Список літератури для оформлення роботи і підготовки
Теоретичного матеріалу
Опрацювати розділ «Карбон» посібника [1] та 5.7.1, 5.7.2 (стор.486-470), 5.7.3, 5.7.4 посібника [3].
Лабораторна робота 17 Добування і дослідження властивостей аліфатичних вуглеводнів
Теоретична частина
Вуглеводні, молекули яких мають незамкнений (відкритий) карбоновий ланцюг, називаються аліфатичними (ациклічними). Аліфатичні вуглеводні з одинарними зв’язками між атомами Карбону називаються насиченими (алканами), а з подвійними або потрійними зв’язками між атомами Карбону – ненасиченими.
Алкани, або парафінові вуглеводні (від лат.parum affinis – позбавлений спорідненості), мають загальну формулу 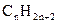 . У гомологічних рядах алканів, як і в гомологічних рядах інших вуглеводнів, із зростанням молекулярної маси відбувається закономірна зміна фізичних властивостей гомологів. Наприклад, у гомологічному ряді метану спостерігається зростання температур кипіння і плавлення: нижчі гомологи метану
. У гомологічних рядах алканів, як і в гомологічних рядах інших вуглеводнів, із зростанням молекулярної маси відбувається закономірна зміна фізичних властивостей гомологів. Наприклад, у гомологічному ряді метану спостерігається зростання температур кипіння і плавлення: нижчі гомологи метану 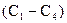 є газами, проміжні
є газами, проміжні  – рідинами, вищі (
– рідинами, вищі ( 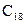 і більше) – твердими речовинами за стандартних умов. Густина насичених вуглеводнів зростає зі збільшенням розмірів молекул, проте всі вони легші за воду. Газоподібні та тверді алкани не мають запаху, рідкі – мають характерний «бензиновий» запах.
і більше) – твердими речовинами за стандартних умов. Густина насичених вуглеводнів зростає зі збільшенням розмірів молекул, проте всі вони легші за воду. Газоподібні та тверді алкани не мають запаху, рідкі – мають характерний «бензиновий» запах.
Алкани – достатньо інертні сполуки, що зумовлено високою міцністю σ-зв’язків 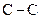 (
( 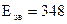 кДж/моль) та
кДж/моль) та 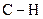 (
(  кДж/моль), а також їх неполярністю. Для розриву цих зв’язків та ініціювання реакції потрібні достатньо жорсткі умови (висока температура, дія ультрафіолетового опромінювання, дія активних вільних радикалів тощо). Завдяки насиченості алкани не вступають в реакції приєднання, не реагують з кислотами та лугами, не окиснюються типовими окисниками. Зв’язки
кДж/моль), а також їх неполярністю. Для розриву цих зв’язків та ініціювання реакції потрібні достатньо жорсткі умови (висока температура, дія ультрафіолетового опромінювання, дія активних вільних радикалів тощо). Завдяки насиченості алкани не вступають в реакції приєднання, не реагують з кислотами та лугами, не окиснюються типовими окисниками. Зв’язки 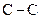 та
та 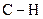 можуть розриватися під дією активних вільних радикалів. Отже, для алканів характерними є реакції, що відбуваються за ланцюговим радикальним механізмом, в яких атоми Гідрогену заміщуються на інші атоми чи групи атомів. Найважливішими реакціями радикального заміщення з розривом зв’язків
можуть розриватися під дією активних вільних радикалів. Отже, для алканів характерними є реакції, що відбуваються за ланцюговим радикальним механізмом, в яких атоми Гідрогену заміщуються на інші атоми чи групи атомів. Найважливішими реакціями радикального заміщення з розривом зв’язків 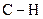 є галогенування при нагріванні або освітленні та нітрування під дією розбавленої нітратної кислоти. Серед реакцій з розривом зв’язків
є галогенування при нагріванні або освітленні та нітрування під дією розбавленої нітратної кислоти. Серед реакцій з розривом зв’язків 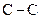 найбільше значення мають ізомеризація і крекінг (термічний і каталітичний).
найбільше значення мають ізомеризація і крекінг (термічний і каталітичний).
|
|
|
Аліфатичні вуглеводні загального складу  з одним подвійним зв’язком називаються алкенами (етиленовими вуглеводнями). Подвійний зв’язок
з одним подвійним зв’язком називаються алкенами (етиленовими вуглеводнями). Подвійний зв’язок  являє собою поєднання σ-зв’язку, утвореного sp2-гібридними орбіталями, та π-зв’язку, утвореного 2р-негібридними орбіталями атома Карбону. Наявність подвійного зв’язку в молекулах алкенів зумовлює їх високу реакційну здатність. Для алкенів типовими є реакції за місцем розриву π-зв’язку: приєднання (гідрування, галогенування, гідратації, гідрогалогенування), окиснення, полімеризації.
являє собою поєднання σ-зв’язку, утвореного sp2-гібридними орбіталями, та π-зв’язку, утвореного 2р-негібридними орбіталями атома Карбону. Наявність подвійного зв’язку в молекулах алкенів зумовлює їх високу реакційну здатність. Для алкенів типовими є реакції за місцем розриву π-зв’язку: приєднання (гідрування, галогенування, гідратації, гідрогалогенування), окиснення, полімеризації.
|
|
|
Реакції окиснення відбуваються під дією водного розчину калій перманганату (м’яке окиснення, реакція Вагнера) або при нагрівання з кислими розчинами калій перманганату чи дихромату (жорстке окиснення). Під час м’якого окиснення (реакція Вагнера) руйнується лише π-зв’язок і утворюються двохатомні спирти:

Внаслідок жорсткого окиснення алкенів відбувається повний розрив подвійного зв’язку з утворенням суміші кетонів, карбонових кислот або карбон(IV) оксиду. Якісними реакціями на алкени є знебарвлення бромної води або розчину калій перманганату.
Добування алкенів ґрунтується на реакціях елімінування алкенів, спиртів чи галогенопохідних (відщеплення). Атоми Карбону при елімінуванні переходять з sp3-гібридного в sp2-гібридний стан. Основними реакціями елімінування є дегідрогалогенування, дегідратація, дегалогенування, дегідрування. У лабораторних умовах для добування етилену застосовують реакцію дегідратації етилового спирту при нагріванні з концентрованою сульфатною кислотою.
|
|
|
Аліфатичні вуглеводні з одним потрійним зв’язком називаються алкінами (ацетиленовими вуглеводнями), вони мають загальну формулу 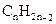 . Потрійний зв’язок
. Потрійний зв’язок 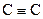 являє собою поєднання σ-зв’язку, утвореного sp- гібридними орбіталями, та двох π-зв’язків, утворених 2р-негібридними орбіталями атома Карбону. Таким чином, алкіни подібно до алкенів виявляють високу реакційну здатність і вступають в реакції приєднання, багато з яких відбуваються у дві стадії: на першій відбувається приєднання до потрійного зв’язку з утворенням подвійного, а на другій – приєднання до подвійного зв’язку з утворенням одинарного.
являє собою поєднання σ-зв’язку, утвореного sp- гібридними орбіталями, та двох π-зв’язків, утворених 2р-негібридними орбіталями атома Карбону. Таким чином, алкіни подібно до алкенів виявляють високу реакційну здатність і вступають в реакції приєднання, багато з яких відбуваються у дві стадії: на першій відбувається приєднання до потрійного зв’язку з утворенням подвійного, а на другій – приєднання до подвійного зв’язку з утворенням одинарного.
Алкіни, які містять потрійний зв’язок на початку карбонового ланцюга 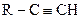 , виявляють слабкі кислотні властивості. Атом Гідрогену при потрійному зв’язку здатен до заміщення на метал під дією сильних основ (NaH, NaNH2), амоніакових розчинів - аргентум(І) оксиду або купрум(І) хлориду.
, виявляють слабкі кислотні властивості. Атом Гідрогену при потрійному зв’язку здатен до заміщення на метал під дією сильних основ (NaH, NaNH2), амоніакових розчинів - аргентум(І) оксиду або купрум(І) хлориду.
Якісними реакціями на алкіни є знебарвлення бромної води або розчину калій перманганату; утворення білого осаду з амоніаковим розчином аргентум(І) оксиду у випадку кінцевого розміщення потрійного зв’язку.
|
|
|
Загальний спосіб добування алкінів – дегідрогалогенування. Найпростіший із алкінів – ацетилен – отримують термічним крекінгом метану або гідролізом кальцій карбіду.
Аліфатичні вуглеводні добре горять на повітрі або в кисні з утворенням карбон(IV) оксиду та води, їх горіння супроводжується виділенням значної кількості теплоти, наприклад, ацетиленово-кисневе полум’я має температуру 28000 С. Характер горіння вуглеводнів залежить від вмісту Карбону: зі збільшенням масової частки Карбону зростає яскравість полум’я і з’являється кіптява. Слід пам’ятати, що суміші газоподібних вуглеводнів, а також пара рідких вуглеводнів з киснем або повітрям є вибухонебезпечними.
Дата добавления: 2019-02-13; просмотров: 153; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
