Контрольні запитання і вправи
1 Які сполуки називають галогенопохідними вуглеводнів?
2 Охарактеризуйте хлороформ та брометан за такими критеріями: а) будова молекули; б) фізичні властивості (температура кипіння, колір, запах, густина, розчинність у полярних та неполярних розчинниках); в) фізіологічна дія на організм людини; г) правила зберігання та поводження з ними; д) хімічні властивості; е) практичне використання.
3 Які реакції використовують для виявлення Хлору, Брому, Йоду в органічних сполуках? У чому полягає суть цих реакцій?
4 Порівняти зв’язки 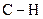 та
та  за довжиною, енергією, полярністю, реакційною здатністю.
за довжиною, енергією, полярністю, реакційною здатністю.
5 Скласти рівняння хімічних реакцій за наведеною схемою:
C2H5NH2
↑
C2H5OH→ C2H5CI→C4H10
↓ ↑
C2H4 →C2H4CI2,
зазначити умови перебігу хімічних реакцій, їх тип і назви речовин.
Практична частина
Мета роботи –дослідити властивості галогенопохідних алканів і ознайомитися з лабораторними способами їх добування.
Обладнання і реактиви: лабораторний штатив, штатив для пробірок, пробірки, гумові пробки, колба Вюрца (100мл), ділильна лійка, нагрівний прилад, сірники, конічна пробірка, градуйовані конічні пробірки, хімічний стакан (50 мл), пінцет, скальпель, фільтрувальний папір, тигельні щипці, мікрошпатель, технохімічні терези, льод, універсальний індикаторний папір, металічний натрій, натрій хлорид (крист.), калій бромід (крист.), етиловий спирт, толуен, бромна вода, соняшникова олія, розчини: сульфатної кислоти (ρ=1,84 г/см3), нітратної кислоти (2 М), аргентум нітрату (0,1 М).
|
|
|
Увага! Всі досліди необхідно виконувати у витяжній шафі!
ДОСЛІД 3.18.1 Властивості хлороформу
А У три пробірки налити по 1 мл: у першу – дистильованої води, у другу – етилового спирту, у третю – толуену. В кожну пробірку додати декілька крапель хлороформу, закрити їх пробками, ретельно збовтати і поставити в штатив на півхвилини. Через зазначений час подивитися на вміст пробірок. Що спостерігається? Зробити висновок про розчинність хлороформу у полярних і неполярних розчинниках.
Б У три пробірки налити по 1 мл хлороформу і одразу закрити їх пробками. У першу пробірку до хлороформу додати 1 мл бромної води, у другу – декілька крапель соняшникової олії, у третю – декілька кристаликів натрій хлориду. Закрити пробірки пробками, ретельно збовтати їх і поставити у штатив на півхвилини. Через зазначений час розглянути вміст пробірок. Зробити висновок про розчинність у хлороформі речовин полярної і неполярної будови.
В Налити в пробірку 0,5 мл хлороформу. Кінець мідного дроту зігнути петелькою або у вигляді спіралі діаметром 1-2 мм. Прожарювати дротину у полум’ї до того часу, поки полум’я не перестане забарвлюватись, охолодити її. Внести дротину в хлороформ , який міститься у пробірці, і знову – в полум’я. Що спостерігається? Зелене забарвлення полум’я свідчить про наявність атома Галогену у складі хлороформу. З якою метою можна використовувати проведену реакцію?
|
|
|
Г Налити в пробірку 0,5 мл хлороформу і 3-4 мл етилового спирту, додати шматочок очищеного натрію завбільшки з невеличку горошину. Що спостерігається? Після повного розчинення натрію і припинення виділення водню розбавити суміш однаковим об’ємом дистильованої води і підкислити розчином нітратної кислоти до кислої реакції (перевірити за допомогою універсального індикаторного паперу). Додати у суміш декілька крапель розчину аргентум нітрату. Що спостерігається? З якою метою можна використовувати проведену реакцію? Пояснити результати досліду, скласти рівняння відповідних реакцій.
ДОСЛІД 3.18.2 Добування і властивості брометану
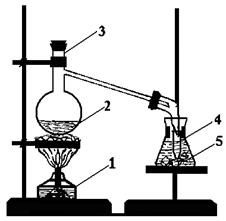
Приготувати суміш, яка складається з 10 мл концентрованої сульфатної кислоти та 10 мл етилового спирту. Що спостерігається при змішуванні цих речовин? Чому? Який запах має утворена суміш? Про що це свідчить? Охолодити суміш. Закріпити колбу Вюрца в лапці штатива і налити в неї приготовану суміш. Налити також в реакційну колбу 5 мл дистильованої води і насипати 5-7 г калій броміду (наважку зважити на технохімічних терезах). Закрити колбу пробкою. У конічну пробірку-приймач налити 2мл дистильованої води, помістити її в хімічний стакан з льодом. Отвір газовідвідної трубки, сполученої з реакційною колбою, занурити у пробірку-приймач (рис. 3.2 ).
|
|
|
Почати обережно нагрівати реакційну колбу на невеличкому полум’ї. Через декілька хвилин спостерігати появу маслянистих крапель брометану у пробірці-приймачі під шаром води. Коли у пробірку-приймач перестануть потрапляти краплі брометану, вийняти газовідвідну трубку з приймача, а потім припинити нагрівання реакційної колби.
За допомогою ділильної лійки відділити брометан.
Дослідити розчинність брометану в різних розчинниках та його розчинювальну здатність (див. дослід 3.18.1).
| Зробити висновки про розчинність брометану у неполярних та полярних розчинниках, а також його розчинювальну здатність. Довести наявність Брому у складі брометану двома способами (див. дослід 3.18.1).
Пояснити результати досліду, скласти рівняння відповідних реакцій. | ||
| Рисунок 3.2 - Синтез брометану: 1 - нагрівний прилад; 2 - реакційна суміш; 3 - колба Вюрца; 4 - пробірка-приймач; 5 - охолоджувальна суміш |
Дата добавления: 2019-02-13; просмотров: 141; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
