Список літератури для оформлення роботи і підготовки
теоретичного матеріалу
Опрацювати розділ «Родина Феруму» посібника[1], 5.6.4 посібника [3].
Лабораторна робота 15 Дослідження властивостей міді та сполук Купруму
Теоретична частина
До ІВ-групи, крім Купруму Cu, належать також елементи Аргентум Ag та Аурум Au. Вони є d-елементами, атоми яких мають (n-1)d10ns1- конфігурацію валентних рівнів. Ці елементи є металами з невисокою хімічною активністю: на відміну від більшості металів вони характеризуються позитивними значеннями стандартних електродних потенціалів.
У своїх сполуках Купрум виявляє ступені окиснення +1, +2, більш характерними для нього є сполуки зі ступенем окиснення +2.
Мідь – метал світло-рожевого кольору, легко піддається прокатуванню в тонкі листи. Він має гарну тепло - та електропровідність, поступаючись у цих властивостях лише сріблу.
У хімічному відношенні мідь є малоактивним металом. Проте з галогенами вона реагує вже за кімнатної температури. У сухому повітрі мідь вкрита тонкою плівкою оксидів (вони надають їй більш темного забарвлення), яка забезпечує для міді гарний захист від подальшого окиснення. У присутності вологи та вуглекислого газу поверхня міді вкривається зеленуватим нальотом купрум(ІІ) дигідроксид карбонату 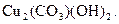 При нагріванні в температурному інтервалі від 2000 С до 3750 С мідь окиснюється до купрум(ІІ) оксиду, а при більш високих температурах на її поверхні утворюється суміш купрум(І) та купрум(ІІ) оксидів.
При нагріванні в температурному інтервалі від 2000 С до 3750 С мідь окиснюється до купрум(ІІ) оксиду, а при більш високих температурах на її поверхні утворюється суміш купрум(І) та купрум(ІІ) оксидів.
|
|
|
Мідь не витісняє водень з кислот, оскільки знаходиться в ряді напруг металів після водню. В дуже концентрованій хлоридній кислоті мідь може бути розчинена з утворенням комплексної сполуки:
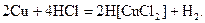
У концентрованій сульфатній кислоті при нагріванні та концентрованій і розбавленій нітратній кислотах мідь розчиняється, окиснюючись при цьому до +2.
Гідроксиди характеризується слабовираженими амфотерними властивостями.
Для  характерно утворення комплексних сполук як катіонного, так і аніонного типу. Координаційні числа в комплексних сполуках такі: для
характерно утворення комплексних сполук як катіонного, так і аніонного типу. Координаційні числа в комплексних сполуках такі: для 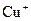 – 2 (наприклад
– 2 (наприклад 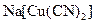 ), для
), для 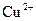 - 4 (наприклад
- 4 (наприклад 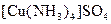 ).
).
Контрольні запитання і вправи
1 Що є спільного в будові електронних оболонок атомів елементів ІВ-групи? Скласти електронні формули Купруму, Аргентуму, Ауруму.
2 У чому можна розчинити прості речовини, утворені елементами підгрупи Купруму? Скласти відповідні рівняння хімічних реакцій.
3 Скласти схему електролізу розчину купрум(ІІ) сульфату на інертних електродах.
4 Купрум(ІІ) гідроксид розчиняється в розчинах кислот і в розчині амоніаку. Чи є однотипними ці реакції? Скласти рівняння відповідних хімічних реакцій у молекулярному та йонному вигляді.
|
|
|
Практична частина
Мета роботи –дослідити хімічні властивості міді та сполук Купруму.
Обладнання і реактиви: лабораторний штатив, штатив для пробірок, пробірки, пробіркотримач, нагрівний прилад, сухе пальне, мідь, купрум(ІІ) оксид, розчини: натрій гідроксиду (2 Н), хлоридної кислоти (2 Н, ρ=1,19 г/см3), сульфатної кислоти (2 Н, ρ=1,84 г/см3), нітратної кислоти (2 Н, ρ=1,4 г/см3), амоніаку (2 Н), калій йодиду (0,5 Н), натрій тіосульфату (0,5Н), купрум(ІІ) сульфату(0,5 Н), натрій сульфіту (0,5 Н).
ДОСЛІД 3.15.1 Відношення міді до кислот
А У три пробірки помістити по невеличкому шматочку мідного дроту і долити по 0,5 мл 2 Н розчинів кислот: у першу – хлоридної, у другу – сульфатної, у третю – нітратної. Чи з’явилося у пробірках синьо-блакитне забарвлення, характерне для йона Cu2+?
Увага! Дослід необхідно виконувати у витяжній шафі!
Б Дослід, аналогічний А, провести з концентрованими кислотами без нагрівання та при обережному нагріванні. Що спостерігається? Скласти рівняння хімічних реакцій, ураховуючи, що при взаємодії міді з розбавленою нітратною кислотою утворюється нітроген(ІІ) оксид. Зробити висновок про особливості взаємодії міді з кислотами.
|
|
|
ДОСЛІД 3.15.2 Взаємодія купрум(ІІ) оксиду з кислотами
У дві пробірки внести 2-3 мікрошпателі купрум(ІІ) оксиду і долити по 1 мл 2 Н кислот, у першу пробірку – хлоридної, у другу – сульфатної. Збовтати пробірки, поставити їх у штатив на 5 хвилин. Через зазначений час розглянути забарвлення розчинів у пробірках.
Скласти рівняння реакцій взаємодії купрум(ІІ) оксиду з кислотами. Зробити висновок про хімічний характер оксиду.
ДОСЛІД 3.15.3 Добування купрум(ІІ) гідроксиду і дослідження його властивостей
У пробірку налити 1 мл розчину купрум(ІІ) сульфату і долити 2 Н розчин лугу. Визначити колір осаду, що утворився. Осад розділити на частини у три пробірки. Обережно нагріти першу пробірку. Як змінюється колір осаду при нагріванні? Чому? Скласти рівняння реакцій утворення купрум(ІІ) гідроксиду та його розкладу.
У другу пробірку налити 1 мл 2 Н розчину сульфатної кислоти. У третю – 1 мл 2 Н розчину лугу. В якому випадку відбувається розчинення осаду? Зробити висновок про властивості купрум(ІІ) гідроксиду. Скласти рівняння хімічних реакцій.
|
|
|
ДОСЛІД 3.15.4 Добування основного купрум(ІІ) карбонату
У пробірку налити 1 мл розчину купрум(ІІ) сульфату, долити 2 мл розчину натрій карбонату. Що спостерігається? Чому при взаємодії солей купруму з розчином натрій карбонату в осад не випадає середня сіль купрум(ІІ) карбонат? Скласти рівняння реакції взаємодії купрум(ІІ) сульфату з натрій карбонатом за участю води.
ДОСЛІД 3.15.5 Добування купрум(І) йодиду
У пробірку налити по 1 мл розчину купрум(ІІ) сульфату та калій йодиду. Відмітити утворення осаду і забарвлення вмісту пробірки у жовтий колір. За допомогою йодкрохмального паперу довести, що поява жовтого забарвлення зумовлена утворенням йоду.
Для визначення кольору осаду купрум(І) йодиду необхідно перевести вільний йод, який має жовте забарвлення, у безбарвний йодид-іон. Для цього необхідно до вмісту пробірки додавати по краплях розчин натрій сульфіту до зникнення жовтого забарвлення. Який колір має купрум(І) йодид? Залишити пробірку для проведення іншого досліду. Скласти рівняння хімічних реакцій: а) взаємодії купрум(ІІ) сульфату з калій йодидом; б) взаємодії йоду з натрій сульфітом. Чим пояснюється стійкість купрум(І) йодиду?
ДОСЛІД 3.15.6 Комплексні сполуки Купруму(І) та (ІІ)
А У пробірку з осадом, отриманим у досліді 3.15.5, додати декілька крапель розчину натрій тіосульфату. Спостерігати повне розчинення осаду. Чим пояснюється розчинення купрум(І) йодиду у розчині натрій тіосульфату? Скласти рівняння хімічної реакції, враховуючи, що йони 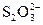 є монодентатними лігандами, а координаційне число
є монодентатними лігандами, а координаційне число 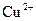 – йону дорівнює 2.
– йону дорівнює 2.
Увага! Дослід необхідно виконувати у витяжній шафі!
Б У пробірку налити 0,5 мл розчину купрум(ІІ) сульфату. Потім по краплях добавляти розчин амоніаку до повного розчинення осаду основної солі 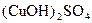 , що утворюється під час додавання перших крапель розчину амоніаку. Відзначити колір вихідного розчину купрум(ІІ) сульфату і розчину, що утворився після розчинення осаду
, що утворюється під час додавання перших крапель розчину амоніаку. Відзначити колір вихідного розчину купрум(ІІ) сульфату і розчину, що утворився після розчинення осаду 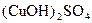 . Які йони зумовлюють забарвлення вихідного та утвореного розчинів? Скласти рівняння реакцій: а) утворення основного купрум (ІІ) сульфату внаслідок взаємодії купрум (ІІ) сульфату з розчином амоніаку; б) розчинення основного купрум(ІІ) сульфату в надлишку амоніаку з одночасним утворенням комплексної солі і комплексної основи купруму(ІІ); в) дисоціації комплексних сполук купруму(ІІ).
. Які йони зумовлюють забарвлення вихідного та утвореного розчинів? Скласти рівняння реакцій: а) утворення основного купрум (ІІ) сульфату внаслідок взаємодії купрум (ІІ) сульфату з розчином амоніаку; б) розчинення основного купрум(ІІ) сульфату в надлишку амоніаку з одночасним утворенням комплексної солі і комплексної основи купруму(ІІ); в) дисоціації комплексних сполук купруму(ІІ).
Дата добавления: 2019-02-13; просмотров: 170; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
