Контрольні запитання і вправи
1 Складіть схеми корозійного гальванічного елемента, утвореного залізом, що контактує з міддю в кислому середовищі. Складіть рівняння реакцій, що відбуваються на катодній та анодній ділянках елемента.
2 Поясніть сутність процесів корозії, покритого цинком, і заліза, покритого оловом. Складіть рівняння відповідних реакцій.
3 Який метал у парі залізо-нікель буде розчинятися в розбавленому розчині оцтової кислоти? З поверхні якого металу буде виділятися водень?
Практична частина
Мета роботи –ознайомитися з процесами електрохімічної корозії металічних виробів і методами захисту їх від корозії.
Обладнання і реактиви: штатив для пробірок, пробірки, скляна паличка, наждак, хімічний стакан (50 мл) цинк (гранули), мідний дріт, смужка оцинкованого заліза, смужка лудженого заліза, цинкова пластина, свинцева пластина, розчини: сульфатної кислоти (10%), нітратної кислоти (конц.), оцтової кислоти (10%), калій гексаціаноферату(ІІІ) (0,1 М), калій йодиду (0,5М).
ДОСЛІД 3.11.1 Вплив гальванічної пари на процес розчинення металу
Налити у пробірку 1 мл сульфатної кислоти і помістити гранулу цинку. Спостерігати виділення водню. Пояснити можливість перебігу реакції. Доторкнутися мідним дротом до гранули цинку. З поверхні якого металу спостерігатиметься виділення водню? Складіть схему утвореного мідно-цинкового гальванічного елемента.
ДОСЛІД 3.11.2 Корозія оцинкованого та лудженого заліза
|
|
|
Наповнити наполовину дві пробірки дистильованою водою, додати в кожну пробірку 2-3 краплі розчину калій гексаціаноферату(ІІІ) (гексаціаноферат(III) - іон утворює з катіонами 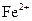 сполуку, яка має інтенсивне синє забарвлення). Перемішати розчини скляною паличкою. В одну пробірку помістити смужку оцинкованого заліза, в іншу – лудженого. В якій пробірці спостерігається поява синього забарвлення у розчині навколо металевої пластинки? Пояснити причину появи у розчині катіонів
сполуку, яка має інтенсивне синє забарвлення). Перемішати розчини скляною паличкою. В одну пробірку помістити смужку оцинкованого заліза, в іншу – лудженого. В якій пробірці спостерігається поява синього забарвлення у розчині навколо металевої пластинки? Пояснити причину появи у розчині катіонів 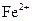 . Скласти рівняння реакцій, що відбуваються на катодній та анодній ділянках гальванічних пар:
. Скласти рівняння реакцій, що відбуваються на катодній та анодній ділянках гальванічних пар: 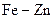 та
та 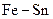 .
.
ДОСЛІД 3.11.3 Протекторний захист
У два стакани налити розчин оцтової кислоти. В один стакан додати декілька крапель розчину калій йодиду ( 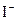 - іони утворюють з катіонами
- іони утворюють з катіонами 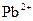 малорозчинну сполуку
малорозчинну сполуку 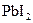 жовтого кольору) і помістити в нього цинкову та свинцеву пластини, так, щоб вони торкалися одна одної. В інший стакан із розчином оцтової кислоти помістити тільки свинець. У якому випадку швидше утвориться плюмбум(ІІ) йодид? Пояснити результати спостережень, скласти рівняння відповідних реакцій. Який метал відіграє роль протектора?
жовтого кольору) і помістити в нього цинкову та свинцеву пластини, так, щоб вони торкалися одна одної. В інший стакан із розчином оцтової кислоти помістити тільки свинець. У якому випадку швидше утвориться плюмбум(ІІ) йодид? Пояснити результати спостережень, скласти рівняння відповідних реакцій. Який метал відіграє роль протектора?
ДОСЛІД 3.11.4 Пасивація металів, роль захисних плівок у процесі корозії
|
|
|
Увага! Досліди з концентрованими розчинами кислот необхідно виконувати у витяжній шафі!
Удві пробірки на 1/3 налити розчин сульфатної кислоти. Очистити наждаком два стальних цвяхи. Один цвях пасивувати, помістивши його в пробірку з концентрованим розчином нітратної кислоти. Сполоснути цвях водою і знову помістити в нітратну кислоту. Промити цвях.
В одну пробірку з розчином сульфатної кислоти помістити цвях, який піддали пасивації, в іншу – цвях, який не піддавали пасивації. Звернути увагу на швидкість виділення водню з поверхні заліза в обох пробірках.
Пояснити результати спостережень, відзначити роль оксидної плівки відносно корозії. Скласти рівняння відповідних хімічних реакцій.
Дата добавления: 2019-02-13; просмотров: 119; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
