Література для оформлення роботи і підготовки
теоретичного матеріалу
Опрацювати підрозділи 11.2 - 11.4 підручника [6 ] та підрозділи 4.3 - 4.5 посібника [3].
Лабораторна робота 11 Корозія металів
Теоретична частина
Корозія - це гетерогенний окисно-відновний процес, що самочинно відбувається на межі поділу двох фаз: метал-газ чи метал-розчин і поєднує, як правило, хімічну взаємодію та електрохімічні явища.
Залежно від механізму перебігупроцесу розрізнюють хімічну та електрохімічнукорозію.
Хімічна корозія - це процес самочинного руйнування металів у атмосфері окиснювальних газів за умов високих температур чи у середовищі рідких неелектролітів.
Хімічній корозії притаманні певні ознаки:
- безпосереднє передавання електронів атомами металів окиснику, що знаходиться у зовнішньому середовищі;
- відсутність у системі електричного струму.
Залежно від умов перебігу хімічна корозія поділяється на типи:
- газова, яка виникає при високих температурах у атмосфері сухих агресивних газів ( F2, Cl2, SO2, NO2, H2S тощо), наприклад: корозія двигунів внутрішнього згоряння, деталей турбін, ракетних двигунів;
- корозія у неелектролітах - струмонепровідних рідинах (Br2, нафта і нафтопродукти).
Наведемо схему корозії металу в атмосфері кисню:
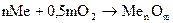 .
.
Електрохімічна корозія - це руйнування металів у середовищах з йонною провідністю, при якому відбувається просторове перенесення електронів і виникнення електричного струму.
|
|
|
Як випливає із визначення, процеси йонізації атомів металу і відновлення окиснювального компонента із корозійного середовища відбуваються хоч і одночасно, однак не в єдиному акті (на різних ділянках), а їх швидкості залежать від величин електродних потенціалів металу.
Сутність електрохімічної корозіїполягає в анодному розчиненні металу ( 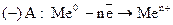 ) на тих ділянках, яким відповідає більш від’ємне значення електродного потенціалу, і катодному відновленні окисника із навколишнього середовища (
) на тих ділянках, яким відповідає більш від’ємне значення електродного потенціалу, і катодному відновленні окисника із навколишнього середовища ( 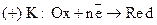 ) на тих ділянках, де електродний потенціал має більш додатне значення, завдяки чому самі катодні ділянки зберігають свою цілісність.
) на тих ділянках, де електродний потенціал має більш додатне значення, завдяки чому самі катодні ділянки зберігають свою цілісність.
Окисниками при електрохімічній корозії найчастіше бувають О2 і Cl2 у вологому повітрі, йони Н+, Fe3+, NO3- тощо. Взагалі середовищем електрохімічної корозії може бути: електроліт (водні розчини кислот, солей, лугів, морська вода); вологий газ; вологий ґрунт.
Здебільшого на катодних ділянках спостерігається йонізація (відновлення) кисню відповідно до схем:
– у нейтральному чи лужному середовищі:
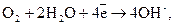
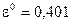 В;
В;
– у кислому середовищі:
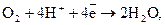
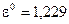 В;
В;
а також виділення водню:
|
|
|
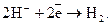
Корозійний процес, що супроводжується поглинанням і відновленням газового кисню, називається корозією з кисневою деполяризацією.
Корозійний процес, при якому відновлюються йони Гідрогену і виділяється газуватий водень, називається корозією з водневою деполяризацією.
Поряд з електрохімічними процесами під час корозії відбуваються вторинні хімічні реакції, наприклад, взаємодія йонів металу з гідроксильними йонами:
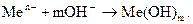
Утворена основа протягом часу може піддаватися поступовій дегідратації:
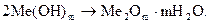
Корозійні електрохімічні процеси подібні до тих, що відбуваються у гальванічних елементах. Однак на відміну від звичайних гальванічних елементів у корозійних гальванічних елементах відсутній зовнішній ланцюг, а електрони переходять безпосередньо з анода на катод без участі сполучного електронного провідника.
Захист від корозії – це комплекс заходів, спрямованих на збільшення працездатності та надійності металів і конструкційних матеріалів за умов їх експлуатації.
Вибір конкретного методу захисту зумовлюється його ефективністю та економічною доцільністю. Залежно від специфіки всі методи поділяються на три великі групи: дія на метал, дія на корозійне середовище та електрохімічні методи.
|
|
|
Дата добавления: 2019-02-13; просмотров: 134; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
