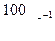Література для оформлення роботи і підготовки
теоретичного матеріалу
Опрацювати підрозділи 5.1-5.3 підручника [6] та 2.1.1 і 2.1.2 посібника [3].
Лабораторна робота 2 Швидкість хімічних реакцій
Теоретична частина
Швидкість гомогенної хімічної реакції  визначається за зміною концентрації реагуючих речовин або продуктів реакції за одиницю часу (
визначається за зміною концентрації реагуючих речовин або продуктів реакції за одиницю часу ( 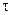 ) при сталому об`ємі реакційної системи.
) при сталому об`ємі реакційної системи.
Швидкість реакції залежить від: 1) концентрації реагуючих речовин; 2) природи реагуючих речовин; 3) температури реакційної суміші; 4) наявності каталізатора у системі.
Якщо один із реагентів перебуває у твердій фазі, то швидкість хімічної реакції залежить від загальної поверхні твердої речовини (або від ступеня його подрібненості). Під час перебігу реакції у газовій фазі швидкість реакції визначається парціальним тиском реагентів.
Вплив концентрації реагентів на швидкість хімічної реакції можна описати за допомогою закону діючих мас, відкритого К.М. Гульдбергом та П. Вааге в 1864-1867рр. Для елементарних реакцій він має таке формулювання: швидкість хімічної реакції при даній температурі прямо пропорційна добутку концентрацій реагентів, взятих у степенях, що дорівнюють стехіометричним коефіцієнтам у рівнянні реакції. Для реакції у загальному вигляді 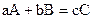 швидкість згідно із законом діючих мас
швидкість згідно із законом діючих мас
можна виразити співвідношенням
 ,
,
де  та
та 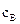 – молярні концентрації реагентів А та В;
– молярні концентрації реагентів А та В;
 – константа швидкості даної реакції, яка чисельно дорівнює
– константа швидкості даної реакції, яка чисельно дорівнює  , якщо концентрації реагентів дорівнюють одиниці.
, якщо концентрації реагентів дорівнюють одиниці.
|
|
|
Вплив температури на швидкість хімічної реакції можна описати за допомогою правила Вант-Гоффа.
Згідно із правилом Вант-Гоффа при підвищенні (зниженні) температури на 100 С швидкість хімічної реакції зростає (зменшується) в 2-4 рази:
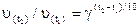 або
або 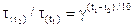 ,
,
де 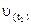 та
та 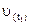 – швидкості хімічної реакції при відповідних температурах;
– швидкості хімічної реакції при відповідних температурах; 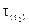 та
та 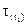 – час перебігу хімічної реакції при відповідних температурах;
– час перебігу хімічної реакції при відповідних температурах;  - температурний коефіцієнт Вант-Гоффа, який може набувати значення в інтервалі 2-4.
- температурний коефіцієнт Вант-Гоффа, який може набувати значення в інтервалі 2-4.
Каталізом називають зміну швидкості хімічної реакції, яка відбувається за наявності каталізаторів. Каталізатори – речовини, які змінюють швидкість хімічної реакції внаслідок багаторазової участі у проміжній хімічній взаємодії з реагентом реакції, проте після кожного циклу проміжної взаємодії відновлюють свій хімічний склад. Розрізняють гомогенний і гетерогенний каталіз. У гомогенному каталізі каталізатор і реагуючі речовини перебувають в одній фазі, а при гетерогенному – у різних фазах.
Контрольні запитання і вправи
1 Які фактори і яким чином впливають на швидкість хімічної реакції?
|
|
|
2 Розрахуйте, у скільки разів збільшиться швидкість хімічної реакції при підвищенні температури на 400С, якщо температурний коефіцієнт реакції дорівнює 3.
3 У 10 л міститься 4 моль речовини А та 5 моль речовини В. Якою буде концентрація цих речовин через 4 с, якщо середня швидкість реакції 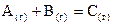 становить
становить 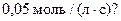
Практична частина
Мета роботи – вивчити вплив концентрації, температури, каталізатора та величини поверхні реагуючих речовин на швидкість хімічної реакції.
Обладнання і реактиви: секундомір, термостат (три стакани місткістю 200 мл), термометр на 500С, електрична плитка, колба з термостійкого скла, бюретки (100мл), фільтрувальний папір, скляні палички, пробірки; розчини: натрій тіосульфату (0,5 Н), сульфатної кислоти (2 Н), хлоридної кислоти (ρ=1,19г/см3), ферум(ІІІ) хлориду (0,5 Н), амоній тіоціонату (0,5 Н), купрум(ІІ) сульфату(0,5 Н).
ДОСЛІД 3.2.1 Вплив концентрації реагуючих речовинна швидкість хімічної реакції
Залежність швидкості хімічної реакції від концентрації реагуючих речовин можна вивчати на прикладі реакції взаємодії розчину натрій тіосульфату та сульфатної кислоти
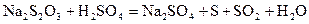
при різних концентраціях натрій тіосульфату. Швидкість реакції вимірюється часом від початку зливання розчинів до появи у всіх дослідах однакової опалесценції від утвореної сірки.
|
|
|
Спочатку провести якісний дослід: у пробірку внести 5-10 крапель розчину натрій тіосульфату та 3-5 крапель розчину сульфатної кислоти (додавати сульфатну кислоту потрібно так, щоб її краплі одразу потрапили в розчин натрій тіосульфату, а не стікали по стінках пробірки). Спостерігати появу помутніння внаслідок утворення сірки.
Приготувати три розчини натрій тіосульфату різної концентрації. Для цього в три сухі пробірки внести: в першу – 5 крапель розчину натрій тіосульфату та 10 крапель води, у другу – 10 крапель розчину натрій тіосульфату та 5 крапель води, в третю – 15 крапель розчину натрій тіосульфату. Першу та другу пробірки обережно струснути. Таким чином, концентрація 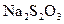 становитиме у першій пробірці С, у другій пробірці – 2С, у третій пробірці 3С.
становитиме у першій пробірці С, у другій пробірці – 2С, у третій пробірці 3С.
У першу пробірку додати одну краплю розчину сульфатної кислоти, відмітити час за секундоміром від початку потрапляння краплі у пробірку і до появи помітної опалесценції. Провести аналогічні досліди в другій та третій пробірках.
За даними дослідів розрахувати величини, пропорційні швидкості хімічної реакції. Результати записати в таблицю за такою формою:
|
|
|
| Номер пробірки | Об’єм, кількість крапель | Концентрація розчину Na2S2O3
| Час до початку помутніння, с | Величина, пропорційна швидкості,
| ||
| Na2S2O3 | H2O | H2SO4 | ||||
| 1 | 5 | 10 | 1 | С | ||
| 2 | 10 | 5 | 1 | 2С | ||
| 3 | 15 | - | 1 | 3С | ||
Побудувати графік залежності швидкості хімічної реакції від концентрації Na2S2O3, відкладаючи на осі абсцис концентрацію Na2S2O3, а на осі ординат – величину, пропорційну швидкості. На підставі отриманого графіка зробити висновок про вплив концентрації на швидкість хімічної реакції. Скласти рівняння реакції і вираз закону діючих мас.
ДОСЛІД 3.2.2 Вплив температури на швидкість хімічної реакції
Дослідження впливу температури на швидкість хімічної реакції також можна провести на прикладі реакції між натрій тіосульфатом та сульфатною кислотою. Приготувати три розчини натрій тіосульфату однакової концентрації. Для цього в три сухі пробірки внести в кожну по 5 крапель розчину натрій тіосульфату та 10 крапель води і обережно струснути.
А Відмітити кімнатну температуру. В одну пробірку з розчином натрій тіосульфату додати 1 краплю сульфатної кислоти і відмітити час від потрапляння краплі в розчин до появи опалесценції.
Б Приготувати термостат: змішати у хімічному стакані воду кімнатної температури з гарячою водою, щоб температура стала вища за кімнатну на 100С, і поставити в неї пробірку з розчином натрій тіосульфату. Через 5 хвилин додати в пробірку 1 краплю сульфатної кислоти і відмітити час перебігу реакції при даній температурі. Вийняти цю пробірку зі стакана.
В Провести дослід, аналогічний досліду Б, змішуючи воду у термостаті таким чином, щоб її температура була вища за кімнатну на 200С.
Результати дослідів записати в таблицю за такою формою:
| Дослід | Температура досліду t ,0C | Час перебігу реакції τ, c | Температурний коефіцієнт γ |
| А | |||
| Б | |||
| В |
Розрахувати температурний коефіцієнт швидкості реакції γ:
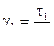 ,
, 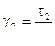 ,
, 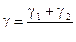 .
.
Зробити висновок про вплив температури на швидкість хімічної реакції.
ДОСЛІД 2.2.3 Вплив каталізатора на швидкість хімічної реакції
У пробірку налити 1 мл розчину амоній тіоціонату та долити розчин ферум(ІІІ) хлориду до появи криваво-червоного забарвлення. Розлити отриманий розчин порівну у дві пробірки. В одну пробірку додати 10 крапель натрій тіосульфату і за допомогою секундоміра встановити час, необхідний для повного знебарвлення її вмісту. В другу пробірку додати 10 крапель натрій тіосульфату і одночасно одну краплю розчину купрум(ІІ) сульфату. За допомогою секундоміра встановити час, необхідний для повного знебарвлення її вмісту. Відмітити спостереження. Скласти рівняння хімічних реакцій: а) взаємодії ферум(ІІІ) хлориду з амоній тіоціонатом, внаслідок якого утворюється Fe(SCN)3 червоного кольору; б) відновлення феруму(ІІІ) до феруму(ІІ) натрій тіосульфатом, що відбувається за рівнянням:
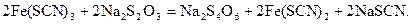 Яке забарвлення має
Яке забарвлення має 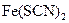 ? Яка речовина є каталізатором у цьому досліді? Зробити висновок про вплив каталізатора на швидкість хімічної реакції.
? Яка речовина є каталізатором у цьому досліді? Зробити висновок про вплив каталізатора на швидкість хімічної реакції.
ДОСЛІД 2.2.4 Вплив величини поверхні реагуючих
Дата добавления: 2019-02-13; просмотров: 132; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!