А) Оценка сосудистого компонента гемостаза
Для оценки состояния сосудистого компонента гемостаза применяют пробы:
-щипка,
- жгута (проба Кончаловского), пробу Нестерова.
Проба щипка. Врач собирает под ключицей кожу и делает щипок. В норме изменений кожи не происходит. При снижении резистентности капилляров на месте щипка появляются петехии или кровоподтеки, особенно через 24 часа.
Проба жгута, или манжеточная проба (проба РумпеляЛееде-Кончаловского). Отступив на 2 см книзу от локтевого сгиба, очерчивают на внутренней поверхности предплечья круг диаметром 5 см. На плечо накладывают манжету тонометра, соединяют с манометром и поддерживают давление на уровне 90-100 мм рт.ст. в течение 5 мин. Затем манжету снимают и в течение 5 минут ждут восстановления кровотока в руке, после чего подсчитывают количество петехий в очерченном круге.
В норме число петехий не превышает 10;
при слабо положительной пробе количество петехий – 11-20;
при положительной – 20-30 петехий;
при резко положительной – количество 30 петехий и более.
Количество петехий более 10 свидетельствует о снижении резистентности стенки капилляров, что может быть связано с нарушением функционального состояния тромбоцитов, снижением их количества и ангиотрофической функции тромбоцитов, а также с повышением проницаемости капилляров при различных патологических процессах (васкулиты, вазопатии).
Проба Нестерова – оценка проницаемости и резистентности капилляров с помощью аппарата Нестерова. На кожу внутренней стороны предплечья накладывают баночку аппарата Нестерова, под которой создают разрежение воздуха на 0,4 атм. в течение 3 мин. Оценка результатов пробы оценивается 4 степенями по выраженности гиперемии и количеству петехий на опытном поле.
|
|
|
0 степень – на бледном или слегка гиперемированном фоне единичные мелкоточечные кровоизлияния (петехии до 20 шт.).
1 степень – на гиперемированном фоне множественные (2040) петехии.
2 степень – на интенсивно гиперемированном фоне множественные слитые геморрагии.
3 степень – сплошное кровоизлияние.
Примечание: 0-1 степени пробы Нестерова свидетельствуют о нормальной проницаемости и резистентности капилляров; 2-3 степени – о повышении проницаемости и снижении резистентности капилляров.
Б) Оценка тромбоцитарного компонента гемостаза
Применяются следующие лабораторные тесты:
определение длительности кровотечения по Дьюке;
подсчет количества тромбоцитов в крови;
оценка адгезивности тромбоцитов;
исследование агрегационных свойств тромбоцитов;
определение ретракции кровяного сгустка.
Время кровотечения по Дьюке – определение длительности кровотечения из поверхностных микрососудов мочки уха или из пальца) после нарушения их целостности с помощью скарификатора. Каждые 30 сек. промокают каплю крови бумагой, до тех пор, пока кровь уже не появляется (в норме – 2-5 мин.) Увеличение времени свидетельствует о наличии тромбоцитопении, тромбоцитопатии, болезни Виллебранда.
|
|
|
Определение количества тромбоцитов– в норме (150 – 450) × 109 /л. Тромбоциты встречаются в мазке крови либо в одиночку, либо чаще разбросаны кучками между эритроцитами. По величине тромбоциты равны приблизительно 1/3—1/4 эритроцита. Ядра в них нет. Тромбоциты окрашиваются в розовато-фиолетовый цвет, имеют вид округлых образований размером 2-4 мкм.
В обычно окрашенном мазке крови подсчитать тромбоциты не удается, так как на воздухе они легко склеиваются в кучки. Существуют способы для предупреждения склеивания. Для этого капилляр Панченкова промывают 14% раствором магния сульфата. Затем набирают в него 25 делений (до метки 75) этого реактива и переносят на дно серологической пробирки. Кровь из пальца берут тем же капилляром до метки «0» (К) и перемешивают ее с реактивом. Параллельно берут кровь для подсчета эритроцитов. Из смеси крови с раствором сульфата магния готовят тонкие мазки. Высушивают на воздухе, фиксируют и окрашивают краской Романовского в течение 1-2 ч. Окрашенный мазок микроскопируют с иммерсионной системой (Ув. 7 × 90).
|
|
|
Подсчитывают количество тромбоцитов на 1000 эритроцитов. Определив одновременно в счетной камере число эритроцитов в 1 л исследуемой крови и, зная, сколько тромбоцитов приходится на каждые 1000 эритроцитов, можно легко вычислить количество тромбоцитов в 1 л крови.
Диагностическое значение изменения количества тромбоцитов в крови
Увеличение количества тромбоцитов в крови (тромбоцитоз) наблюдается редко и ввиду несовершенства методики подсчета тромбоцитов и лишено особого диагностического значения. Тромбоцитоз встречается иногда в начальных стадиях хронических лейкозов и, изредка, в начальных стадиях лимфогранулематоза. Небольшой скоропреходящий тромбоцитоз наряду с лейкоцитозом наблюдаетси после значительных острых кровопотерь, после родов, во время менструации.
Гораздо большее диагностическое значение имеет уменьшение числа тромбоцитов в крови (тромбоцитопения). Следует отметить, что уменьшение числа тромбоцитов, хотя и не всегда и не строго параллельно, сопутствует уменьшению числа других элементов крови, в особенности уменьшению количества эритроцитов.
|
|
|
Определение адгезивности тромбоцитовN: 20 – 55%.
Непрямой метод основан на установлении разницы между количествами тромбоцитов в венозной крови до и после ее контакта с какой-либо поверхностью (колонки со стеклянными шариками).

где А – количество тромбоцитов в крови до пропускания, В – после пропускания через колонку.
Определение агрегационных свойств тромбоцитов. Агрегационные свойства тромбоцитов изучают с помощью анализатора агрегации тромбоцитов. Проба служит для оценки сосудисто-тромбоцитарного гемостаза. Агрегатометрия является незаменимым методом в клинической и экспериментальной научно-исследовательской работе для изучения влияния на тромбоциты различных соединений и фармакологических препаратов, а также для исследования механизмов агрегации.
Принцип метода заключается в регистрации агрегации тромбоцитов в результате активации данного процесса добавлением индуктора агрегации (АДФ, коллаген, адреналин и др.) к плазме, обогащенной тромбоцитами.
Кровь для исследования рекомендуется брать утром натощак пункцией иглой локтевой вены (самотеком). Свертывание крови предупреждается 3,8%-м раствором цитрата натрия, добавляемом в соотношении 1:9. Для исключения контактной активации тромбоцитов в работе используется только пластмассовая или силиконированная посуда (кюветы, пробирки, пипетки). Вначале кровь центрифугируют при малых оборотах (15 мин при 1000 об/мин.). При этом отделяется богатая тромбоцитами плазма, которая отбирается в пластмассовые пробирки. Затем оставшуюся кровь снова центрифугируют, но уже при более высоких оборотах (15 мин при 3000 об./мин.). Образующийся после повторного центрифугирования верхний слой является бестромбоцитной плазмой. Плазма, богатая тромбоцитами, используется для исследования их функциональной активности, бестромбоцитная плазма – для калибровки шкалы оптической плотности прибора, и, при необходимости, для разведения богатой тромбоцитами плазмы до стандартного содержания клеток, которое должно составлять (200-250)х109/л.
Мерой агрегационного процесса является графически регистрируемое падение оптической плотности плазмы крови в результате потребления тромбоцитов в агрегатах, образующихся под воздействием индукторов агрегации.

Принцип работы агрегометра
Первой ответной реакцией на добавление индуктора агрегации является изменение формы тромбоцитов, набухание (shape change), их дискоидная форма переходит в сферическую. В этот момент на агрегатограмме может отмечаться кратковременный сдвиг исходной оптической плотности в сторону увеличения. За изменением формы тромбоцитов наступает первая фаза агрегации (первичная агрегация), вызываемая агрегационным средством. Кривая агрегации смещается в сторону снижения оптической плотности. После окончания первичной агрегации крутизна агрегационной кривой понижается (lag phase), за этот период из тромбоцитов освобождаются (реакция освобождения) секретируемые в гранулах биологически активные соединения (АДФ, серотонин, тромбоксаны и пр.), вызывающие новую агрегационную волну (вторичная агрегация, вторая фаза агрегации).
Ось абсцисс соответствует времени измерения, ось ординат – процентам светопропускания плазмы (уровню агрегации). Числовые поля внизу окна отражают время измерения, уровень агрегации в текущий момент времени и измеренную концентрацию тромбоцитов.

Агрегация тромбоцитов, индуцированная АДФ.Нормальная кривая. Первичная агрегация с дезагрегацией.
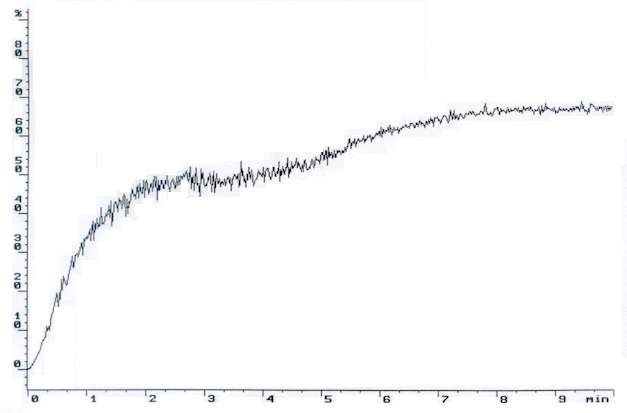
Агрегация тромбоцитов, индуцированная АДФ. Нормальная кривая. Двухфазная агрегация

Патологические кривые агрегации тромбоцитов
Определение ретракции кровяного сгустка. В основе метода лежит определение объема сыворотки через час после образования сгустка.
В норме ретракция кровяного сгустка колеблется в пределах 48-60%.
Недостаточная ретракция сгустка наблюдается при выраженных тромбоцитопениях, а также при некоторых тромбоцитопатиях. Ложное уменьшение ретракции имеет место при избытке эритроцитов – истинной полицитемии, ложное увеличение – при анемиях, при гипофибринемии.
Дата добавления: 2018-08-06; просмотров: 1468; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
