Реакции электрофильного замещения
Общая схема механизма реакций электрофильного замещения SЕ:
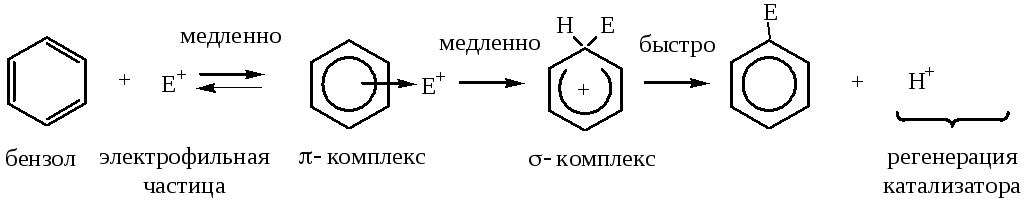
На первом этапе реакции образуется p-комплекс с электрофильной частицей (быстрая стадия), который затем превращается в s-комплекс (медленная стадия) за счет образования s-связи одним из атомов углерода с электрофильной частицей. Для образования s-связи с электрофильной частицей из сопряжения «вырывается» пара электронов, а образующийся продукт приобретает положительный заряд. В s- комплексе ароматичность нарушена, так как один из атомов углерода находится в sp3 -гибридизации, а на пяти других атомах углерода делокализованы четыре электрона и положительный заряд. Для регенерации термодинамически выгодной ароматической системы происходит гетеролитический разрыв связи Csp3 -Н. В результате отщепляется ион Н+ , а пара электронов связи идет на восстановление системы сопряжения, при этом у атома углерода, отщепившего протон, изменяется гибридизация атомных орбиталей с sp3 на sp2 .
Механизм реакций нитрования, сульфирования, галогенирования, алкилирования, ацилирования ароматических соединений включает еще дополнительную стадию, не указанную в общей схеме – стадию генерирования электрофильной частицы.
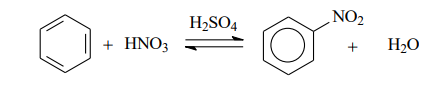
Уравнение реакции нитрования бензола имеет вид:
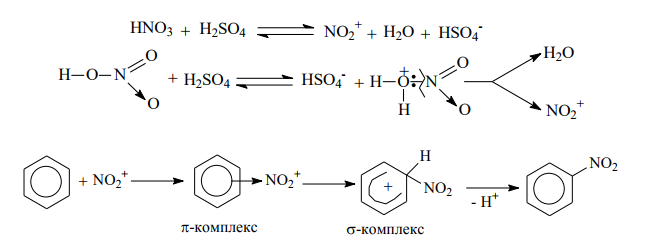
образование катиона нитрония NO2 + , который далее реагирует с ароматическим соединением:
2.Р. Галогенирования:
Бромирование
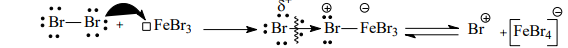
Хлорирование
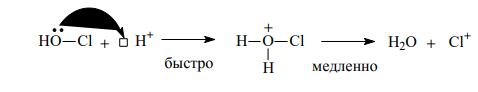
|
|
|
(с бромом можно так же)
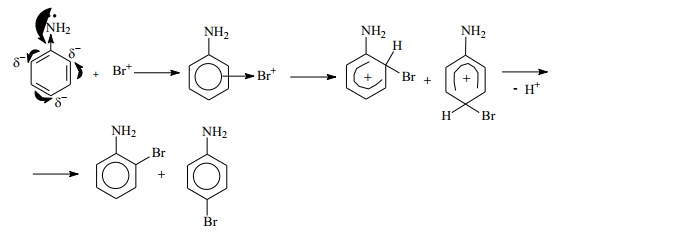
Механизм дальнейшего взаимодействия катионов Br+ или Cl+ ничем не отличается от механизма нитрования катионами NO2 + . Рассмотрим механизм реакции на примере бромирования анилина (ограничимся образованием монозамещенных продуктов). Как известно, анилин обесцечивает бромную воду, образуя в итоге 2,4,6-триброманилин, выделяющийся в виде белого осадка:

Образовавшаяся электрофильная частица атакует p-электроны бензольного кольца, образуя p-комплекс. Из возникшего p-комплекса образуются два основных s -комплекса, в которых связь углерод-бром возникает в орто- и пара-положениях цикла. На следующем этапе происходит отщепление протона, что приводит к образованию монозамещенных производных анилина. В избытке реагента эти процессы повторяются, приводя к образованию дибром- и трибромпроизводных анилина.
3.Алкилировария:
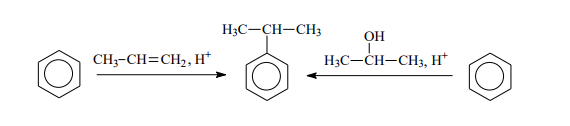
Генерирование электрофильной частицы:
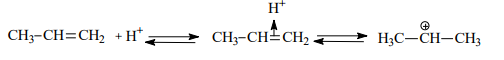 Или
Или
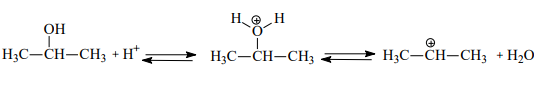
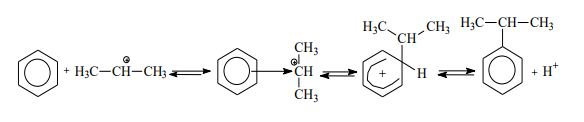
Образовавшийся изопропильный катион атакует p-электроны бензольного кольца, что приводит к возникновению p-комплекса, который далее превращается в s-комплекс с нарушенной ароматичностью. Последующее отщепление протона ведет к регенерации ароматической системы:
|
|
|
4. Сульфирования
роль электрофильной частицы выполняет молекула SO3, образующаяся в результате реакции: 2H2SO4 « SO3 +H3O + + HSO4 - . Атомы серы в этой молекуле характеризуются сильным дефицитом электронной плотности и наличием частичного положительного заряда и, следовательно, именно атом S должен, как электрофил, связываться с атомом углерода бензольного кольца толуола.
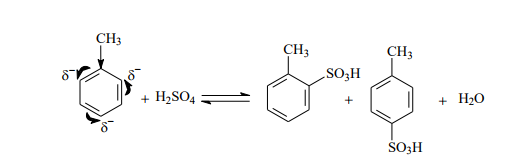
Механизм реакции
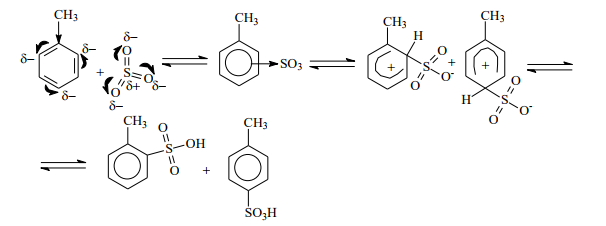
2) Образование p - комплекса происходит при атаке p - электронного облака кольца электрофильной частицей, например, комплексом хлора с катализатором, при этом образуется p - комплекс по донорно – акцепторному типу.
3) Образование s - комплекса происходит при возникновении ковалентной связи между электрофилом и атомом углерода бензольного кольца, за счет пары электронов p -системы кольца, что сопровождается переходом атома углерода из sp2 - в sp3 - гибридизованное состояние.
Влияние заместителей в бензольном ядре и гетероатомов в ароматических гетероциклах на реакционную способность(заместители 1-го и 2-го рода). Ориентирующее влиянияе заместителей и гетероатомов. Сульфирование пиррола и пиримидина.
Ориентанты I рода. Эти заместители облегчают электрофильное замещение по сравнению с бензолом и направляют входящую группу в орто- и пара-положения. К ним относятся электронодонорные заместители, увеличивающие электронную плотность в бензольном ядре. В результате ее перераспределения в положения 2,4,6 (орто- и пара-положения) возникают частичные отрицательные заряды, что облегчает присоединение электрофильной частицы в эти положения с образованием s-комплекса.
|
|
|

Ориентанты II рода. Эти заместители затрудняют реакции электрофильного замещения по сравнению с бензолом и направляют входящую группу в одно из мета-положений. К ним относятся электроноакцепторные заместители, уменьшающие электронную плотность в бензольном кольце. В результате ее перераспределения в положениях 3,5 (мета-положения) возникают частичные отрицательные заряды и присоединение электрофильной частицы с образованием s- комплекса идет в жестких условиях.
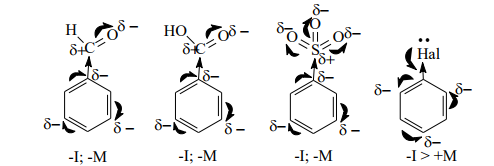
Атомы галогенов направляют электрофильную частицу в орто- или пара- положения (за счет положительного мезомерного эффекта), но при этом затрудняют протекание реакции, так как являются электроноакцепторными заместителями (-I>+M). Реакции галогенпроизводных бензола с электрофильными реагентами идут в жестких условиях.
|
|
|
Сульфирование пиррола и пиридина
Общаясхема реакции 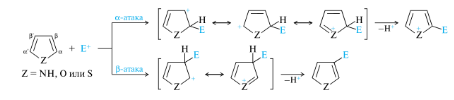
Пиррол

Пиридин
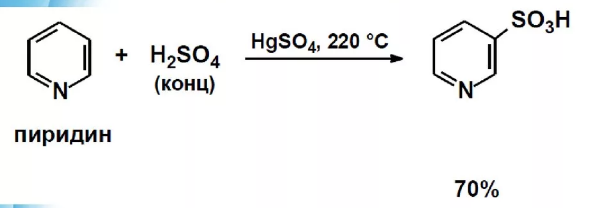
Дата добавления: 2018-08-06; просмотров: 892; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
