Влияние заместителей, связанных с кислотным центром
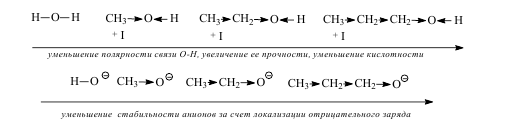
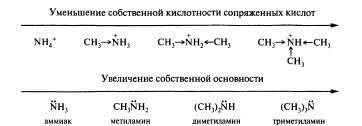
Электроноакцепторные заместители увеличивают кислотность соединений. Смещая на себя электронную плотность, они способствуют увеличению полярности и уменьшению прочности связи атома кислотного центра с атомом водорода, облегчают отщепление протона. Смещение электронной плотности к электроноакцепторному заместителю приводит к большей делокализации отрицательного заряда в анионе и увеличению его стабильности.

Электронодонорные заместители уменьшают кислотность соединений, так как смещают электронную плотность от себя, что приводит к локализации отрицательного заряда на атоме кислотного центра в анионе и уменьшению его устойчивости, увеличению его энергии, что затрудняет его образование.
Роль неподелённой пары электронов. Основания Брёнстеда

Электронная теория кислот и оснований Льюиса


12. Водородная связь 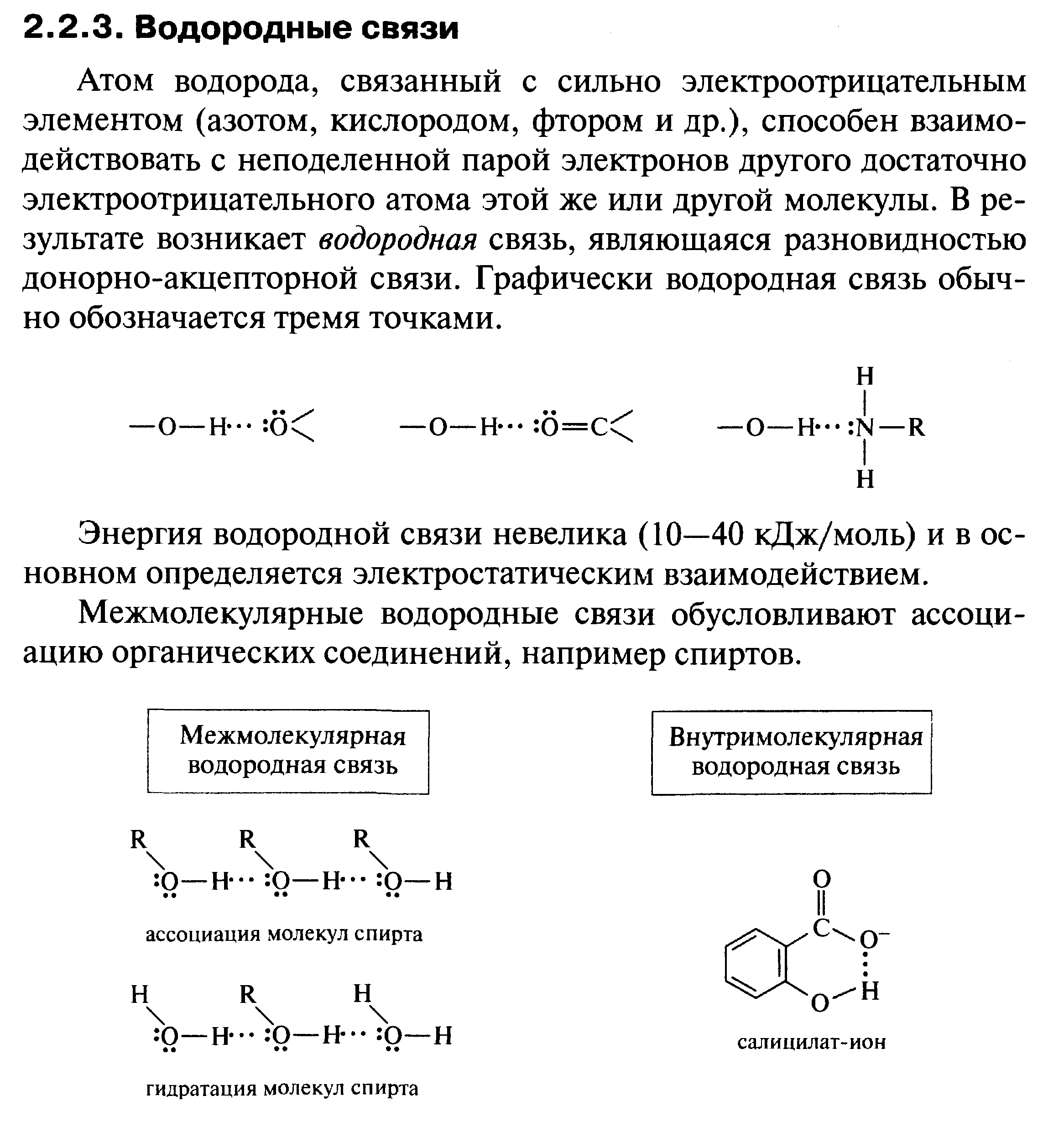
 13. Химические реакции
13. Химические реакции 

Окислительно-восстановительные. Процесс окисления включает переход от органического субстрата к реаге 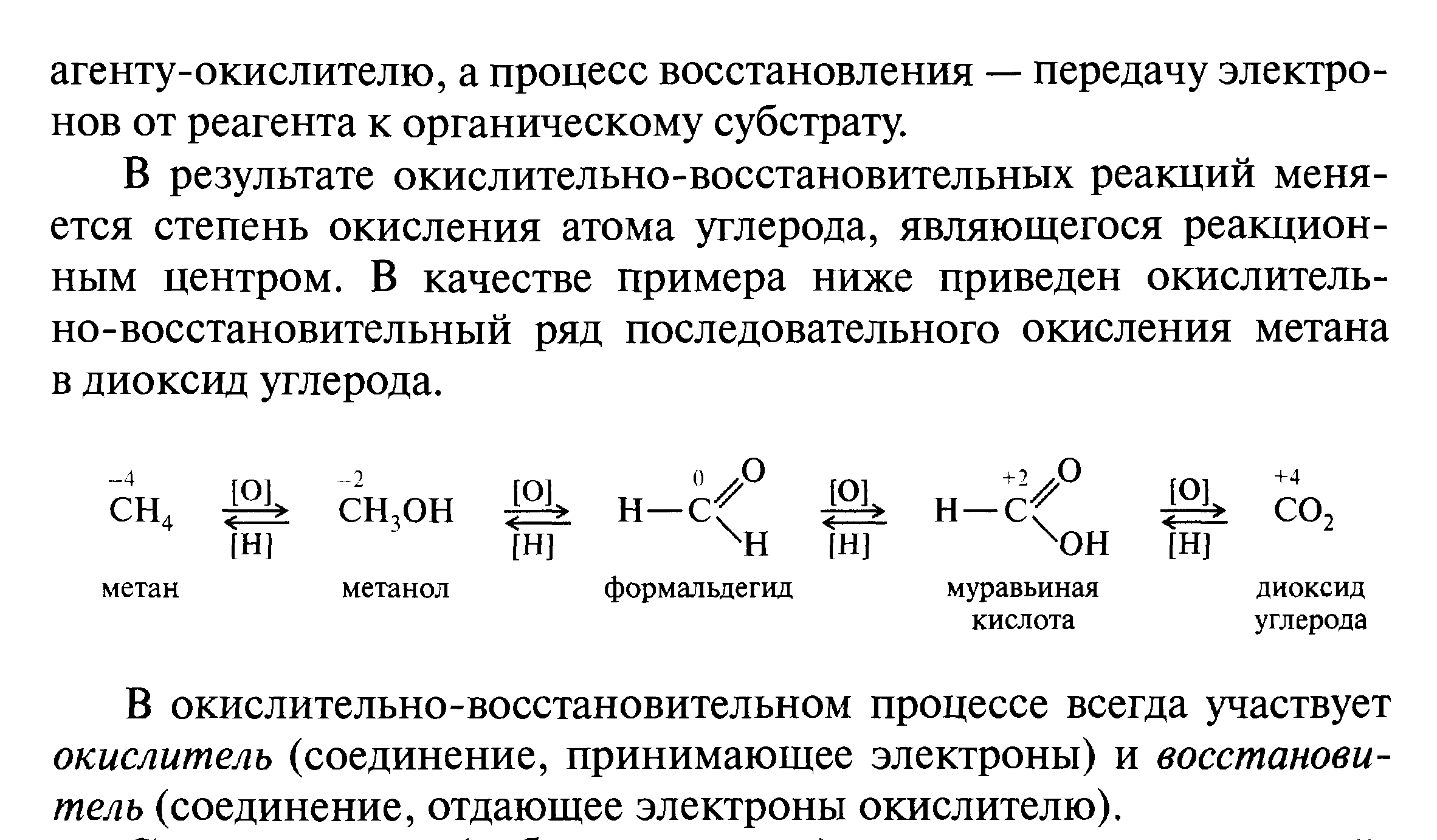

Электрофильные и нуклеофильные реагенты

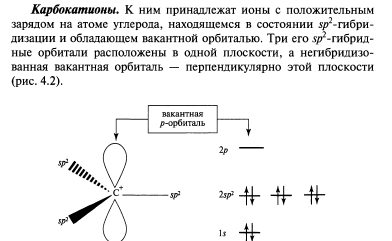



Реакции радикального замещения алкановSr





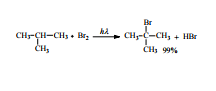
Реакция электофильногорисоединенияАе

реакции происходит образование p-комплекса (быстрая стадия). p- Комплекс формируется в результате электростатического притяжения электрофильной частицы к отрицательно заряженному электронному облаку p-связи. На втором этапе происходит превращение p-комплекса в s-комплекс (медленная или лимитирующая стадия реакции). Это превращение идет за счет того, что под действием электронного облака p- связи происходит дальнейшая поляризация связи Е®Nu и еѐгетеролитический разрыв. Образующийся катион Е+ образует s-связь с одним из атомов углерода за счет пары электронов p-связи в результате ее гетеролитического разрыва. Продукт присоединения катиона называютs-комплексом (так как возникла s-связь), или карбкатионом (так как полный положительный заряд находится на атоме углерода). На третьем этапе образовавшийся s-комплекс (карбкатион) легко подвергается нуклеофильной атаке Nu- с образованием конечного продукта. Скорость реакций электрофильного присоединения увеличивается с увеличением числа электронодонорных заместителей при двойной связи субстрата, что увеличивает ее нуклеофильность, облегчает образование p-комплекса с электрофильной частицей и его превращение в s-комплекс.
|
|
|

При взаимодействии алкенов с галогеноводородами лимитирующей стадией является присоединение протона через образование p-комплекса; реакция оканчивается последующей атакой образовавшегося карбкатиона галогенид-ионом. По мере увеличения кислотности легкость присоединения галогеноводородов возрастает в ряду: HF<HCl<HBr<HI.
|
|
|
В случае алкенов несимметричного строения, например, пропена, бутена-1, 2-метилпропена, присоединение галогеноводородов может приводить к образованию двух продуктов. На практике наблюдается региоселективное протекание реакции согласно правилу Марковникова: при взаимодействии несимметричных алкенов (алкинов, диенов) с соединениями типа Н-Х, атом Н присоединяется к более гидрогенизированному атому углерода при двойной (тройной) связи, а Х – к менее гидрогенизированному атому углерода. Есть и другие формулировки этого правила: присоединение протона к несимметричным алкенам идет с образованием более стабильного карбкатиона.
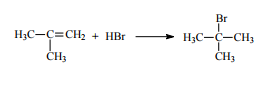
Механизм:





Дата добавления: 2018-08-06; просмотров: 1146; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
