Сопряжённые системы с замкнутой цепью
Биоорганическая химиякак наука.
Биоорганическая химия изучает связь между строением органических веществ и их биологическими функциями, используя методы органической и физической химии, а также физики и математики. Как самостоятельная наука, биоорганическая химия сформировалась во второй половине ХХ века на стыке биохимии и органической химии, на основе традиционной химии природных соединений. Объектами изучения являются биологически важные природные и синтетические соединения, главным образом биополимеры, а также витамины, гормоны, антибиотики, природные феромоны и сигнальные вещества, биологически активные вещества растительного происхождения, внутриклеточные регуляторы, а также синтетические регуляторы биологических процессов – лекарственные препараты, пестициды, инсектициды и другие соединения.
К основным задачам биоорганической химии относятся:
1. Разработка методов выделения и очистки природных соединений.
2. Определение строения и конфигурации изучаемого соединения.
3. Разработка методов синтеза как самих природных биологически важных веществ, так и их аналогов.
4. Изучение зависимости биологического действия от строения.
5. Выяснение химизма взаимодействия биологически активного вещества с живой клеткой или ее компонентами.
Биоорганическая химия тесно связана с практическими задачами медицины и сельского хозяйства (получение витаминов, гормонов, антибиотиков, стимуляторов роста растений, регуляторов поведения насекомых и животных), химической, пищевой и микробиологической промышленности.
|
|
|
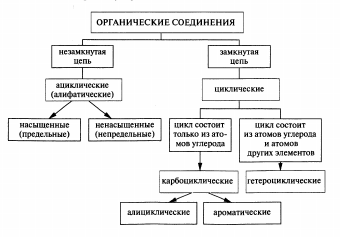
Классификация орг. веществ.

Номенклатура
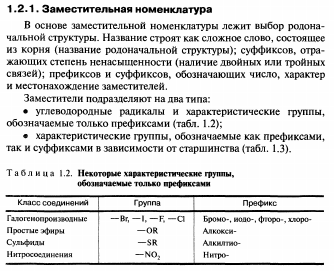
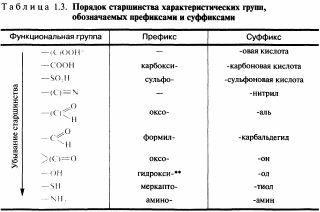
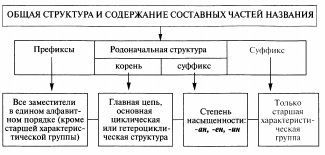
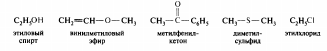
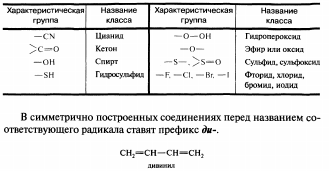
Номенклатура— это совокупность названий индивидуальных химических веществ, их групп и классов, а также правила составления этих названий.

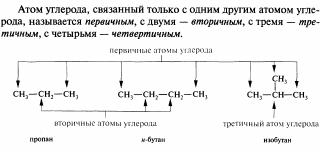




Сопряжённые системы
Сопряженные системы, виды сопряжения Сопряженными системами называются соединения, в которых есть чередование двойных и ординарных связей. Простейшим примером такой системы является молекула бутадиена-1,3.
Атомные орбитали всех атомов углерода в молекуле бутадиена-1,3 находятся в состоянии sp2 -гибридизации, в результате которой каждый из них имеет три гибридные орбитали, лежащие в одной плоскости под углом и одну негибридную р-орбиталь, располагающуюся перпендикулярно°120 этой плоскости.
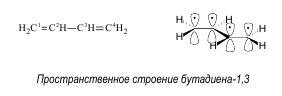

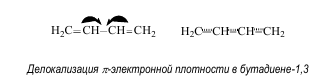
В реальной молекуле бутадиена-1,3 нет двойных или ординарных связей, все четыре р-электрона делокализованы по всей системе сопряжения, охватывающей углеродный скелет.
Таким образом, под термином сопряжение понимают делокализацию(перераспределение) p-электронной плотности в молекуле, приводящую к изменению длин связей и увеличению ее устойчивости за счет выделения энергии. Различают два типа сопряжения: p,p- и p,p-сопряжение, которые могут возникать как в циклических, так и ациклических молекулах.
|
|
|
p,p-Сопряжение возникает, если в сопряжении участвуют р-орбитали, образующие p-связи. В рассмотренной выше молекуле бутадиена-1,3 в сопряжении участвовали четыре электрона атомов углерода, расположенные на р-орбиталях, образующих p-связи, таким образом, можно сделать вывод о том, что в этом случае имеет место p,p- сопряжение.
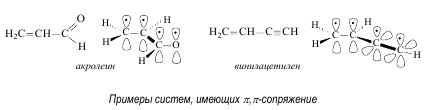
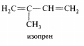
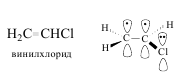
р,p-Сопряжение возникает, если в сопряжение с р-орбиталями, образующими p-связи, вступает р-орбиталь, не участвующая в образовании связей, причем эта р-орбиталь может быть вакантной или на ней могут находиться один или два электрона.
Энергия сопряжения (энергия делокализации) – это та часть энергии, которую молекула теряет в результате сопряжения. Чем больше энергия сопряжения, тем стабильнее сопряженная система. Один из способов определения этой величины состоит в сравнении теплоты гидрирования бензола с ее расчетным значением.
Сопряжённые системы с замкнутой цепью
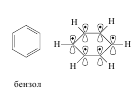
В молекуле бензола в p,p-сопряжении участвуют шесть р-орбиталейот шести атомов углерода, находящихся в sp2-гибридизации, на которых делокализуются шесть электронов. В молекуле нафталина в p,p-сопряжении участвуют десять р-орбиталей с десятью электронами.
|
|
|
Среди циклических соединений с сопряженной системой двойных связей выделяют ароматические соединения, характеризующиеся повышенной термодинамической устойчивостью и особыми свойствами
(низкая реакционная способность в реакциях присоединения, сравнительная легкость реакций замещения, сохраняющих сопряженную систему, устойчивость к окислению и другие). Соединение обладает ароматичностью, если:
- имеет плоский цикл, все атомы которого находятся в состоянии sp2-гибридизации;
- образуется сопряженная система -электронов, охватывающая все атомы цикла;
- число электронов N(e), участвующих в сопряжении, удовлетворяет правилу Хюккеля: N(e) = 4n +2, где n = 0,1,2,3 и т.д.
Если число электронов N(e), участвующих в сопряжении, равно N(e) = 4n, такое соединение считается антиароматическим.
Бензол является классическим представителем ароматических углеводородов, так как: имеет плоский цикл, все 6 атомов углерода находятся в состоянии sp2-гибридизации; образуется единая сопряженная система, охватывающая все атомы цикла (p,p-сопряжение); в сопряжении участвуют шесть электронов – по одному р-электрону от каждого атома углерода, что удовлетворяет правилу Хюккеля: 4n+2=6, n=1.
|
|
|
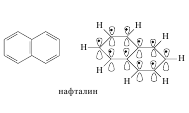
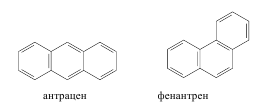
Нафталин, как и бензол, имеет плоский цикл, все 10 атомов углерода находятся в состоянии sp2-гибридизации, образуется сопряженная система, охватывающая все атомы цикла; в сопряжении участвуют 10 электронов (p,p-сопряжение) – по одному р-электрону от каждого атома углерода, что удовлетворяет правилу Хюккеля: 4n+2=10,n=2. Антрацен и фенантрен также удовлетворяют всем критериям ароматичности, в создании единой p,p-сопряженной системы в молекулах этих соединений участвуют 14 электронов.
Среди гетероциклических ненасыщенных соединений тоже есть соединения, удовлетворяющие критериям ароматичности. Типичными представителями пятичленных гетероциклических ароматических соединений являются фуран, тиофен, пиррол, имидазол.
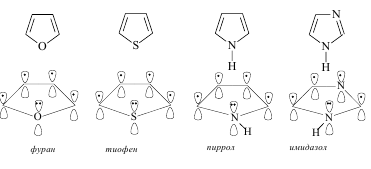
Во всех молекулах в создании сопряженной системы участвуют 6 электронов и имеет место какp,p-сопряжение, так и р,p-сопряжение. p,p-сопряжение происходит в результате перекрывания р-орбиталей, участвующих в образовании p-связей, р,p-сопряжение – за счет дополнительного перекрывания р-орбиталигетероатома (с неподеленнойпарой р-электронов) и р-орбиталей атомов углерода, образующих -связи.
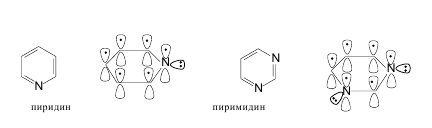
Атом азота, предоставляющий для образования сопряженной системы пару р-электронов, называют пиррольным, атом азота, предоставляющий в сопряжение один р-электрон, называют пиридиновым атомом азота. Атомныеорбиталипиррольного и пиридинового атомов азота находятся в состоянии sp2-гибридизации, но отличаются по своему электронному строению.
Пиридин и пиримидин, являющиеся шестичленными гетероциклическими соединениями, также отвечают всем критериям ароматичности. В создании сопряженной системы в этих молекулах участвуют 6 электронов. Каждый атом, входящий в цикл, отдает в сопряжение по одному р-электрону. В этих соединениях, в отличие от пятичленных гетероциклов, имеет место только p,p-сопряжение, так как
эти молекулы в своем составе содержат только пиридиновые атомы азота.
Дата добавления: 2018-08-06; просмотров: 685; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
