Электронные эффекты заместителей
На реакционную способность молекул влияют также заместители, связанные с атомом углерода, которые за счет проявляемых ими электронных эффектов приводят к изменению полярности связей и их прочности. Различают два типа электронных эффектов заместителей: индуктивный и мезомерный.
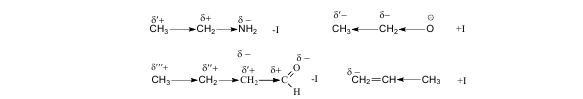
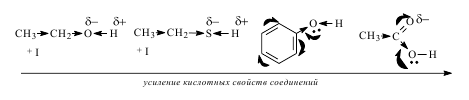
Индуктивный эффект (I) – это передача электронного влияния заместителя по системе s-связей. Он возникает, если связь образована атомами, разными по электроотрицательности. Индуктивный эффект передается на небольшие расстояния (3 – 4 s-связи) и затухает.
Отрицательный индуктивный эффект (- I) – смещение электронной плотности по системе s– связей к заместителю. Его проявляют более электроотрицательные, чем углерод, атомы и группы атомов.
Положительный индуктивный эффект (+I) – смещение электронной плотности по системе s – связей от заместителя. Его проявляют углеводородные радикалы и анионы, связанные с атомом углерода. Принято считать, что индуктивный эффект атома водорода равен нулю, т.е. связь С-Н является неполярной ковалентной связью.
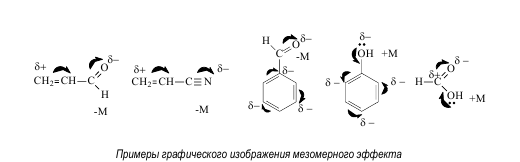
Мезомерный эффект (М) – это передача электронного влияния заместителя по системе сопряжения. В отличие от быстро затухающего индуктивного эффекта, мезомерный эффект по сопряженной системе передается на большие расстояния. Положительный мезомерный эффект (+М) имеет место в случае смещения электронной плотности по системе сопряжения от заместителя, отрицательный (-М) – к заместителю. Графически мезомерный эффект обозначается изогнутыми стрелками, начало которых показывает, какие р- или s-электроны смещаются, а конец – связь или атом, к которому они смещаются. На концах сопряженной системы указывают частичные заряды.
|
|
|
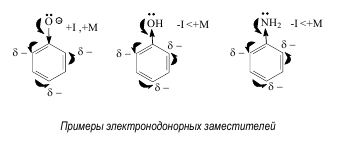
Электроноакцепторные заместители – заместители, уменьшающие электронную плотность в молекуле. Это достигается в результате проявления ими отрицательных индуктивного и мезомерногоэффектов, либо преобладания отрицательного индуктивного эффекта над положительныммезомерным.
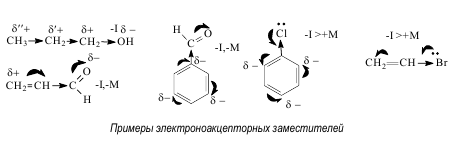
Электроноакцепторные заместители – заместители, уменьшающие электронную плотность в молекуле. Это достигается в результате проявления ими отрицательных индуктивного и мезомерногоэффектов, либо преобладания отрицательного индуктивного эффекта над положительныммезомерным.
Теория Бренстеда-Лоури
В 1923 г. были предложены две теории кислот и оснований: протолитическая теория Бренстеда и Лоури, а также электронная теория Льюиса.
Согласно протолитической теории, кислоты – это ионы или молекулы, способные отдавать катион водорода, т.е. вещества, являющиеся донорами протона. Основания – это молекулы или ионы, способные присоединять катион водорода, т. е. вещества, являющиеся акцепторами протона или донорами пары электронов, необходимой для
|
|
|
присоединения протона. По этой теории кислота и основание составляют сопряженную пару и связаны уравнением: кислота ↔ основание + Н+.

Количественная оценка кислотности (силы кислоты) проводится сравнением констант равновесия реакций по переносу протона от кислоты к основанию.
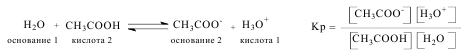
Ка – константа кислотности, чем больше значение константы кислотности, тем кислота сильнее. На практике для удобства часто используют не константу кислотности, а отрицательный десятичный логарифм константы кислотности, называемый показателем кислотности рКа = – lg Ка. Чем меньше значение рКа, тем
кислота сильнее.
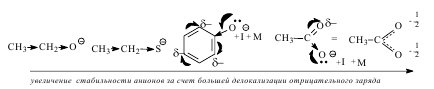
Степень делокализации отрицательного заряда зависит от следующих факторов:
1) от природы атома кислотного центра, т.е. от его электроотрицательности и радиуса (поляризуемости);
2) от характера связанного с ним радикала;
3) от электронного строения аниона;
4) от влияния растворителя.
Дата добавления: 2018-08-06; просмотров: 1065; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
