Глава 2. Вторичные мессенджеры
Общие представления о путях сигнальной трансдукции
Для большинства регуляторных молекул между их связыванием с мембранным рецептором и окончательной реакцией клетки, т.е. изменением ее работы, вклиниваются сложные серии событий - определенные пути передачи сигнала, иначе называемые путями сигнальной трансдукции.
Регуляторные вещества принято подразделять на эндокринные, нейрокринные и паракринные. Эндокринныерегуляторы (гормоны)выделяются эндокринными клетками в кровь и переносятся ею к клеткам-мишеням, которые могут находиться в любом месте организма. Нейрокринныерегуляторы выделяются нейронами в непосредственной близости от клеток-мишеней. Паракринныевещества освобождаются несколько дальше от мишеней, но все же достаточно близко к ним, чтобы достичь рецепторов. Паракринные вещества секретируются одним типом клеток, а действуют на другой, однако в некоторых случаях регуляторы предназначены тем клеткам, которые их выделили, или соседним клеткам, относящимся к тому же типу. Это называется аутокриннойрегуляцией.
В ряде случаев последний этап сигнальной трансдукции состоит в фосфорилировании определенных эффекторных белков, что ведет к усилению или угнетению их активности, а это, в свою очередь, определяет необходимую организму клеточную реакцию. Фосфорилирование белков осуществляют протеинкиназы,а дефосфорилирование - протеинфосфатазы.
|
|
|
Изменения протеинкиназной активности происходят в результате связывания регуляторной молекулы (в общем случае называемойлигандом)с ее мембранным рецептором, что запускает каскады событий, некоторые из которых приведены на рисунке (рис. 2-1). Активность различных протеинкиназ регулируется рецептором не прямо, а через вторичные мессенджеры(вторичные посредники), в роли которых выступают, например, циклический АМФ (цAMФ), циклический ГМФ (цГMФ), Са2+, инозитол-1,4,5-три- фосфат (IP3)идиацилглицерол (DAG).При этом связывание лиганда с мембранным рецептором изменяет внутриклеточный уровень вторичного мессенджера, что, в свою очередь, отражается на активности протеинкиназы. Многие регулятор-
ные молекулы влияют на клеточные процессы через пути сигнальной трансдукции с участием гетеротримерных ГТФ-связывающих белков (гетеротримерных G-белков)или мономерных ГТФ-связывающих белков (мономерных G-белков).
Когда молекулы лиганда связываются с мембранными рецепторами, взаимодействующими с гетеротримерными G-белками, происходит переход G-белка в активное состояние путем связывания с ГТФ. Активированный G-белок может затем взаимодействовать со многимиэффекторными белками,прежде всего ферментами, такими, как аденилатциклаза, фосфодиэстераза, фосфолипазы С, А2и D.Это взаимодействие запускает цепи реакций (рис. 2-1), которые заканчиваются активацией различных протеинкиназ, таких, какпротеинкиназа А (ПКА), протеинкиназа G (ПKG), протеинкиназа C (ПИС).
|
|
|
В общих чертах пути сигнальной трансдукции с участием G-белков - протеинкиназ включает следующие этапы.
1. Лиганд связывается с рецептором на мембране клетки.
2. Связанный с лигандом рецептор, взаимодействуя с G-белком, активирует его, и активированный G-белок связывает ГТФ.
3. Активированный G-белок взаимодействует с одним или несколькими следующими соединениями: аденилатциклазой, фосфодиэстеразой, фосфолипазами С, А2, D, активируея или ингибируя их.
4. Внутриклеточный уровень одного или нескольких вторичных мессенджеров, таких, как цАМФ, цГМФ, Са2+, IP3 или DAG, возрастает или снижается.
5. Увеличение или уменьшение концентрации вторичного мессенджера влияет на активность одной или нескольких зависимых от него протеинкиназ, таких, как цАМФ-зависимая протеинкиназа (протеинкиназа А), цГМФ-зависимая протеинкиназа (ПКG),кальмодулинзависимая протеинкиназа(КМПК), протеинкиназа С. Изменение концентрации вторичного мессенджера может активировать тот или иной ионный канал.
|
|
|
6. Уровень фосфорилирования фермента или ионного канала изменяется, что влияет на активность ионного канала, обуславливая конечный ответ клетки.
Рис. 2-1. Некоторые каскады событий, реализующиеся в клетке благодаря вторичным посредникам.
Обозначения: * - активированный фермент

Мембранные рецепторы, связанные с G-белками
Мембранные рецепторы, опосредующие агонист-зависимую активацию G-белков, составляют особое семейство белков, в котором 500 с лишним представителей. К нему относятся α- и β-адренергические, мускариновые ацетилхолиновые, серотониновые, аденозиновые, обонятельные рецепторы, родопсин, а также рецепторы большинства пептидных гормонов. Представители семейства рецепторов, связанных с G-белками, имеют семь трансмембранных α-спиралей (рис. 2-2 А), каждая из которых содержит 22-28 преимущественно гидрофобных аминокислотных остатков.
Для некоторых лигандов, например, ацетилхолина, адреналина, норадреналина и серотонина, известны разные подтипы связанных с G-белками рецепторов. Зачастую они различаются сродством к конкурентным агонистам и антагонистам.
Далее представлена (рис. 2-2 Б) молекулярная организация аденилатциклазы - фермента, продуцирующего цАМФ (первый открытый вторичный мессенджер). Регуляторный путь аденилатциклазы считается классическим путем сигнальной трансдукции, обусловленной G-белками.
|
|
|
Аденилатциклаза служит основой позитивного или негативного контроля путей сигнальной трансдукции через G-белки. При позитивном контроле связывание стимулирующего лиганда, например, адреналина, действующего через β-адренергические рецепторы, ведет к активации гетеротримерных G-белков с α-субъединицей типа as («s» означает стимуляцию). Активация Gs-типа G-белков посредством связанного с лигандом рецептора приводит к тому, что его as-субъединица связывает ГТФ, и затем диссоциирует от βγ-димера.
На рисунке 2-2 В показано, как фосфолипаза С расщепляет фосфатидилинозитол-4,5-дифосфат на инозитол-1,4,5-трифосфат и диацилглицерол. Оба вещества, инозитол-1,4,5-трифосфат и диацилглицерол, относятся к вторичным мессенджерам. IP3, связываясь со специфическими лигандзависимыми Са2+-каналами эндоплазматического ретикулума, высвобождает из него Са2+, т.е. повышает концентрацию Са2+ в цитозоле. Диацилглицерол вместе с Са2+ активирует другой важный класс протеинкиназ - протеинкиназу С.
Затем показана структура некоторых вторичных мессенджеров (рис. 2-2 Г-Е): цАМФ, ГМФ,
цГМФ.
Рис. 2-2. Примеры молекулярной организации некоторых структур, участвующих в путях сигнальной трансдукции.
А - рецептор мембраны клетки, связывающий на внешней поверхности лиганд, а внутри - гетеротримерный G-белок. Б - молекулярная организация аденилатциклазы. В - структура фосфатидилинози- тол-4,5-дифосфата и образованных под действием фосфолипазы С инозитол-1,4,5-трифосфата и диацилглицерола. Г - структура 3',5'-циклического АМФ (активатора протеинкиназы А). Д - структура ГМФ. Е - структура 3',5'-циклического ГМФ (активатора протеинкиназы G)

Гетеротримерные G-белки
Гетеротримерный G-белок состоит из трех субъединиц: α (40 000-45 000 Да), β (около 37 000 Да) и γ (8000-10 000 Да). Сейчас известно около 20 различных генов, кодирующих эти субъединицы, в том числе не менее четырех генов β-субъединиц и примерно семь генов γ-субъединиц млекопитающих. Функция и специфичность G-белка обычно, хотя и не всегда, определяются его α-субъединицей. У большинства G-бел- ков субъединицы β и γ плотно связаны между собой. Некоторые гетеротримерные G-белки и пути трансдукции, в которых они задействованы, перечислены в табл. 2-1.
Гетеротримерные G-белки служат посредниками между рецепторами плазматической мембраны для более 100 внеклеточных регуляторных веществ и внутриклеточными процессами, которые они контролируют. В общих чертах, связывание регуляторного вещества с его рецептором активирует G-белок, а тот либо активирует, либо ингибирует фермент и/или вызывает цепь событий, приводящих к активации определенных ионных каналов.
На рис. 2-3 представлен общий принцип работы гетеротримерных G-белков. В большинстве G-белков α-субъединица представляет собой «рабочий элемент» гетеротримерных G-белков. Активация большинства G-белков приводит к конформационному изменению этой субъединицы. Неактивные G-белки существуют главным образом в форме αβγ-гетеротримеров,
с ГДФ в позициях, связывающих нуклеотид. Взаимодействие гетеротримерных G-белков с присоединившим лиганд рецептором ведет к преобразованию α-субъединицы в активную форму с повышенным сродством к ГТФ и пониженной афинностью его к βγ-комплексу. В результате активированная α-субъединица освобождает ГДФ, присоединяет ГТФ, а затем диссоциирует от βγ-димера. У большинства G-белков диссоциированная α-субъединица затем взаимодействует с эффекторными белками в пути сигнальной трансдукции. Однако у некоторых G-белков освободившийся βγ-димер может быть ответственным за все или некоторые эффекты рецептор-лигандного комплекса.
Работа некоторых ионных каналов модулируется G-белками непосредственно, т.е. без участия вторичных мессенджеров. Например, связывание ацетилхолина с мускариновыми М2-рецепторами сердца и некоторых нейронов ведет к активации особого класса К+-каналов. В этом случае связывание ацетилхолина с мускариновым рецептором ведет к активации G-белка. Его активированная α-субъединица затем отделяется от βγ-димера, а βγ-димер напрямую взаимодействует с особым классом К+-каналов, приводя их в открытое состояние. Связывание ацетилхолина с мускариновыми рецепторами, повышающее К+-проводимость пейсмекерных клеток в синоатриальном узле сердца - один из главных механизмов, посредством которого парасимпатические нервы вызывают уменьшение частоты сердечных сокращений.
Рис. 2-3. Принцип работы гетеротримерных ГТФ-связывающих белков (гетеротримерных G-белков).
Обозначения: R - рецептор, L - лиганд, Е - эффекторный белок

Таблица 2-1.Некоторые гетеротримерные ГТФ-связывающие белки млекопитающих, классифицированные на основе их α-субъединиц *

* В каждом классе α-субъединиц различают несколько изоформ. Идентифицировано более 20 α-субъединиц.
Мономерные G-белки
Клетки содержат еще одно семейство ГТФсвязывающих белков, которые называют мономернымиГТФ-связывающими белками. Они также известны как G-белки с низкой молекулярной массойили малые G-белки(молекулярная масса 20 000-35 000 Да). В таблице 2-2 перечислены основные подклассы мономерных ГТФсвязывающих белков и некоторые из их свойств. Ras-подобные и Rho-подобные мономерные ГТФ-связывающие белки участвуют в пути сигнальной трансдукции на этапе передачи сигнала от тирозинкиназы, рецептора фактора роста, на внутриклеточные эффекторы. Среди процессов, регулируемых путями сигнальной трансдукции, в которые вовлечены мономерные ГТФсвязывающие белки, можно назвать элонгацию полипептидной цепи в ходе белкового синтеза, пролиферацию и дифференцировку клеток, их злокачественное перерождение, контроль актинового цитоскелета, связь между цитоскелетом
и внеклеточным матриксом, транспорт везикул между различными органеллами и экзоцитозную секрецию.
Мономерные ГТФ-связывающие белки, как и их гетеротримерные аналоги, представляют собой молекулярные переключатели, существующие в двух формах - активированной «включенной» и инактивированной «выключенной» (рис. 2-4 Б). Однако активация и инактивация мономерных ГТФ-связывающих белков требует дополнительных регуляторных белков, которые, насколько известно, не требуются для работы гетеротримерных G-белков. Мономерные G-белки активируются гуанин-нуклеотид-освобождающими белками,а инактивируются ГТФаза-активирующими белками.Таким образом, активация и инактивация мономерных ГТФ-связывающих белков контролируется сигналами, которые изменяют активность гуанин-нуклеотид-освобождающих белковилиГТФаза-активирующих белковскорее, чем путем прямого воздействия на мономерные G-белки.
Рис. 2-4. Принцип работы мономерных ГТФ-связывающих белков (мономерных G-белков).
Обозначения: R - рецептор, L - лиганд

Таблица 2-2.Подсемейства мономерных ГТФ-связывающих белков и некоторые регулируемые ими внутриклеточные процессы

Механизм работы гетеротримерных G-белков
Неактивные G-белки существуют главным образом в форме αβγ-гетеротримеров, с ГДФ в их позициях, связывающих нуклеотид (рис. 2-5 А). Взаимодействие гетеротримерных G-белков с присоединившим лиганд рецептором ведет к преобразованию α-субъединицы в активную форму, которая имеет повышенное сродством к ГТФ и пониженную афинность его к βγ-комплексу (рис. 2-5 Б). В большинстве гетеротримерных G-белков именно α-субъединица представляет собой структуру, передающую информацию. Активация большинства G-белков приводит к конформационному изменению α-субъединицы.
В результате активированная α-субъединица освобождает ГДФ, присоединяет ГТФ (рис. 2-5 В), а затем диссоциирует от βγ-димера (рис. 2-5 Г). У большинства G-белков диссоциированная α-субъединица сразу взаимодействует с эффекторными белками (Е1) в пути сигнальной трансдукции (рис. 2-5 Г). Однако у некоторых G-белков освободившийся βγ-димер может быть ответственным за все или за некоторые эффекты рецептор-лигандного комплекса. Затем βγ-димер взаимодействует с эффекторным белком Е2 (рис. 2-5 Д). Далее показано, что члены RGS семьи G-белка стимулируют гидролиз ГТФ (рис. 2-5 Е). Это инактивирует α-субъединицу и объединяет все субъединицы в αβγ-гетеротример.
Рис. 2-5. Цикл работы гетеротримерного G-белка, запускающего дальнейшую цепь событий с помощью своейα-субъединицы.
Обозначения: R - рецептор, L - лиганд, Е - эффекторный белок

Пути сигнальной трансдукции через гетеротримерные G-белки
На рисунке 2-6 А показаны три лиганда, их рецепторы, связанные с разными G-белками, и их молекулярные мишени. Аденилатциклаза является основой для позитивного или негативного контроля путей сигнальной трансдукции, которые обусловлены G-белками. При позитивном контроле связывание стимулирующего лиганда, например норадреналина, действующего через β- адренергические рецепторы, ведет к активации гетеротримерных G-белков с α-субъединицей типа αS («s» означает стимуляцию). Поэтому такой G-белок называют G-белком GS-типа. Активация Gs-типа G-белков посредством связанного с лигандом рецептора приводит к тому, что его αs- субъединица связывает ГТФ и затем диссоциирует от βγ-димера.
Другие регуляторные вещества, такие, как адреналин, действующий через α2-рецепторы, или аденозин, действующий через α1-рецепторы, или дофамин, действующий через D2-рецепторы, участвуют в негативном или ингибирующем контроле аденилатциклазы. Эти регуляторные вещества активируют Gi-тип G-белков, которые имеют α-субъединицу типа αi («i» означает ингибирование). Связывание ингибирующего лиганда с его
рецептором активирует Gi-тип G-белков и вызывает диссоциацию его αi-субъединицы от βγ-димера. Активированная αi-субъединица связывается с аденилатциклазой и подавляет ее активность. Кроме того, βγ-димеры могут связывать свободные αs-субъединицы. Этим путем связывание βγ-димеров со свободной αs-субъединицей дополнительно подавляет стимуляцию аденилатциклазы, блокируя действие стимулирующих лигандов.
Еще один класс внеклеточных агонистов (рис. 2-6 А) связывается с рецепторами, которые активируют посредством G-белка, называемого Gq, β-изоформу фосфолипазы С. Она расщепляет фосфатидилинозитол-4,5-дифосфат (фосфолипид, в малых количествах присутствующий в плазматической мембране) на инозитол-1,4,5- трифосфат и диацилглицерол, которые относятся ко вторичным мессенджерам. IP3, связываясь со специфичными лигандзависимыми Са2+-каналами эндоплазматического ретикулума, высвобождает из него Са2+, т.е. повышает концентрацию Са2+ в цитозоле. Са2+-каналы эндоплазматического ретикулума вовлечены в электромеханическое сопряжение в скелетной и сердечной мышце. Диацилглицерол вместе с Са2+ активирует протеинкиназу С. К ее субстратам относятся, например, белки, участвующие в регуляции клеточного деления.
Рис. 2-6. Примеры путей сигнальной трансдукции через гетеротримерные G-белки.
А - в трех приведенных примерах связывание нейротрансмиттера с рецептором ведет к активации G-белка и последующему включению путей вторичных мессенджеров. Gs, Gq, и Gi подразумевают три различных типа гетеротримерных G-белков. Б - регуляция клеточных белков фосфорилированием ведет к усилению или угнетению их активности, а это, в свою очередь, определяет необходимую организму клеточную реакцию. Фосфорилирование белков осуществляют протеинкиназы, а дефосфорилирование - протеинфосфатазы. Протеинкиназа переносит фосфатную группу (Pi) от АТФ на сериновые, треониновые или тирозиновые остатки белков. Это фосфорилирование обратимо меняет структуру и функции клеточных белков. Оба типа ферментов - киназы и фосфатазы - регулируются различными внутриклеточными вторичными мессенджерами

Пути активации внутриклеточных протеинкиназ
Взаимодействие гетеротримерных G-белков с присоединившим лиганд рецептором ведет к преобразованию α-субъединицы в активную форму, которая имеет повышенное сродство к ГТФ и пониженную афинность его к βγ-комплексу. Активация большинства G-белков приводит к конформационному изменению α-субъединицы, которая освобождает ГДФ, присоединяет ГТФ, а затем диссоциирует от βγ-димера. Далее диссоциированная α-субъединица взаимодействует с эффекторными белками в пути сигнальной трансдукции.
На рисунке 2-7 А продемонстрирована активация гетеротримерных G-белков Gs-типа с α-субъединицей типа αs, которая происходит благодаря связыванию с лигандом рецептора и приводит к тому, что αs-субъединица G-белков Gs-типа связывает ГТФ и затем диссоциирует от βγ-димера, а далее взаимодействует с аденилатциклазой.Это приводит к повышению уровня цАМФ и активации ПКА.
На рисунке 2-7 Б продемонстрирована активация гетеротримерных G-белков Gt-типа с α-субъединицей типа αt, которая происходит благодаря связыванию с лигандом рецептора и приводит к тому, что αt-субъединица G-белков Gt-типа активируется и затем диссоциирует от βγ-димера, а далее взаимодействует с фосфодиэстеразой.Это приводит к повышению уровня цГМФ и активации ПKG.
Рецептор катехоламинов α1 взаимодействует с Gαq -субъединицей, активирующей фосфолипазу С. На рисунке 2-7 В продемонстрирована активация гетеротримерных G-белков Gαq-типа с α-субъединицей типа αq, которая происходит благодаря связыванию лиганда с рецептором и приводит к тому, что αq-субъединица G-белков Gαq-типа активируется и затем диссоциирует от βγ-димера, а далее взаимодействует с фосфолипазой С.Она расщепляет фосфатидилинози- тол-4,5-дифосфат на IP3 и DAG. Это приводит к повышению уровня IP3 и DAG. IP3, связываясь со специфичными лигандзависимыми Са2+- каналами эндоплазматического ретикулума,
высвобождает из него Са2+. DAG вызывает активацию протеинкиназы С. В нестимулированной клетке значительное количество этого фермента находится в цитозоле в неактивной форме. Са2+ заставляет протеинкиназу С связываться с внутренней поверхностью плазматической мембраны. Здесь фермент может активироваться диацилглицеролом, который образуется при гидролизе фосфатидилинозитол-4,5-дифосфата. Мембранный фосфатидилсерин также может быть активатором протеинкиназы С, если фермент находится в мембране.
Описано около 10 изоформ протеинкиназы С. Хотя некоторые из них присутствуют во многих клетках млекопитающих, однако подтипы γ и ε обнаружены, главным образом, в клетках центральной нервной системы. Подтипы протеинкиназы С различаются не только распределением по организму, но, по-видимому, и механизмами регуляции своей активности. Некоторые из них в нестимулированных клетках связаны с плазматической мембраной, т.е. не требуют для активации увеличения концентрации Са2+. Некоторые изоформы протеинкиназы С активируются арахидоновой кислотой или другими ненасыщенными жирными кислотами.
Первоначальная кратковременная активация протеинкиназы С происходит под действием диацилглицерола, который освобождается, когда фосфолипаза Сβ активируется, а также под влиянием Са2+, освобожденного из внутриклеточных хранилищ с помощью IP3. Долго длящаяся активация протеинкиназы С запускается рецептор-зависимыми фосфолипазами А2 и D. Они действуют первично на фосфатидилхолин - основной мембранный фосфолипид. Фосфолипаза А2 отделяет от него жирную кислоту во втором положении (обычно ненасыщенную) и лизофосфатидилхолин. Оба эти продукта активируют определенные изоформы протеинкиназы С. Рецептор-зависимая фосфолипаза D расщепляет фосфатидилхолин таким образом, что образуется фосфатидная кислота и холин. Фосфатидная кислота далее расщепляется до диацилглицерола, участвующего в долговременной стимуляции протеинкиназы С.
Рис. 2-7. Основные принципы активации протеинкиназы А, протеинкиназы G и протеинкиназы С.
Обозначения: R - рецептор, L - лиганд

цAMФ-зависимая протеинкиназа (протеинкиназа А) и связанные с ней сигнальные пути
В отсутствии цАМФ, цАМФ-зависимая протеинкиназа (протеинкиназа А) состоят из четырех субъединиц: двух регуляторных и двух каталитических. У большинства типов клеток каталитическая субъединица одна и та же, а регуляторные субъединицы высокоспецифичны. Присутствие регуляторных субъединиц почти полностью подавляет ферментативную активность комплекса. Таким образом, активация ферментативной активности цАМФ-зависимой протеинкиназы должна вовлекать отделение регуляторных субъединиц от комплекса.
Активация происходит в присутствии микромолярных концентраций цАМФ. Каждая регуляторная субъединица связывает две его молекулы. Связывание цАМФ индуцирует конформационные изменения в регуляторных субъединицах и снижает аффинность их взаимодействия с каталитическими субъединицами. В результате этого регуляторные субъединицы отделяются от каталитических, и каталитические субъединицы становятся активированными. Активная каталитическая субъединица фосфорилирует белкимишени по определенным сериновым и треониновым остаткам.
Сравнение аминокислотных последовательностей цАМФ-зависимой и других классов протеинкиназ показывает, что, несмотря на сильные различия в их регуляторных свойствах, все эти ферменты высокогомологичны по первичной структуре срединной части. Эта часть содержит АТФ-связывающий домен и активный центр фермента, обеспечивающий перенос фосфата с АТФ на белок-акцептор. Участки киназ за пределами этой каталитической срединной части белка участвуют в регуляции киназной активности.
Определена также кристаллическая структура каталитической субъединицы цАМФ-зависимой протеинкиназы. Каталитическая средняя часть молекулы, имеющаяся у всех известных протеинкиназ, состоит из двух долей. Меньшая из них содержит необычный АТФ-связывающий участок, а большая доля содержит участок связывания пептида. Многие протеинкиназы содержат также регуляторный участок, известный как псевдосубстратный домен.По аминокислотной последовательности он напоминает фосфорилируемые участки субстратных белков. Псевдосубстратный домен, связываясь с активным центром протеинкиназы, ингибирует фосфорилирование истинных субстратов протеинкиназы. Активация киназы может включать фосфорилирование или нековалентную аллостерическую модификацию протеинкиназы для устранения ингибирующего действия псевдосубстратного домена.
Рис. 2-8. цAMФ-зависимая протеинкиназа А и мишени.
Когда адреналин связывается с соответствующим рецептором, активация αs-субъединицы стимулирует аденилатциклазу с увеличением уровня цАМФ. цАМФ активирует протеинкиназу А, которая путем фосфорилирования дает три основных эффекта. (1) Протеинкиназа А активирует киназу фосфорилазы гликогена, которая фосфорилирует и активирует фосфорилазу гликогена. (2) Протеинкиназа А инактивирует гликогенсинтазу и таким образом уменьшает образование гликогена. (3) Протеинкиназа А активирует ингибитор фосфопротеин-фосфатазы-1 и тем самым ингибирует фосфатазу. Эффект в целом заключается в координации изменений уровня глюкозы.
Обозначения: УДФ-глюкоза - уридиндифосфатглюкоза

Гормональная регуляция активности аденилатциклазы
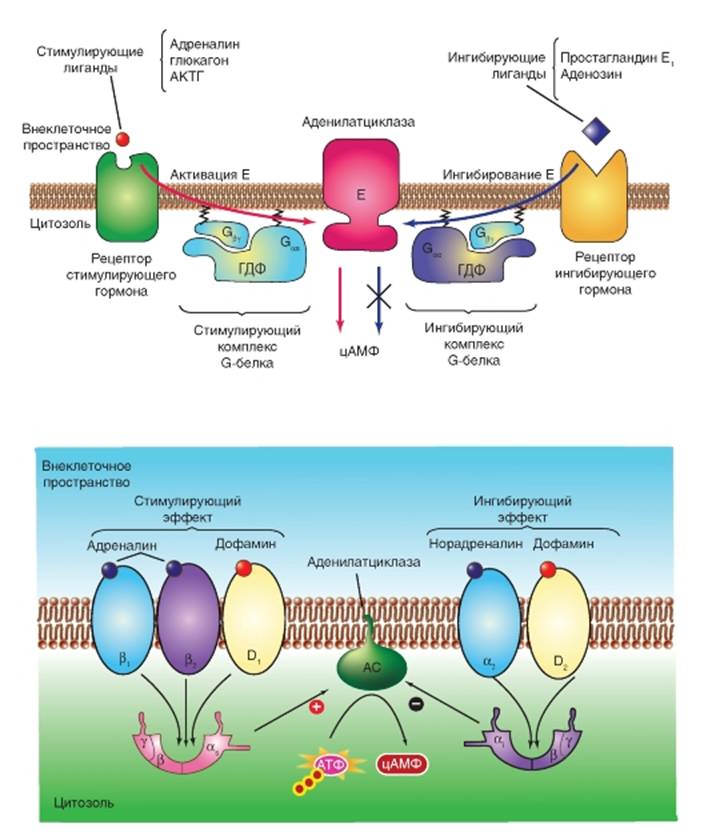
На рисунке 2-9 А представлен принципиальный механизм индуцированной гормонами стимуляции и ингибирования аденилатциклазы. Взаимодействие лиганда с рецептором, связанным с α-субъединицей типа αs (стимулирующая), вызывает активацию аденилатциклазы, тогда как взаимодействие лиганда с рецептором), связанным с α-субъединицей типа αi (ингибирующая), вызывает ингибирование фермента. Gβγ-субъединица и в стимулирующих, и в ингибирующих G-белках идентична. Gα-субъединицы и рецепторы различны. Лиганд-стимулирован-ное образование активных Gα•ГТФ комплексов происходит с помощью одинаковых механизмов в обоих Gαs,- и Gαi-протеинах. Однако Gαs•ГТФ и Gαi•ГТФ по-разному взаимодействуют с аденилатциклазой. Одна (Gαs•ГТФ) стимулирует, а другая Gαi•ГТФ) ингибирует ее каталитическую активность.
На рисунке 2-9 Б представлен механизм индуцированной определенными гормонами активации и ингибирования аденилатциклазы. β1-, β2- и D1-рецепторы взаимодействуют с субъединицами, которые активируют аденилатциклазу и повышают уровень цАМФ. α2-и D2-рецепторы взаимодействуют с Gαi субъединицами, которые ингибируют аденилатциклазу. (Что касается α1-рецептора, то он взаимодействует с G -субъединицей, которая активирует фосфолипазу С.) Рассмотрим один из примеров, представленных на рисунке. Адреналин связывается с β1-рецептором, что приводит к активации Gαs-белка, который стимулирует аденилатциклазу. Это приводит к увеличению внутриклеточного уровня цАМФ, и, таким образом, усиливает активность ПКА. С другой стороны, норадреналин связывается с α2-рецептором, что приводит к активации Gαi-белка, который ингибирует аденилатциклазу и тем самым снижает внутриклеточный уровень цАМФ, уменьшая активность ПКА.
Рис. 2-9. Индуцированная лигандами (гормонами) активация и ингибирование аденилатциклазы.
А - принципиальный механизм. Б - механизм применительно к конкретным гормонам
Протеинкиназа С и связанные с ней сигнальные пути
Рецептор α1 взаимодействует с Gαq-субъединицей G-белка, которая активирует фосфолипазу С. Фосфолипаза С расщепляет фосфатидилинози- тол-4,5-дифосфат на IP3 и DAG. IP3, связываясь со специфичными лиганд-зависимыми Са2+-каналами эндоплазматического ретикулума, высвобождает из него Са2+, т.е. повышает концентрацию Са2+ в цитозоле. DAG вызывает активацию протеинкиназы С. В нестимулированной клетке этот фермент находится в цитозоле в неактивной
форме. Если цитозольный уровень Са2+ повышается, происходит взаимодействие Са2+ с протеинкиназой С, что приводит к связыванию протеинкиназы С с внутренней поверхностью клеточной мембраны. В таком положении фермент активируется диацилглицеролом, образующимся при гидролизе фосфатидилинозитол-4,5-дифосфа- та. Мембранный фосфатидилсерин также может быть активатором протеинкиназы С, если фермент находится в мембране.
В таблице 2-3 приведены изоформы протеинкиназы С млекопитающих и свойства этих изоформ.
Таблица 2-3.Свойства изоформ протеинкиназы С млекопитающих

ДАГ - диацилглицерол; ФС - фосфатидилсерин; ФФА - цис-ненасыщенные жирные кислоты; ЛФХ - лизофосфатидилхолин.
Рис. 2-10. Сигнальные пути диацилглицерол / инозитол-1,4,5-трифосфат

Фосфолипазы и связанные с ними сигнальные пути на примере арахидоновой кислоты
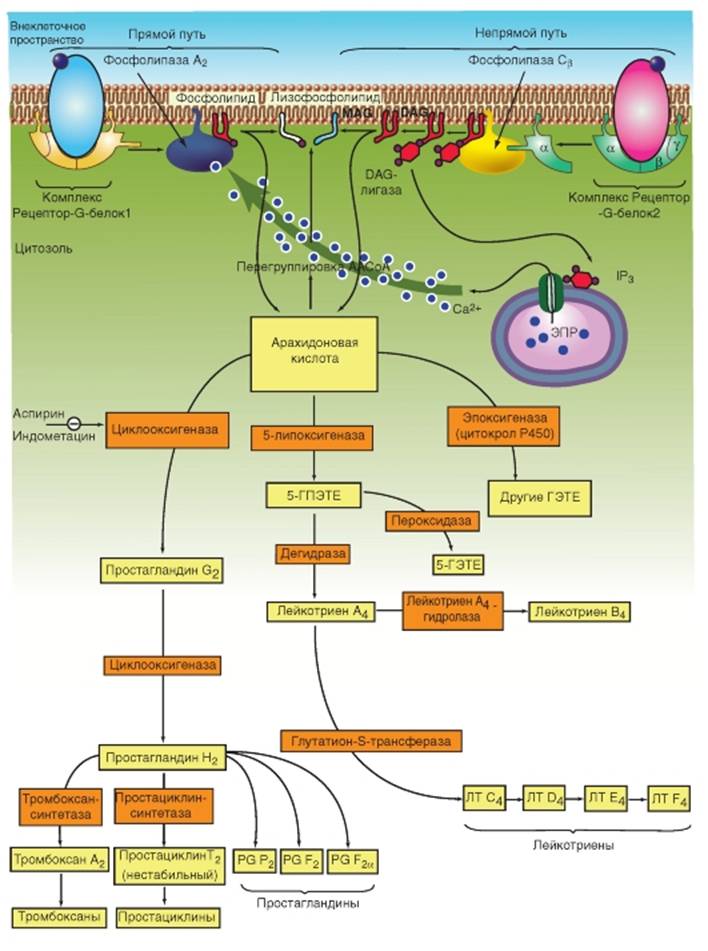
Некоторые агонисты посредством G-белков активируют фосфолипазу А2,которая действует на мембранные фосфолипиды. Продукты их реакций могут активировать протеинкиназу С. В частности, фосфолипаза A2 отделяет от фосфолипидов находящуюся во втором положении жирную кислоту. Вследствие того, что некоторые фосфолипиды содержат в этом положении арахидоновую кислоту, вызванное фосфолипазой A2, расщепление этих фосфолипидов освобождает значительное ее количество.
Вышеописанный сигнальный путь арахидоновой кислоты, связанный с фосфолипазой А2, называют прямым. Непрямой путь активации арахидоновой кислоты связан с фосфолипазой Сβ.
Арахидоновая кислота сама по себе является эффекторной молекулой, а кроме того, служит предшественником для внутриклеточного синтеза простагландинов, простациклинов, тромбоксанови лейкотриенов- важных классов регуляторных молекул. Арахидоновая кислота также образуется из продуктов расщепления диацил-глицеролов.
Простагландины, простациклины и тромбоксаны синтезируются из арахидоновой кислоты циклооксигеназно-зависимым путем,а лейкотриены - липоксигеназно-зависимым путем.Один из противовоспалительных эффектов глюкокортикоидов заключается как раз в ингибировании фосфолипазы A2, которая освобождает арахидоновую кислоту из фосфолипидов. Ацетилсалициловая кислота (аспиринª) и другие нестероидные противовоспалительные средства ингибируют окисление арахидоновой кислоты циклооксигеназой.
Рис. 2-11. Сигнальные пути арахидоновой кислоты.
Обозначения: ПГ - простагландин, ЛГ - лейкотриен, ГПЭТЕ - гидропероксиэйкозатетраеноат, ГЭТЕ - гидроксиэйкозатетраеноат, ЭПР - эндоплазматический ретикулум
Кальмодулин: строение и функции
Множество жизненно важных клеточных процессов, включая освобождение нейротрансмиттеров, секрецию гормонов и мышечное сокращение, регулируется цитозольным уровнем Са2+. Один из путей влияния этого иона на клеточные процессы заключается в его связывании с кальмодулином.
Кальмодулин- белок с молекулярным весом 16 700 (рис. 2-12 А). Он присутствует во всех клетках, иногда составляя до 1% их общего белкового содержимого. Кальмодулин связывает четыре иона кальция (рис. 2-12 Б и В), после чего этот комплекс регулирует активность различных внутриклеточных белков, многие из которых не относятся к протеинкиназам.
Комплекс Са2+ c кальмодулином активирует также кальмодулин-зависимые протеинкиназы. Специфический кальмодулин-зависимые протеинкиназы фосфорилируют специфические эффекторные белки, например, регуляторные легкие цепи миозина, фосфорилазу и фактор элонгации II. Мультифункциональные кальмодулин-зависимые протеинкиназы фосфорилируют многочисленные белки ядра, цитоскелета или мембранные белки. Некоторые кальмодулинзависимые протеинкиназы, такие, как киназа
легкой миозиновой цепи и киназа фосфорилазы, действуют только на один клеточный субстрат, тогда как другие полифункциональны и фосфорилируют более чем один субстратный белок.
Кальмодулин-зависимая протеинкиназа II относится к мажорным белкам нервной системы. В некоторых областях головного мозга на нее приходится до 2% общего белка. Эта киназа участвует в механизме, при котором увеличение концентрации Са2+ в нервном окончании вызывает освобождение нейротрансмиттера по типу экзоцитоза. Ее главным субстратом служит белок под названиемсинапсин I,присутствующий в нервных окончаниях и связывающийся с наружной поверхностью синаптических везикул. Когда синапсин I связан с везикулами, он предотвращает экзоцитоз. Фосфорилирование синапсина I вызывает его отделение от везикул, позволяя им выбросить нейротрансмиттер в синаптическую щель путем экзоцитоза.
Киназа легких цепей миозина играет важную роль в регуляции сокращения гладких мышц. Повышение цитозольной концентрации Са2+ в клетках гладких мышц активирует киназу легких цепей миозина. Фосфорилирование регуляторных легких цепей миозина приводит к длительному сокращению гладкомышечных клеток.
Рис. 2-12. Кальмодулин.
А - кальмодулин без кальция. Б - связывание кальция с кальмодулином и пептидной мишенью. В - схема связывания.
Обозначения: EF - Са2+-связывающие домены кальмодулина

Рецепторы с собственной ферметативной активностью (каталитические рецепторы)
Гормоны и факторы роста связываются с протеинами поверхности клетки, которые имеют ферментативную активность на цитоплазматической стороне мембраны. На рисунке 2-13 представлены пять классов каталитических рецепторов.
Один из характерных экземпляров трансмембранных рецепторов с гуанилатциклазной активностью, рецептор предсердного натрий-уретического пептида (ANP).Мембранный рецептор, с которым связывается ANP, не зависит от рассмотренных систем сигнальной трансдукции. Выше было описано действие внеклеточных агонистов, которые, связываясь с мембранными рецепторами, либо активируют аденилатциклазу через Gs-белки, либо угнетают ее через Gi. Мембранные рецепторы для ANP интересны тем, что сами рецепторы обладают гуанилатциклазной активностью, стимулирующейся связыванием ANP с рецептором.
ANP-рецепторы имеют внеклеточный ANP-свя- зывающий домен, единственную трансмембранную спираль и внутриклеточный гуанилатциклазный домен. Связывание ANP с рецептором повышает внутриклеточный уровень цГМФ , что стимулирует цГМФ-зависимую протеинкиназу. В противоположность цАМФ-зависимой протеинкиназе, имеющей регуляторную и каталитическую субъединицы, регуляторные и каталитические домены цГМФ-зависимой протеинкиназы находятся на одной полипептидной цепи. цГМФзависимая киназа затем фосфорилирует внутриклеточные белки, что приводит к различным клеточным ответам.
Рецепторы с серин-треонин-киназной активностьюфосфорилируют белки только по остаткам серина и/или треонина.
Еще одно семейство мембранных рецепторов, не сопряженных с G-белками, состоит из белков с собственнойтирозин-протеинкиназнойактивностью. Рецепторами с собственной тирозин-протеинкиназной активностьюслужат белки с гликозилированным внеклеточным доменом, единственным
трансмембранным участком и внутриклеточным доменом с тирозин-протеинкиназной активностью. Связывание с ними агониста, например фактора роста нервов (NGF),стимулирует тирозин-протеинкиназную активность, что фосфорилирует специфичные белки-эффекторы по определенным тирозиновым остаткам. Большинство рецепторов для факторов роста димеризуются, когда с ними связывается NGF. Именно димеризация рецептора ведет к появлению у него тирозинпротеинкиназной активности. Активированные рецепторы часто фосфорилируют сами себя, что называется аутофосфорилированием.
К надсемейству пептидных рецепторовотносят рецепторы инсулина. Это также тирозин-протеинкиназы. В подклассе рецепторов, относящихся к семейству инсулиновых рецепторов, нелигандный рецептор существует как дисульфид-связанный димер. Взаимодействие с инсулином приводит к конформационным изменениям обоих мономеров, что повышает связывание инсулина, активирует рецепторную тирозинкиназу и ведет к увеличению аутофосфорилирования рецептора.
Связывание гормона или фактора роста с его рецептором запускает разнообразные клеточные ответы, включая поступление в цитоплазму Са2+, увеличение Na+/H+ обмена, стимуляцию захвата аминокислот и сахара, стимуляцию фосфолипазы Сβ и гидролиз фосфатидилинозитолдифосфата.
Рецепторы гормона роста, пролактинаи эритропоэтина,также как рецепторы интерферонаи многих цитокинов,непосредственно не служат протеинкиназами. Однако после активации эти рецепторы образуют сигнальные комплексы с внутриклеточными тирозин-протеинкиназами, которые и запускают их внутриклеточные эффекты. Именно потому они не являются истинными рецепторами с собственной тирозин-протеинкиназной активностью, а просто связываются с ними.
На основе структуры можно полагать, что трансмембранные тирозин-протеинфосфатазытакже представляют собой рецепторы, а их с тирозин-протеинфосфатазная активность модулируется внеклеточными лигандами.
Рис. 2-13. Каталитические рецепторы.
А - рецептор гуанилциклазы, Б - рецептор с серин-треонин киназной активностью, В - рецептор с собственной тирозин-протеинкиназной активностью, Г - рецепторы, ассоциированные с тирозин-протеинкиназной активностью

Рецептор-связанные тирозинпротеинкиназы на примере рецепторов интерферона
Рецепторы интерферона непосредственно не являются протеинкиназами. После активации эти рецепторы образуют сигнальные комплексы с внутриклеточными тирозин-протеинкиназами, которые и запускают их внутриклеточные эффекты. То есть они не являются истинными рецепторами с собственной тирозин-протеинкиназной активностью, а просто связываются с ними таке рецепторы называются рецептор-связанными (рецептор-зависимыми) тирозин-протеинкиназами.
Механизмы, благодаря которому эти рецепторы оказывают действие, запускаются, когда гормон связывается с рецептором, что вызывает его димеризацию. Рецепторный димер связывает одну или несколько членов Janus-семейства тирозин-протеинкиназ (JAK). JAK затем перекрестно
фосфорилируют друг друга, а также рецептор. Члены семейства преобразователей сигнала и активаторов транскрипции (STAT) связывают фосфорилированные домены на комплексе рецептора и JAK. STAT-белки фосфорилируются JAK-киназами и затем отсоединяются от сигнального комплекса. В конечном итоге фосфорилированные STAT-белки образуют димеры, которые двигаются к ядру, чтобы активировать транскрипцию определенных генов.
Специфичность рецептора для каждого гормона отчасти зависит от специфики членов семейства JAK или STAT, объединяющихся для образования сигнального комплекса. В некоторых случаях сигнальный комплекс также активирует MAP-(митоген-активирующий протеин)-киназный каскад с помощью адапторных белков, используемых рецепторными тирозинкиназами. Некоторые из ответов рецепторных тирозинкиназных лигандов также вовлекают JAK и STAT пути.
Рис. 2-14. Пример каталитических рецепторов, ассоциированных с тирозин-протеинкиназной активностью. Рецептор, активируемыйα-интерфероном (А) иγ-интерфероном (Б)

Ras-подобные мономерные G-белки и опосредованные ими пути трансдукции
Лиганд, например фактор роста, связывается с рецептором, обладающим собственной тирозинпротеинкиназной активностью, что приводит к увеличению транскрипции в 10-ступенчатом процессе. Ras-подобные мономерные ГТФ-связывающие белкиучаствуют в пути сигнальной трансдукции на этапе передачи сигнала от рецепторов с собственной тирозин-протеинкиназной активностью (например, рецепторов фактора роста) на внутриклеточные эффекторы. Активация и инактивация мономерных ГТФ-связывающих белков требуют дополнительных регуляторных белков. Мономерные G-белки активируются гуанин-нуклеотид-освобождающими белками (GNRP), а инактивируются ГТФаза-активирующими белками (GAP).
Мономерные ГТФ-связывающие белки семейства Ras служат посредниками связывания митогенных лигандов и их тирозин-протеинкиназных рецепторов, что запускает внутриклеточные процессы, ведущие к пролиферации клеток. Когда Ras-белки неактивны, клетки не реагируют на факторы роста, действующие через тирозинкиназные рецепторы.
Aктивация Ras запускает путь сигнальной трансдукции, приводящий в конечном итоге к транскрипции определенных генов, способствующих клеточному росту. Каскад MAP-киназы (МАРК) вовлекается в ответы при активации Ras. Протеинкиназа С также активирует каскад MAP- киназы. Таким образом, каскад MAP-киназы оказывается важной точкой конвергенции для разнообразных эффектов, вызывающих клеточную пролиферацию. Более того, здесь наблюдается перекрест между протеинкиназой С и тирозинкиназами. Например γ-изоформа фосфолипазы С активируется путем связывания с активированным Ras-белком. Эта активация передается на протеинкиназу С в процессе стимуляции фосфолипидного гидролиза.
На рисунке 2-15 представлен механизм, включающий 10 ступеней.
1. Связывание лиганда приводит к димеризации рецептора.
2. Активированнаятирозин-протеинкиназа (RTK) фосфорилирует себя.
3. GRB2 (growth factor receptor-bound protein-2), SH2-содержащий протеин, узнает фосфотирозиновые остатки на активированном рецепторе.
4. Связывание GRB2 включает SOS (son of sevenless) обменный протеин гуаниннуклеотида.
5. SOS активирует Ras, формируя на Ras ГТФ вместо ГДФ.
6. Активный комплекс Ras-ГТФ активирует другие протеины физическим включением их в плазматическую мембрану. Активный комплекс Ras-ГТФ взаимодействует с N-терминальной частью серин-треонин киназы Raf-1 (известной как митоген-активирующий протеин, MAP) первой в серии последовательности активированных протеинкиназ, которые передают активационный сигнал в ядро клетки.
7. Raf-1 фосфорилирует и активирует протеинкиназу, названную MEK, которая известна как киназа МАP-киназы (МАРКК). MEK - это мультифункциональная протеинкиназа, фосфорилирующая субстраты остатков тирозина и серина / треонина.
8. MEK фосфорилирует МАP-киназу (МАРК), которая также вызывается внеклеточным сигналом - регуляторной киназой (ERK1, ERK2). Активация МАРК требует двойного фосфорилирования на соседних остатках серина и тирозина.
9. МАРК служит важнейшей эффекторной молекулой в Ras-зависимой сигнальной трансдукции, поскольку она фосфорилирует много клеточных протеинов после митогенной стимуляции.
10. Активированная МАРК переносится в ядро, где она фосфорилирует фактор транскрипции. В целом, активированный Ras активирует МАР
путем связывания с ней. Результатом этого каскада являются фосфорилирование и активация МАР-киназы, которая, в свою очередь, фосфорилирует факторы транскрипции, белковые субстраты и другие протеинкиназы, важные для деления и других ответов клеток. Активация Ras зависит от адаптерных белков, связывающихся с фосфотирозиновыми доменами на активированных факторами роста рецепторах. Эти адаптерные белки присоединяются и активируют GNRF (гуанин-нуклеотидобменный протеин), который активирует Ras.
Рис. 2-15. Регуляция транскрипции Ras-подобными мономерными G-белками, запускаемая с рецептора с собственной тирозин-протеинкиназной активностью

Регуляция транскрипции белком, взаимодействующим с цАМФзависимым элементом ДНК (CREB)
CREB -широко распространенный транскрипционный фактор - в норме связан с участком ДНК, названным CRE (сАМР response element).В отсутствии стимуляции CREB дефосфорилирован и не влияет на транскрипцию. Многочисленные пути сигнальной трансдукции посредством активации киназ (таких, как ПКА, Са2+/кальмо- дулин-киназа IV, МАР-киназа) приводят к фосфорилированию CREB. Фосфорилированный CREB связывается CBP(CREB-binding protein - CREB-связывающим протеином), который имеет домен, стимулирующий транскрипцию. Параллельно фосфорилирование активирует РР1
(фосфопротеинфосфатазу 1), которая дефосфорилирует CREB, что приводит к остановке транскрипции.
Показано, что активация CREB-опосредованно- го механизма важна для реализации таких высших когнитивных функций, как обучение и память.
На рисунке 2-15 показано также строение цАМФзависимой ПКА, которая в отсутствии цАМФ состоит из четырех субъединиц: двух регуляторных и двух каталитических. Присутствие регуляторных субъединиц подавляет ферментативную активность комплекса. Связывание цАМФ индуцирует конформационные изменения в регуляторных субъединицах, в результате чего регуляторные субъединицы отделяются от каталитических. Каталитические ПКА попадают в ядро клетки и запускают изложенный выше процесс.
Рис. 2-16. Регуляция генной транскрипции с помощью CREB (сАМР response element binding protein) через увеличение уровня циклического аденозинмонофосфата

Глава 3. Синапсы
Электрическое взаимодействие клеток: электрический синапс
Впервые ультраструктура межклеточных контактов была подробно изучена в 1963 г. М.Г. Фаркухаром (Farquhar M.G.) и Г.Е. Палейдом (Palade G.E.) на тонких срезах различных эпителиальных клеток. В апикальной области этих клеток были выделены три специализированные структуры. На рисунке 3-1 A схематично представлена клетка с основными известными типами контактных структур.
1. В непосредственной близости к протоку располагается зона замыкания, или плотный контакт (tight junction). Эта зона характеризуется слиянием внешних листков мембран соседних клеток с образованием одиночной электронно-плотной полосы вдоль контакта и представляет собой сеть ветвящихся тонких гребней.
2. Непосредственно к плотному контакту примыкает зона слипания, или промежуточный контакт (intermediate junction). Эта зона характеризуется наличием межклеточной щели шириной 150-200 А,заполненной гомогенным материалом низкой электронной плотности. Кроме того, для этой зоны характерен строгий параллелизм соседних клеточных мембран. В прилегающей к ней цитоплазме перпендикулярно контакту локализованы полосы плотного материала.
3. Десмосома (desmosome) - локальное дискообразное электронно-плотное образование, располагающееся параллельно внутреннему листку каждой клеточной мембраны. Межклеточная щель составляет около 240 А.От каждой десмосомы внутрь цитоплазмы расходятся пучки фибрилл.
4. Введение в практику электронной микроскопии методов обработки материала солями тяжелых металлов позволило идентифицировать еще один тип контактов - щелевой контакт (gap junction), имеющий в области тесного сближения мембран двух соседних клеток межклеточную щель шириной 20-40 А.Именно этот тип контактов клеток представляет значительный интерес для физиологии с позиций межклеточного взаимодействия и будет детально обсуждаться ниже.
5. Позднее в некоторых тканях беспозвоночных был обнаружен еще один тип клеточного контакта, септированный контакт (septate junction), в котором межклеточное пространство шириной в 150-170 Апересекается перегородками (септами) толщиной 40-50 А,связывающими внешние поверхности соседних клеток. Для межклеточного электрического взаимодействия основное значение имеет щелевой контакт.
Щелевой контакт,или gap junction, - наиболее распространенный тип контактов между клетками практически всех тканей животных, присутствующий между клетками как электровозбудимых, так и электроневозбудимых тканей. В бислое мембран обеих клеток, образующих щелевой контакт, белковая часть представлена цилиндрическими структурами, распространяющимися по всей ширине щели и пронизывающими насквозь оба бислоя. Эти структуры представляют собой заполненные водой каналы и служат основой для осуществления физиологических функций щелевого контакта.
Модель части мембран двух клеток, имеющих щелевой контакт, представлена на рис. 3-1 Б. Щелевой контакт состоит из ряда гексагональных субъединиц - коннексонов - с расстоянием между ними 80-100 А.Каждый коннексон состоит из шести коннексинов полипептидной природы, построенных так, что они создают канал, как бы окружая его. Проходя через бислои мембран каждой из двух соседних клеток, коннексоны выходят в межклеточную щель, где соединяются друг с другом и образуют контактную структуру в виде водного канала между цитоплазмой двух соседних клеток. В результате того, что одиночные коннексины каждого коннексона могут изгибаться относительно друг друга, центральный канал коннексона открывается или закрывается. На рис. 3-1 В представлена модель открытого (слева) и закрытого (справа) канала щелевого контакта. Видно, что такой механизм регуляции просвета канала напоминает работу диафрагмы. Радиальное смещение (около 6 А)каждого коннексина соответствует изменению наклона субъединицы по отношению к продольной оси коннексона только на 5°.
Рис. 3-1. Межклеточные контакты и структура щелевого контакта.
А - типы межклеточных контактов. Б - модель структуры щелевого контакта, включающая липидный бислой двух соседних клеток, содержащий коннексоны, каждый из которых построен из шести коннексинов. В - в увеличенном виде представлено открытое и закрытое состояние канала коннексона

Структура коннексонов
Коннексоны позволяют осуществлять обмен ионами и водорастворимыми молекулами с молекулярной массой до 1200-1500 Да между клетками. Это свидетельствует о возможности метаболической кооперации между клетками, когда одна клетка способна передавать другой вещества, которые последняя не синтезирует. Например, АМФ, АДФ или АТФ могут проходить через щелевой контакт. Кроме того через него может осуществляться переход из клетки в клетку цАМФ, внутриклеточного вторичного мессенджера. Эти каналы служат основой и для электротонического взаимодействия между клетками. Центральный канал коннексона может закрываться в результате увеличения концентрации внутриклеточного Са2+ или Н+ в одной из клеток, а также в ответ на деполяризацию одной или обеих клеток.
В целом, щелевые контакты обладают следующими свойствами и функциями:
• это структуры, ответственные за эффективную диффузионную связь между клетками;
• через них могут проникать гидрофильные соединения, не способные проходить через другие участки поверхностных мембран;
• диффузионные каналы между двумя клетками изолированы от остальной межклеточной среды;
• проницаемость контактирующих мембран в области щелевых контактов резко падает при увеличении концентрации свободного внутриклеточного кальция, закисления или деполяризации любой из клеток;
• диффузионные каналы из клетки в клетку способны формироваться в течение десятков секунд или минут при тесном сближении мембран двух соседних клеток.
Пространственная модель щелевого контакта и молекулярная организация коннексина представлены на рис. 3-2 А, Б.
На рисунке 3-2 В показаны различные комбинации коннексинов, формирующих коннексоны, хемиканалы и реальные каналы. Эти данные приведены на основе коннексина (Сх) Сх45 и Сх43.
Наконец, на рис. 3-2 Г представлены две ветви филогенетического древа семейства коннексинов. Примечательно, что разница между двумя выделенными коннексинами из двух разных классов заключается только в четырех аминокислотах.
Рис. 3-2. Коннексоны и их молекулярная организация

Принцип межклеточного электротонического взаимодействия
Для анализа факторов, определяющих условия передачи возбуждения от клетки к клетке, необходимо рассмотреть эквивалентную электрическую схему области контакта, учитывающую все его основные элементы, влияющие на передачу электрического сигнала через эту область. Использование эквивалентных электрических схем позволяет на основании экспериментальных данных количественно оценивать значение того или иного элемента схемы. Контактам разной морфологической структуры соответствуют разные эквивалентные электрические схемы.
Для сравнения рассмотрим два типа клеточных контактов - плотный контакт, клеточный контакт с узкой межклеточной щелью без коннексонов, эквивалентная электрическая схема которого представлена на рис. 3-3 А, и щелевой контакт, эквивалентная электрическая схема которого представлена на рис. 3-3 Б. Последнюю модель рассматривают при условии, что сопротивление утечки стремится к бесконечности. Кроме того, считается, что весь ток проходит из одной клетки в другую по каналам коннексонов, хорошо изолированных от окружающей среды. Эквивалентная электрическая схема в этом случае не содержит емкости. Сопротивление цитоплазмы и наружной среды принимается крайне малым. Такой подход, безусловно, представляется слишком упрощенным, но он приемлем для ряда объектов.
Если в каждую из клеток введены стимулирующие и регистрирующие микроэлектроды, то возможно определить входное сопротивление каждой клетки, обусловленное только свободными неконтактными мембранами, и сопротивление контактной
мембраны. Для этого необходимо через оба стимулирующих микроэлектрода пропускать токи такой силы, чтобы потенциалы обеих клеток стали равны. При этом ток через контакт не идет, и входные сопротивления клеток легко определить:
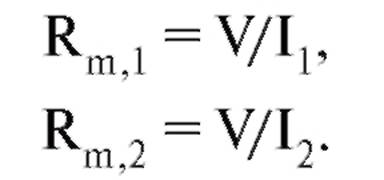
Было введено понятие «коэффициент электрической связи», т.е. отношения

Эти коэффициенты, вообще говоря, не равны друг другу и зависят от входных сопротивлений клеток. Действительно, если сопротивление контактной мембраны в этой модели стремится к нулю, то коэффициент передачи стремится к единице.
Из этих уравнений следует, что K зависит от величины входного сопротивления клетки. Например, изменения потенциала в большой клетке могут сильно сдвинуть потенциал в соседней маленькой клетке с высоким входным сопротивлением. Наоборот, эти же изменения потенциала в маленькой клетке незначительно сдвинут потенциал в большой. Такая зависимость эффектов от клеточных размеров получила название «геометрическое выпрямление». Входное сопротивление клеток зависит не только от их величины, но и от удельного сопротивления их мембраны, поэтому всякое изменение сопротивления одной из клеток меняет электрическую связь между ними, и притом несимметрично.
Рис. 3-3. Эквивалентные электрические схемы клеточных контактов.
А - эквивалентная электрическая схема клеточного контакта с узкой межклеточной щелью (100-200 Å) без коннексонов.
Обозначения: Rm1 и Rm2 - сопротивления поверхностной мембраны клеток 1 и 2, соответственно; Cm1 и Cm2 - емкости поверхностной мембраны клеток 1 и 2, соответственно; R - сопротивление утечки через межклеточную щель, Rc1 и Rc2, Cc1 и Cc2 - общее сопротивление и емкость двух контактных мембран.
Б - эквивалентная электрическая схема клеточного контакта с коннексонами.
Обозначения: Rm1 и Rm2 - сопротивления поверхностной мембраны клеток 1 и 2, соответственно; Cm1 и Cm2 - емкости поверхностной мембраны клеток 1 и 2, соответственно; R - сопротивление утечки через межклеточную щель равно бесконечности; Rc1 и Rc2, Cc1 и Cc2 - общее сопротивление и емкость двух контактных мембран, RJ - суммарное сопротивление всех коннексонов в щелевом контакте

Принципы обнаружения щелевого контакта
Существует несколько принципов, лежащих в основе обнаружения щелевого контакта.
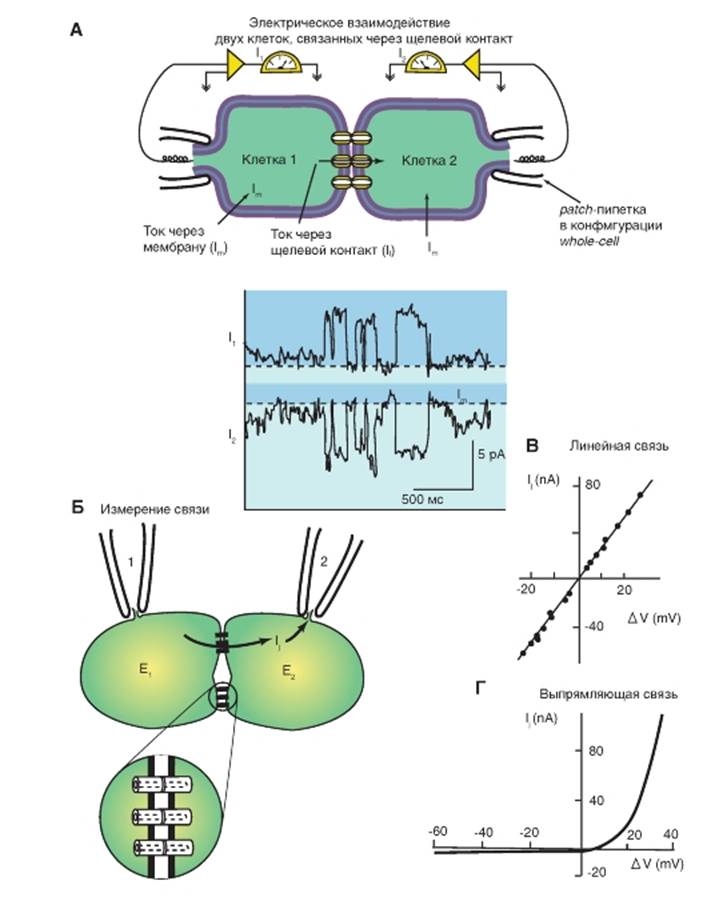
1. Электрофизиологический способ выявления щелевого контакта при помощи пары стандартных микроэлектродов, когда сравнивают электротонические потенциалы в клетке, через которую вводится ток, и в соседней клетке, куда он распространяется, что определяет коэффициент электрической связи (рис. 3-4 А).
2. Электрофизиологический способ определения наличия щелевого контакта с помощью метода двойного patch-clamp и измерения I-V характеристик (рис. 3-5).
3. Метод проведения через щелевой контакт метки, когда внутриклеточно вводят меченое вещество (в большинстве случаев - флуоресцирующий краситель), для которого наружная мембрана непроницаема, и определяют возможность его перетекания в соседние клетки.
3. В последние годы для обнаружения щелевого контакта широко применяют конфокальную микроскопию с использованием меченых антител к коннексинам.
Роль щелевого контакта в проведении возбуждения в ткани
Мембрана электровозбудимых клеток потенциалуправляема, т.е. работа ионных каналов управляется потенциалом, а изменение потенциала зависит от тока, поступающего, например, через щелевой контакт от соседних клеток. При
достижении потенциала порога электровозбудимые клетки генерируют потенциалы действия, распространяющиеся, например у нейронов, по отросткам к другим нервным клеткам или эффекторным органам, у мышечных клеток запускают сокращение, а у возбудимых клеток желез управляют секрецией. Таким образом, функционирование возбудимых тканей связано с распределением потенциала и распространением тока в них. Временные и пространственные характеристики распределения потенциала и тока в тканях зависят от двух факторов: свойств электровозбудимых мембран клеток, образующих данную ткань, и геометрии ткани (как формы клеток, так и типа связей между клетками). Особенности распространения тока в цилиндрической клетке отличаются от особенностей распространения в сферической клетке. Ткань, в которой каждая клетка связана через щелевой контакт всего с одной соседней, будет отличаться от ткани, клетка которой связана с несколькими соседними. Анализ эквивалентной электрической схемы демонстрирует отличия, которые могут проявляться в электрических свойствах и функциональных особенностях ткани.
При небольших сдвигах мембранного потенциала от потенциала покоя проницаемость клеточной мембраны не меняется или меняется очень незначительно, так что ее сопротивление можно считать постоянным. Как обсуждалось ранее, обнаруженные при этом электрические свойства называют пассивными. Эти свойства имеют большое функциональное значение, так как именно они в значительной степени определяют условия возникновения возбуждения в клетке или ткани.
Рис. 3-4. Определение электрической передачи между клетками.
А - электрофизиологический способ определения наличия щелевого контакта и измерения коэффициента электротонической связи. Стрелки показывают направление электрического тока при пропускании через электроды «а» и «б». Б - эквивалентная электрическая схема клетки, имеющей коннексоны с одной соседней клеткой и не имеющей коннексоны с другой соседней.
Обозначения: 1, 2, 3 - соседние клетки. V1 и V2 - падение напряжения на клетках 1 и 2.
В - искусственная внутриклеточная гиперполяризация мембраны клетки вызывает смещение мембранного потенциала в соседней клетке, связанной щелевым контактом, и наоборот. Г - двустороннее электрическое взаимодействие нейронов. Деполяризация первой клетки вызывает смещение мембранного потенциала второй клетки, и наоборот. Аналогично гиперполяризация первой клетки вызывает смещение мембранного потенциала во второй клетке, и наоборот

Методы изучения щелевых контактов
Рассмотрим пассивные электрические свойства сферической клетки и цилиндрического волокна, имеющие одинаковые свойства поверхностной мембраны. Уже такое сравнение достаточно четко показывает роль геометрических факторов.
В клетках, форма которых близка к сферической, сопротивление цитоплазмы крайне мало по сравнению с сопротивлением мембраны самой клетки, а эквивалентная электрическая схема совпадает с эквивалентной схемой мембраны, т.е. представляет собой параллельно соединенные сопротивление и емкость. Мы рассмотрим здесь две пассивные электрические характеристики сферической клетки: входное сопротивление (Rin) и постоянную времени (τ). Входное сопротивление - отношение разности потенциалов на мембране, возникающей при пропускании через клетку постоянного тока, к величине этого тока. Для сферической клетки эта величина совпадает с сопротивлением всей ее поверхностной мембраны. При подаче прямоугольного импульса электрического тока между внутренней частью клетки и наружной средой потенциал на ее мембране лишь постепенно достигает установившегося значения, изменяясь по закону:

Этот вопрос детально проанализирован при обсуждении механизма пассивного электротонического потенциала.
Обсудим функциональное значение Rin. Если на клетку действует синаптический сигнал, а время его действия велико, так что можно пренебречь емкостью мембраны, то синаптический ток будет равен:

где Е - разность потенциала покоя и равновесного потенциала данного синапса; Rs - сопротивление синапса.
При влиянии одного или нескольких синапсов Rs много больше Rin и, следовательно, синаптический ток равен:

Сдвиг потенциала на мембране клетки, создаваемый этим током, равен:

Следовательно, Vs прямо пропорционально Rin. Таким образом, если клетка имеет большие размеры и соответственно маленькое R n, то такой же синапс незначительно изменяет ее потенциал, в то время, как маленькую клетку он может возбудить. Следовательно, Rinвлияет на эффективность действия синапса на клетку, определяя возможность возникновения возбуждения.
Рассмотрим теперь функциональное значение постоянной времени клетки. Обсудим только один из аспектов. Обычно для возбуждения даже маленькой клетки недостаточно активации всего одного синапса. Однако после прекращения работы синапса созданный им на мембране потенциал не спадает мгновенно. Его спад идет экспоненциально с постоянной времени τ. Другими словами, емкость клеточной мембраны постепенно разряжается через ее сопротивление. Если теперь тот же синапс будет активирован вторично, то создаваемый им сдвиг потенциала станет суммироваться с остаточным сдвигом, сохранившимся от первой активации синапса. Такой процесс называют временной суммацией. Ясно, что процесс временной суммации проходит тем эффективнее, чем больше постоянная времени мембраны. Таким образом, величина τ, в частности, определяет способность клетки к временной суммации.
Рис. 3-5. Изучение электрической передачи между клетками методом двойного patch-clamp и измерения I-V характеристик.
А - метод двойного patch-clamp. Показаны одиночные коннексоны. Поскольку потенциал клетки 1 фиксирован на -40 мВ, а потенциал клетки 2 фиксирован на -80 мВ, электрический ток течет через щелевой контакт от клетки 1 к клетке 2. Б - проведение электрического тока через коннексоны при исследованиях методом двойного patch-clamp. Коннексоны увеличены. В - линейная вольт-амперная характеристика септального электрического синапса речного рака. Г - вольт-амперная характеристика аномального выпрямления, т.е. асимметрия в проведении через гигантский электрический синапс речного рака. Примечание: для понимания разницы в вольт-амперных кривых на панелях В и Г вернитесь к описательной части рис. 3-3
Транспорт веществ через щелевой контакт
Одно из важнейших свойств щелевого контакта как транспортной системы состоит в том, что при его наличии между соседними клетками может осуществляться интенсивный диффузионный обмен гидрофильными соединениями с молекулярной массой до 1500 Да, минуя наружную среду. Через коннексоны щелевого контакта проходят неорганические ионы (Na+, K+, Cl-, I-, SO42-), сахара (мальтоза, мальтотриоза, мальтотетроза, сахароза), аминокислоты (аспарагиновая, глутаминовая, гексоглицин), нуклеотиды (гипоксантин, аденин, уридин, тиогуанин). Заметим, что многие из перечисленных веществ не способны диффундировать через наружную мембрану клеток.
Электрический синапс
Принцип работы электрического синапса показан на рис. 3-6 А. Механизм передачи сигнала через электрический синапс аналогичен механизму распространения потенциала действия по нервному волокну. В нервном волокне потенциал действия возникает за счет разности потенциалов между возбужденной и невозбужденной областями. Это вызывает открытие Na+-каналов и генерацию импульса заново на каждом последующем участке волокна. В электрическом синапсе в результате разности потенциалов между возбужденным и невозбужденным участками возникают локальные токи, и потенциал из возбужденной терминали аксона распространяется в постсинаптическую клетку, пройдя через ее мембрану и замыкаясь снаружи. Это приводит к открытию Na+-каналов в мембране постсинаптической клетки и возникновению там потенциала действия. Такой механизм работы требует низкого сопротивления пре- и постсинаптической мембран, что обеспечивается наличием коннексонов.
Основные функции электрических синапсов сводятся к следующим.
1. Быстродействие, что позволяет обеспечивать быстрые реакции организма. Например, гигантские нейроны нервных ганглиев пиявок обеспечивают быстрые сокращения продольной мускулатуры через нейронные цепи, связанные посредством электрических синапсов.
2. Синхронизация работы нейронов. В этом случае электрическая связь клеток обеспечивает их
синхронную работу. Наиболее известные системы таких пар нейронов обеспечивают одновременную работу органов двух сторон тела, например синхронное сокращение продольных мышечных волокон у пиявки.
3. Возникновение импульсных разрядов в группе электрически связанных клеток. Например, у тритона 30 нейронов, связанных электрическими синапсами, запускают реакцию избегания. При возбуждении любого из этих нейронов сразу же включаются все, что обеспечивает полноценность реакции животного.
4. Выпрямление сигнала, что обеспечивает его передачу только в одном направлении. Это хорошо продемонстрировано в мотонейронах пиявок. Односторонняя передача сигнала необходима, чтобы этот сигнал не попал в другую систему с электрической передачей.
Роль щелевого контакта в сердце
В сердечной ткани передача сигнала от клетки к клетке осуществляется только электротонически (рис. 3-6 Б) через щелевые контакты, названные применительно к ткани сердца нексусами. Это достаточно старый термин, не отражающий существа передачи электрического сигнала, мы вводим его для снятия естественных вопросов в случае чтения литературы, посвященной миокардиальной ткани.
В сердце электрическая связь показана для клеток всех его отделов, в том числе между клетками с разной дифференцировкой, например между волокнами Пуркинье и клетками рабочего миокарда. Поскольку щелевые контакты между клетками обладают низким сопротивлением относительно мембраны контактирующих клеток, возбужденная клетка может передавать сигнал невозбужденной, в результате чего эта последняя возбуждается.
Нарушение щелевых контактов между клетками ухудшает условия для распространения возбуждения, что может привести к возникновению частичных или полных блоков проведения на отдельных участках ткани и возникновению различных патологических режимов работы сердца. Однако при повреждении или гибели миокардиальных клеток происходит блокирование проводимости коннексонов между нормальной и поврежденной клетками. Это способствует резкой локализации повреждения и увеличивает жизнеспособность сердца.
Лиганд-рецепторное взаимодействие (основные определения)
Лиганд- это молекула, которая может взаимодействовать с участком связывания(местами связывания) так называемогомолекулярного рецептора- специфическим участком молекулы, в основном белковой природы, встроенной, например, в мембрану клетки или находящейся в цитоплазме. Механизм связывания - либо электрическое притяжение между противоположно заряженными ионными или полярными группами лиганда и участка связывания белка, либо слабое притяжение, обусловленное вандер-ваальсовыми силами между неполярными областями двух молекул. В этом взаимодействии не участвуют ковалентные связи. Белок - молекулярный рецептор может содержать несколько участков связывания, каждый из которых специфичен в отношении определенного лиганда.
Существует два понятия, заложенные исторически в термин «рецептор».В одном случае под термином «рецептор» подразумевают нервные окончания чувствительного нейрона или специализированные нервные клетки, но в другом случае под понятием «рецептор» чаще понимают белковую структуру, рассматриваемую на клеточном уровне, которая имеет участки связывания для сигнальных молекул, например гормонов, трансмиттеров и т.д. Эту белковую структуру часто называют молекулярным рецептором.
Взаимодействие лиганда и участка связывания молекулярного рецептора лежит в основе реализации множества функций как самих белков, так и клеток в целом. Для реализации подобного механизма связывания необходимо, чтобы лиганд находился практически рядом с участком связывания белка, поскольку в противном случае сила электрического притяжения между противоположно заряженными областями на участке связывания молекулярного рецептора и лиганде будет мала. Кроме того, эта сила значительно уменьшается по мере увеличения расстояния между молекулярным рецептором и лигандом. Например, слабые ван-дер-ваальсовы силы действуют только между неполярными группами, расположенными очень близко друг к другу. Эта близость достигается тем, что форма лиганда комплементарна форме участка связывания. Образно можно сказать, что лиганд подходит к участку связывания молекулярного рецептора, как ключ к замку.
Взаимодействие лиганда с участком связывания молекулярного рецептора может быть строго специфичным,и, следовательно, участок связывания
может связывать только один тип лиганда. Эта способность участка связывания молекулярного рецептора взаимодействовать только со строго специфическим лигандом называется химической специфичностью,поскольку участок связывания определяет(ся) тип(ом) химической связи.
Хотя некоторые участки связывания имеют химическую специфичность, которая позволяет им связывать только один тип лиганда, другие участки менее специфичны и, таким образом, способны связывать ряд родственных лигандов, поскольку фрагмент каждого такого лиганда может быть комплементарен форме участка связывания. По этому принципу можно выделить участки связываниясвысоким сродством к лиганду,с промежуточным сродствоми низким сродством.
Молекулярные рецепторы имеют различные аминокислотные последовательности и, соответственно, имеют, различную конфигурацию. Следовательно, они имеют участки связывания различной формы, каждый из которых имеет свою собственную химическую специфичность.
Сила связывания лиганда с участком связывания белка известна как его аффинностьили сродство.В зависимости от того, с какой стороны описывают афинность (с позиций лиганда или с позиций участка связывания), говорят либо об аффинности лиганда по отношению участку связываниярецептора, либо об аффинности участка связывания по отношению к лиганду.В общем случае говорят об аффинности лиганд-рецепторного взаимодействия.
Аффинность лиганда по отношению к участку связыванияопределяет, насколько вероятно то, что связанный лиганд покинет поверхность белка и вернется в несвязанное состояние.
Другим фактором, определяющим процент насыщения участков связывания, является аффинность участка связывания к лиганду(в отличие от афинности лиганда к участку связывания).
Участок связывания, который прочно связывает лиганд, называют участком связывания с высоким сродством(высокоаффинным участком связывания - high-affinity binding site), а тот участок, с которым лиганд связывается слабо, называют участком связывания с низким сродством(низкоаффинным участком связывания - low-affinity binding site). Кроме того, известны участки связывания с промежуточной аффинностью(intermediate-affinity binding site).
Обычные столкновения между молекулами, находящимися в растворе, и рецептором, содержащим связанный лиганд, могут привести к вытеснению непрочно связанного лиганда. Мерой
сродства участка связывания к лиганду служит концентрация лиганда, необходимая для обеспечения 50% насыщения; чем более низкая концентрация лиганда необходима для связывания его с половиной центров связывания, тем больше афинность участка связывания к лиганду.
Аффинностьи химическая специфичностьпредставляют собой два основных свойства участков связывания. Химическая специфичность зависит только от формы участка связывания, а аффинность зависит от силы притяжения между рецептором и лигандом.
Между лигандами, находящимися в растворе, и соответствующими участками связывания белка быстро достигается равновесие, так что в любой момент некоторые свободные лиганды становятся связанными со свободными участками связывания, а некоторые связанные лиганды освобождаются от участков связывания. Для описания этой ситуации применяют понятие насыщение (сатурация),определяющее совокупность участков связывания, содержащих связанный лиганд в данный момент времени. Когда заполнены все участки связывания, говорят о 100% насыщении. Когда лиганд связан с половиной имеющихся участков связывания, система насыщена на 50% и т.д. Единичный участок связывания также будет насыщен на 50%, если он содержит связанный лиганд в течение 50% времени.
Процент насыщения участков связывания зависит и от концентрации свободного лиганда в растворе, и от аффинности участка связывания к лиганду. И, как и степень выраженности биологического эффекта, он будет увеличиваться с увеличением количества занятых лигандом участков связывания до тех пор, пока все они не будут заполнены. Дальнейшее увеличение концентрации лиганда не приведет ни к какому результату, поскольку все участки связывания уже заняты.
В ряде случаев с определенными участками связывания наблюдаеться конкуренциямежду лигандами за один и тот же участок связывания.
Например, если в растворе присутствуют два конкурирующих лиганда «А» и «Б», то увеличение концентрации лиганда «А» приведет к увеличению количества связанного лиганда «А», уменьшая, таким образом, количество участков, доступных для лиганда «Б», и снижая количество связанного лиганда «Б». Многие лекарства обеспечивают свое действие путем конкуренции за участки связывания с эндогенными лигандами организма. Занимая связывающий участок, лекарство уменьшает количество природного лиганда, который может быть связан с этим центром.
Лиганды могут быть агонистамиили антагонистами.
Агонист- это лиганд, который взаимодействует с участком связывания и изменяет состояние молекулярного рецептора, заканчивающееся биологическим ответом. Например, в химическом синапсе агонистами называют вещества, действующие подобно трансмиттеру.
Обычные (классические) агонисты(conventional agonists) усиливают активность рецептора, тогда как обратные агонисты(inverse agonists) уменьшают эту активность.
Основной, или ортостерический участок связывания
Экзогенные агонистымогут действовать посредством связывания с тем же самым участком связывания, как эндогенные агонисты(primary - основной, или orthosteric - ортостерический участок связывания) или реже с другой частью макромолекулы рецептора(аллостерический, или аллотопический участок связывания).Агонисты этой второй категории иногда называют аллостерическими(аллотопическими) активаторами,или аллостерическими(аллотопическими) агонистами.
Некоторые агонисты (например, глутамат) могут быть эффективны только в присутствии другого лиганда (например, глицина в случае глутамата), который взаимодействует с другим участком связывания на макромолекуле рецептора. В этих условиях глутамат представляет собой первичный агонист,а глицин выступает как ко-агонист.
Наряду с агонистами существуют химические соединения, которые хотя и взаимодействуют с участком связывания на макромолекуле рецептора, но не могут открыть ионный канал. Занимая участок связывания, они препятствуют рецепции естественного трансмиттера и возникновению его эффекта, поскольку действуют на ту же самую макромолекулу рецептора, что и агонист. Такие вещества называютантагонистами.
Антагонизм может быть химическимили функциональным.
Химический антагонизм- это результат наличия в среде антагониста и способности участка связывания белка взаимодействовать с ним. Функциональный антагонизм происходит на участках клетки, не имеющих отношения к рецептору, опосредующему ответ агониста.
Функциональный антагонизмможет осуществляться с помощью разных механизмов в виде непрямогои физиологического антагонизма.Непрямой антагонизм представляет собой конкуренцию антагониста и агониста за место
связывания с лигандом в промежуточной макромолекуле, которая участвует в осуществлении агонистом его биологической реакции. Связывание этого участка на промежуточной молекуле с антагонистом не дает возможности осуществиться этой реакции. При физиологическом антагонизме действие одного агониста обычно через другой рецептор оказывает противоположный эффект по отношению к эффекту, свойственному оригинальному агонисту.
Поскольку белки вовлечены практически во все процессы, происходящие в клетке, механизмы, контролирующие эти функции, сконцентрированы на регуляции активности белков. Известно два способа регуляции активности белков: (1) посредством изменения конформации молекулы белка, что влияет на связывание лиганда, и (2) через регуляцию синтеза и деградации белков, что определяет типы белков и их количество в клетке. В контексте настоящего материала представляется важным коротко обсудить первый тип регуляции - контроль за конформацией молекулы белка.
Поскольку конформация белков зависит от электрического притяжения между заряженными или поляризованными группами в различных областях белка, изменение в распределении заряда вдоль полипептидной цепи или полярности молекул, непосредственно окружающих его, изменяет конформацию белка. Известны два механизма, используемых клетками для селективного изменения конформации определенных белков. Это аллостерическая и ковалентная модуляция.
Прежде всего, обсудим аллостерическую модуляцию.При связывании лиганда с белком силы, притягивающие лиганд к белку, изменяют его конформацию. Например, когда лиганд приближается к участку связывания, эти силы могут вызвать изменение формы поверхности участка связывания и придавать форму, наиболее соответствующую форме поверхности лиганда. Более того, изменение формы участка связывания приводит к изменению формы других областей белка. Таким образом, если белок содержит два участка связывания, нековалентное связывание лиганда с одним из участков может изменить форму второго участка связывания и характеристики связывания этого второго участка. Такое явление названо аллостерической модуляцией, а такие белки - аллостерическими.
Один участок связывания аллостерического белка, названный активным центром (функциональным центром), взаимодействует со своим лигандом и обеспечивает физиологическую активность белка. Однако для этого необходимо, чтобы
предварительно другой участок связывания, названный регуляторным центром, соединился со своим лигандом и изменил форму активного центра. Лиганд, который связывается с регуляторным участком, называют модуляторной молекулой.
Таким образом, модуляторная молекула (иначе аллостерический или атопический модулятор) представляет собой лиганд, увеличивающий или уменьшающий действие (основного, или ортостерического) агониста или антагониста, соединяясь с другим (аллостерическим, или аллотопическим) местом на рецепторной макромолекуле, т.е. с регуляторным центром.
Среди аллостерических (аллотопических) модуляторов выделяют несколько видов.
1. Аллостерические (аллотопические) усилители(allosteric enhancers) - это модуляторы, которые усиливают аффинность ортостерических лигандов и/или эффективность агониста, не создавая никакого собственного эффекта.
2. Аллостерические (аллотопические) антагонисты- это модуляторы, которые уменьшают аффинность ортостерических лигандов и/или эффективность агонистов.
3. Аллостерические (аллотопические) агонисты,или аллостерические (аллотопические) активаторы - это лиганды, которые способны опосредовать активацию рецептора их собственным путем, связываясь с центром распознавания на макромолекуле рецептора, отличающийся от основного (ортостерического) участка связывания.
4. Нейтральные аллостерические (аллотопические) лигандывзаимодействуют с аллостерическим участком связывания без влияния на связывание или функции ортостерических лигандов, но могут все еще блокировать действие других аллостерических модуляторов, которые действуют через тот же самый аллостерический участок связывания.
В некоторых аллостерических белках связывание молекулы модулятора с регуляторным центром обеспечивает включение, а в других - выключение активного центра. Кроме того, связывание модуляторной молекулы может уменьшать или увеличивать сродство активного центра к лиганду. Взаимодействие между регуляторными и активными центрами белка - это один из способов регуляции. Существует и другой способ, когда активные центры определенных белков могут влиять друг на друга. Обычно эти белки состоят более чем из одной полипептидной цепи, соединенной вместе благодаря электрическому притяжению между отдельными цепями. При этом на каждой цепи может быть только один связывающий участок,
служащий активным центром. Однако связывание лиганда с активным центром одной из цепей может приводить к изменению активных центров, расположенных на других цепях. Явление взаимодействия между активными центрами в мультимерном белке (т.е. в белке, содержащем более чем одну полипептидную цепь) называют кооперативностью.Кооперативность может обеспечивать прогрессивное увеличение аффинности для связываемого лиганда по мере того, как все большее количество участков белка связывают лиганд.
Синтопическое взаимодействие(syntopic interaction) - это взаимодействие между лигандами, которые связываются с тем же самым центром распознавания или с местами распознавания, которые перекрываются, на рецепторной макромолекуле. Этот термин чаще всего применяют при описании конкурентоспособных взаимодействий между лигандами, которые связываются с основным (ортостерическим) участком связывания на рецепторе. Но синтопическое взаимодействие может также происходить между различными лигандами, совместно использующими одинаковый центр распознавания (например, общий аллостерический центр) где-нибудь на макромолекуле рецептора.
Аллостерическое (аллотопическое) взаимодействие- это взаимодействие между лигандами, которые связываются с отличающимися неперекрывающимися местами распознавания на макромолекуле рецептора. Термины «синтопический» и «аллотопический» рекомендованы для того, чтобы различать взаимодействия, происходящие в общем (том же самом) месте, по сравнению с взаимодействием между различными местами соответственно. Термин «аллотопический» может быть использован равноценно с термином «аллостерический» при описании перекрестного взаимодействия между различными участками на макромолекуле рецептора. Термин «синтопический» должен быть ограничен, определяя взаимодействия в общем (том же самом) месте, и не должен использоваться заменяемо с термином «ортостерический». Последний термин относится только к основному месту распознавания на рецепторе (месту связывания эндогенного агониста).
Аллостерический переход(allosteric transition) - это изомеризация макромолекулы рецептора с большим числом конформационных состояний. Различные авторы использовали термин «аллостерический» в различных ситуациях. Первое
общее применение термина должно описать любой механизм, включающий изомеризацию рецептора с двумя или более конформационными состояниями, каждое из которых может иметь различную аффинность к данному лиганду. Второе общее использование термина должно описывать взаимодействие между двумя топографически отличающимися местами распознавания на макромолекуле рецептора в данном конформационном состоянии. Чтобы применять оба варианта использования терминов, рекомендуют, чтобы термин «аллостерический переход» применяли при описании механизмов изомеризации рецептора. Термин «аллостерическое (или аллотопическое) взаимодействие» необходимо использовать при описании перекрестного взаимодействия между лигандами, связывающимися с неперекрывающимися местами распознавания на макромолекуле рецептора.
Ковалентная модуляция- это второй способ изменить форму и, таким образом, активность белка. Ковалентная модуляция заключается в ковалентном присоединении заряженных химических групп к некоторым боковым остаткам аминокислот полипептидной цепи. В русскоязычной литературе это явление обычно называется «ковалентной модификацией».
В большинстве случаев к белку с помощью реакции фосфорилирования ковалентно прикрепляется фосфатная группа, несущая отрицательный заряд. В этом случае фосфатная группа переносится с одной молекулы на другую. Фосфорилирование одного из боковых остатков определенной аминокислоты в белке приводит к появлению в этой области отрицательного заряда, который обеспечивает изменение его конформации. Если изменение конформации влияет на участок связывания, это приводит к изменению свойств участка связывания. Хотя такой механизм значительно отличается от описанного выше, эффекты, производимые ковалентной модуляцией, подобны эффектам аллостерической модуляции. То есть при ковалентной модуляции функциональный участок связывания может быть включен или выключен либо может быть изменена его аффинность для лиганда. Напомним, что в отличие от аллостерической модуляции, которая обеспечивается нековалентным связыванием модуляторной молекулы, ковалентная модуляция требует химической реакции, в которой образуется ковалентная связь.
Химический синапс
Химический синапс выполняет задачу передачи электрического сигнала от пресинаптического нейрона на постсинаптическую клетку. Для этого существует комплекс механизмов, которые в ответ на изменение потенциала мембраны в пресинаптической клетке приводят к изменению потенциала мембраны постсинаптической клетки. Итак, электрический сигнал пришел на пресинаптическую мембрану и вызвал ее деполяризацию. В результате этого произошло освобождение из везикул пресинаптической зоны специфических переносчиков, называемых нейротрансмиттерами,или медиаторами.Эти химические соединения диффундируют к постсинаптической области и открывают на постсинаптической мембране ионные каналы. Так как потенциал покоя мембраны каждой клетки определяется равновесием между различными ионными токами, оно может нарушаться, если определенный вид ионов вдруг начнет усиленно диффундировать через клеточную мембрану по электрохимическому градиенту. Если, например, мембрана клетки станет проницаемой для ионов Na+, то эти ионы по электрохимическому градиенту начнут входить в клетку. В результате происходит деполяризация мембраны клетки. Именно это и происходит на постсинаптической мембране, в чем заключается важный принцип: изменение возможности проводимости определенных ионов через постсинаптическую мембрану служит основой функции химических синапсов. Ионные токи изменяют потенциал мембраны постсинаптической клетки, поэтому такие изменения потенциала называютпостсинаптическими потенциалами.Так как в формировании потенциала покоя мембраны участвует большое число ионов, равновесие может нарушаться посредством изменений проводимости различных ионов. Так, например, при дополнительном выходящем токе ионов K+ или при входящем токе ионов Cl- может происходить гиперполяризация, которая является противоположностью возбуждения. Т.е. определенные химические процессы на постсинаптической мембране могут посредством гиперполяризации вызывать и торможение нейрона. В этой возможности можно видеть существенное эволюционное преимущество химических синапсов.
Совершенно очевидно, что представленные химические процессы могут быть модифицированы посредством других химических веществ. Это происходит при помощи независимых соединений - нейромодуляторов.
С другой стороны, химические процессы в синапсе открывают широкие возможности для фармакологической регуляции и оказываются предметом многочисленных исследований с целью поиска эндогенных соединений, способных модифицировать в заданных направлениях синаптическую передачу. И действительно, многие медикаменты реализуют свое фармакологическое действие путем влияния на синаптическое проведение. Это относится не только к психотропным и наркотическим веществам. Многие другие, например, (гипотензивные) средства понижающие артериальное давление, также действуют опосредованно через синапсы. Кроме того, многие яды растительного и животного происхождения направленно действуют на химический синапс.
Необходимо подчеркнуть, что нейротрансмиттеры, наряду с их прямыми задачами, имеют также большое значение в передаче информации: во время нейроонтогенеза (зародышевого и раннего развития до года) они играют важнейшую роль при образовании связей в церебральных структурах. Так как большинство соединений с наркотическим действием влияет на функцию нейротрансмиттеров, то их потребление в том или ином виде матерью во время беременности или грудного вскармливания имеет негативные последствия для нейроонтогенеза ребенка.
Почти все синаптические терминали освобождают не один трансмиттер, но одновременно с ним целый ряд биологически активных соединений. Примерами таких сопутствующих соединений служат АТФ, ГТФ, окситоцин, вещество Р, энкефалин и др. Их называюткотрансмиттеры.Многие трансмиттеры, например, глицин и ГАМК или глицин и глутамат могут присутствовать в везикулах одновременно. Котрансмиттеры могут модулировать синаптические процессы. Накапливаясь в везикулах, они обладают собственной кинетикой освобождения, например освобождение только при значительной величине пресинаптического потенциала.
Рис. 3-6. Химический синапс и принцип его работы

Аксональный транспорт
Мембранные и цитоплазматические компоненты, которые образуются в биосинтезирующем аппарате сомы и проксимальной части дендритов, должны распределяться по аксону (особенно важно их поступление в пресинаптические структуры синапсов), чтобы восполнить потерю элементов, подвергшихся высвобождению или инактивации. Однако многие аксоны слишком длинны, чтобы материалы могли эффективно перемещаться из сомы к синаптическим окончаниям путем простой диффузии. Эту задачу выполняет особый механизм - аксональный транспорт.
Существуют несколько типов аксонального транспорта. Окруженные мембранами органоиды и митохондрии транспортируются с относительно большой скоростью посредством быстрого аксонального транспорта.Вещества, растворенные в цитоплазме (например, белки), перемещаются с помощью медленного аксонального транспорта.У млекопитающих быстрый аксональный транспорт имеет скорость 400 мм/сутки, а медленный аксональный транспорт - около 1 мм/сутки. Синаптические пузырьки могут передвигаться с помощью быстрого транспорта из сомы мотонейрона спинного мозга человека к нервно-мышечному соединению стопы примерно за 2,5 суток. Сравним: доставка на такое же расстояние многих растворимых белков происходит примерно за 3 года.
Для аксонального транспорта требуется затрата метаболической энергии и присутствие внутриклеточного Са2+. Элементы цитоскелета (точнее, микротрубочки) создают систему направляющих тяжей, вдоль которых передвигаются окруженные мембранами органоиды (рис. 3.7). Эти органоиды прикрепляются к микротрубочкам аналогично тому, как это происходит между толстыми и тонкими филаментами волокон скелетных мышц; движение органоидов вдоль микротрубочек запускается ионами Са2+.
Аксональный транспорт осуществляется в двух направлениях. Транспорт от сомы к аксональным терминалям, называемыйантероградным аксональным транспортом,восполняет в пресинаптических окончаниях запас синаптических пузырьков и ферментов, ответственных за синтез нейромедиатора. Транспорт в противоположном направлении - ретроградный аксональный транспорт,возвращает опустошенные синаптические
пузырьки в сому, где эти мембранные структуры деградируются лизосомами.
Высокая, в ряде случаев, потребность в молекулах трансмиттера вызывает, как правило, синтез трансмиттера на месте, то есть непосредственно в пресинаптическом окончании. Разумеется, необходимые для синтеза ферменты синтетизируются в теле и при поморщи аксонального транспорта доставляются в синаптические окончания. Поскольку пути синтеза трансмиттера зависят от вида, рассмотрим их на примере обсуждаемого выше холинэргического синапса. Другие трансмиттерные вещества имеют, разумеется, свои собственные пути синтеза.
АЦХ образуется с помощью холин-ацетилтрансферазы путем ацетилирования холина, причем остаток уксусной кислоты образуется из ацетилкоэнзима-А. Холин широко распространен в организме и включается в нервное окончание при помощи двух различных механизмов транспорта, из которых один обладает очень высоким сродством (так называемый высокоаффинный захват). Этот путь блокируется при помощи гемихолина. Если нервное окончание деполяризовано (активировано), то захват холина ускоряется. АЦХ, синтетизированный в цитоплазме, активно транспортируется и накапливается в синаптических везикулах. Это приводит к очень высокой концентрации АЦХ от 0.2 М до 0.6 М, что соответствует нескольким тысячам молекул на везикулу. В целом можно сказать, что низкомолекулярные трансмиттеры накапливаются в маленьких (40-50 нм) электронно-оптически прозрачных везикулах, тогда как большие (>70 нм) электронно-оптически плотные везикулы содержат белки и пептиды. Эти соединения образуются не в пресинаптическом окончании, а в теле клетки и попадают при помощи аксонального транспорта в пресинаптическое окончание.
Теперь необходимо отметить, что хотя синапсы называются на основании названия их главного трансмиттера (например, холинэргический), почти все синаптические терминали освобождают не только один единственный трансмиттер, но одновременно с ним целый ряд биологически активных соединений - ко-трансмиттеров. Примерами таких сопутствующих соединений являются АТФ, ГТФ, окситоцин, вещество Р, энкефалин, и другие. Ко-трансмиттеры могут модулировать синаптический процесс.
Рис. 3-7. Синтез и рецикл синаптических везикул и их содержимого.
А - Биосинтез нейротрансмиттеров.
I. Везикулы, предшественники пептидных трансмиттеров и ферменты синтезируются в теле нейрона и высвобождаются из аппарата Гольджи.
II. Везикулы перемещаются по аксону с помощью быстрого аксонального транспорта. Пептидные трансмиттеры уже заключены в некоторые везикулы.
III. Непептидные нейротрансмиттеры синтезируются и транспортируются в везикулы непосредственно в нервных окончаниях
Б - Экзоцитоз (высвобождение визикул с медиатором)
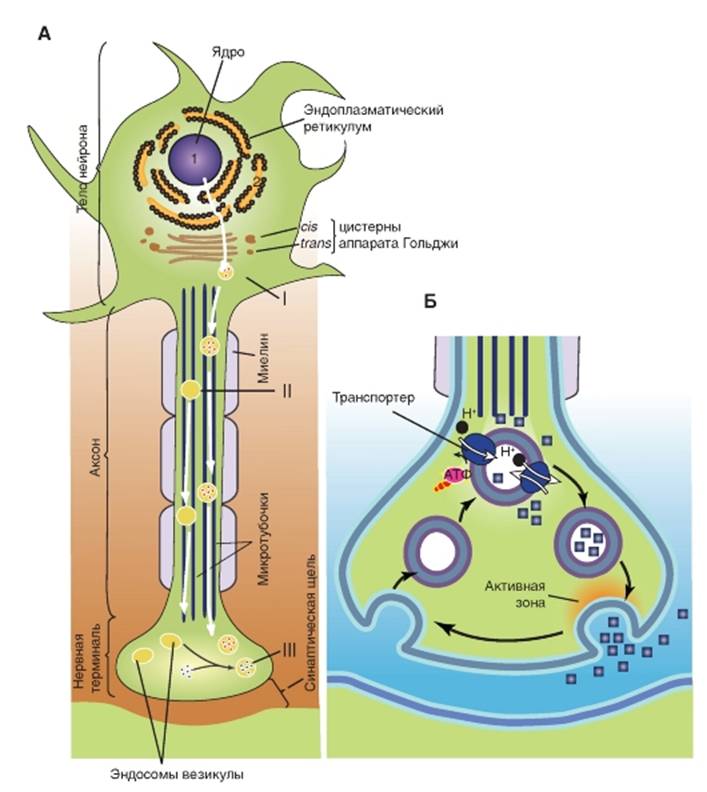
Механизм высвобождения трансмиттера
Серия потенциалов действия «пробегает» вдоль аксона, достигает нервного окончания и деполяризует пресинаптическую зону. Во время этой деполяризации в нервном окончании возникает не только входящий ток Na+, как это происходит в мембране по всей длине аксона. Мембрана окончания аксона имеет и потенциал-управляемые Ca2+- каналы, через которые во время деполяризации, вызванной пришедшим потенциалом действия, ионы Ca2+ проникают в синаптическое окончание. В состоянии покоя очень низкая концентрация Ca2+ (приблизительно 10-7 М) повышается на несколько порядков. Одновременно ионы Ca2+ дополнительно выходят из эндоплазматического ретикулума. В каждом случае требуется некоторое время (приблизительно 0,2 мс), прежде чем цитоплазматический уровень свободного кальция (кальциевое зеркало) достигнет необходимых действенных концентраций. В синаптическом окончании в зоне пресинаптической мембраны расположено большое число синаптических пузырьков (везикул).Их мембраны, подобно клеточной мембране, состоят из фосфолипидного бислоя и белков. Эти везикулы заполнены жидкостью, в составе которой содержится химическое вещество - трансмиттер, благодаря которому осуществляется синаптическая передача. Трансмиттер «переносит» возбуждение от пресинаптической мембраны на постсинаптическую мембрану, откуда и берется его название.
Синаптические везикулы фиксируются большей частью к цитоскелету посредством протеина синапсина(synapsin), локализованного на цитоплазматической поверхности каждой везикулы, к протеину спектрину(spectrin), расположенному на волокнах F-актина цитоскелета, образуя тем самым трансмиттерный резервуар. Меньшая часть везикул также связана с внутренней стороной пресинаптической мембраны с помощью
специфических протеинов. Это взаимодействие осуществляется посредством белка мембраны везикулы - синаптобревина(synaptobrevin) и белка пресинаптической мембраны синтаксина(syntaxin). Именно эти везикулы непосредственно поставляют трансмиттер для очередного выброса.
Если потенциал действия достиг пресинаптической области, и в пресинаптическом окончании концентрация Ca2+ поднялась до необходимого уровня, то происходят два процесса. Во-первых, на уже связанных с пресинаптической мембраной везикулах, по существу, лежащих на ней, Ca2+ связывается с протеином, входящим в мембрану везикулы - синаптотагмином(synaptotagmin). Это приводит к тому, что мембрана везикулы раскрывается. Одновременно комплекс полипептида, называемого синаптофизином(synaptophysin), сливается с неидентифицированными протеинами пресинаптической мембраны. При этом возникает пора, через которую осуществляется регулируемый экзоцитоз, т.е. секреция трансмиттера в синаптическую щель, причем этот процесс регулирует еще один протеин везикулы - rab3А. В одной везикуле сосредоточено примерно 6000-8000 молекул трансмиттера, и это именно то наименьшее количество трансмиттера, освобожденного в синаптическую щель, которое называется 1 квант трансмиттера. В совокупности локальная концентрация трансмиттера в синаптической щели после его освобождения относительно высока и лежит в миллимолярном диапазоне.
Во-вторых, повышенный уровень ионов Ca2+ в пресинаптическом окончании активирует Ca2+-кальмодулин-зависимую протеинкиназу II (СаМ-киназа II). В пресинаптическом окончании этот фермент фосфорилирует синапсин. После этого нагруженные трансмиттером везикулы освобождаются от цитоскелета и перемещаются на пресинаптическую мембрану для осуществления дальнейшего цикла.
Рис. 3-8. Высвобождение трансмиттеров.
А - белки, встроенные в мембрану везикулы. Б - взаимодействие везикулярных белков и белков пресинаптической мембраны. В - механизм высвобождения трансмиттера из везикулы.
Б - экзоцитоз (высвобождение везикул с медиатором)

Преобразование трансмиттера
Трансмиттер может быть либо быстро химически расщеплен на неактивные компоненты, либо удален из синаптической щели путем высокоселективного обратного захвата в пресинаптическое окончание. В центральной нервной системе клетки глии могут также захватывать трансмиттер. Кроме того, на возбуждающих глутаматергических синапсах синаптическая область плотно покрыта отростками астроцитов. Какой из инактивирующих механизмов играет в синапсе большую роль - зависит от типа синапса.
Так, АЦХ, исключительно быстро гидролизуется АЦХ-эстеразой. Возникают ацетат (остаток ацетила) и холин. Последний, благодаря высокоспецифичному механизму транспорта, опять захватывается пресинаптическим окончанием и вновь используется для образования АЦХ. На этом уровне возможна фармакологическая регуляция холинергических синапсов. АЦХ-эстеразу можно ингибировать рядом соединений, например эзерином ( physostigmin). Продолжительность постсинаптического действия выброшенного АЦХ при этом удлиняется. Терапевтически это используется в тех случаях, когда для устранения мышечной релаксации после наркоза конкурентные блокаторы типа кураре хотят вытеснить с помощью высокой концентрации АЦХ. Таким способом можно очень быстро восстановить мышечный тонус.
Пресинаптические окончания благодаря описанному механизму обратного захвата (реаптейка)
захватывают и возвращают либо фрагменты трансмиттера (например, холин), либо всю молекулу трансмиттера (например, серотонин). Для этого в пресинаптической мембране находятся специфические протеины - транспортеры. Данный механизм обратного захвата фрагментов или всей молекулы трансмиттера, в свою очередь, может находиться опять под влиянием многих синапсов. Ряд психофармакологических веществ используют этот синаптический механизм в качестве мишени. Так, например, антидепрессант имипрамин блокирует обратный захват катехоламинов адренергическими синапсами. Тем самым повышается эффективность действия трансмиттера. Группа таких веществ называется ингибиторами обратного захвата, их часто применяют в психофармакологии.
Мембрана везикулы после освобождения трансмиттера также рециклируется. Она эндоцитотически поступает в пресинаптическое окончание и используется для вновь образуемого связывания везикул.
Во многих синапсах рецепторы для трансмиттера есть не только в постсинаптической мембране, но также и в пресинаптической. Это так называемые ауторецепторы. В зависимости от типа синапса, при взаимодействии с ними трансмиттера его высвосвобождение либо усиливается, либо прекращается (позитивное или негативная обратная связь). На ауторецепторы может оказывать влияние также входящий ток Ca2+ в пресинаптическом окончании.
Рис. 3-9. Расщепление, удаление и обратный захват трансмиттера на примере ацетилхолина

Типы химических синапсов
У части синапсов ионный канал, который при действии лиганда, т.е. благодаря связыванию с молекулой трансмиттера, открывается (каналы, управляемые лигандами), называется ионотропным рецептором(рис. 3-10 А).
Рецепторы, в которых открытие ионного канала связано с подключением других химических процессов, называют метаботропными рецепторами.На метаботропных рецепторах лиганд открывает ионный канал не прямо, а опосредованно, через вторичные мессенджеры (рис. 3-10 Б). У большинства синапсов рецепторный белок не представляет собой ионный канал, но при связывании с ним молекул трансмиттера возникает каскад химических реакций, в результате которых соседствующие ионные каналы открываются при помощи вторичных мессенджеров. Речь идет о метаботропных рецепторах.
Хорошим примером и ионотропного, и метаботропного синапса служит холинергический синапс, у которого трансмиттером служит АЦХ. У холинергических синапсов два типа рецепторов: АЦХ-рецепторы, чувствительные дополнительно
к никотину (никотиновый АЦХ-рецептор), и АЦХ-рецепторы, чувствительные дополнительно к мускарину (мускариновый АЦХ-рецептор). Первый является ионотропным, второй - метаботропным.
У мускариновых синапсов и место связывания с трансмиттером, и ионный канал локализованы не в самом трансмембранном белке. Эти рецепторы связаны непосредственно с G-белком. Такая структура дает дополнительные возможности для влияния на функцию синапсов. С одной стороны, для таких рецепторов также существуют конкурентные блокаторы. У мускариновых синапсов это, например, атропин, - алкалоид, содержащийся в растениях семейства пасленовых. Очевидно, что синаптическая передача, в которой используются такие механизмы, очень медленная. До изменения проводимости мембраны должны произойти многие химические реакции. Время передачи лежит в диапазоне от 100 мс. К мускариновым синапсам относятся постганглионарные, парасимпатические и ауторецепторы центральной нервной системы. Мускариновые рецепторы, образованные от аксонов маутнеровских клеток nucleus basalis (Meynert cells), управляют особыми процессами обучения.
Таблица 3-1.Перечень соединений, влияющие на никотиновые, мускариновые и холинергические синапсы

Рис. 3-10. Ионотропные и метаботропные синапсы
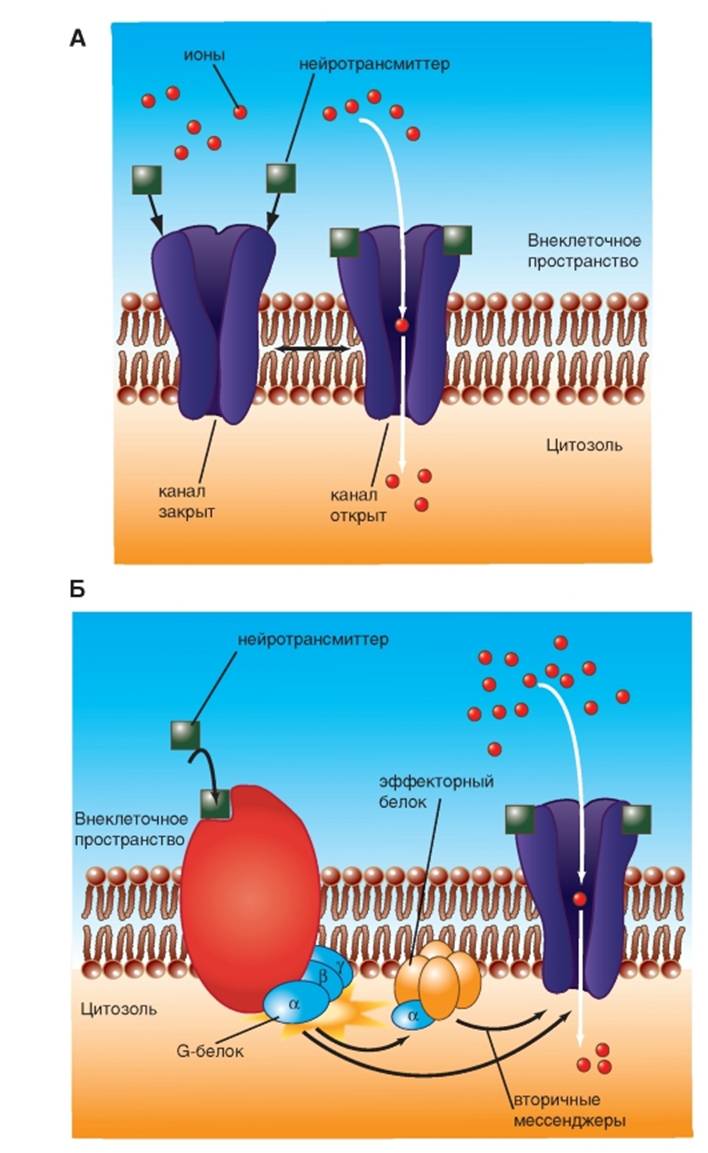
Типы трансмиттеров и механизмы их действия
Ацетилхолин.Является медиатором для всех двигательных нейронов, многих интернейронов ЦНС, а также нейронов парасимпатической нервной системы. Существует 2 типа рецепторов ацетилхолина: АЦХ-рецепторы, чувствительные дополнительно к никотину: никотиновый АЦХрецептор и, соответственно, никотиновый АЦХ (нАЦХ) синапс, и АЦХ-рецепторы, чувствительные дополнительно к мускарину - мускариновый АЦХ-рецептор и, соответственно, мускариновый (мАЦХ) АЦХ синапс. АЦХ синапс с никотиновым рецептором являются ионотропными, а АЦХ синапсы с мускариновым рецептором являются метаботропными.
Глутаматв синапсах выполняет функцию трансмиттера и ко-трансмиттерами (может присутствовать одновременно с другими трансмиттерами, например с глицином). Глутамат в мозге является важнейшим трансмиттером для возбуждающих синапсов. Синапсы, использующие в качестве трансмиттера глутамат, находятся приблизительно на 50% нейронов центральной нервной системы. Такие синапсы образуют важнейшие возбуждающие входы систем мозга к коре большого мозга. Они принимают участие в процессах обучения. Глутамат прямо открывает неспецифический ионный канал для катионов.
Глицинслужит трансмиттером тормозных синапсов и действует как нейромодулятор. Глицин предназначен для выполнения специфических ингибиторных задач. Большинство клеток Реншоу, через которые тормозятся α-мотонейроны спинного мозга, выбрасывают глицин. Глициновые рецепторы открывают каналы для ионов Cl-, что способствует возникновению так называемых тормозных постсинаптических потенциалов (тормозных потенциалов синаптической пластинки - ТПСП). Синаптическое действие заканчивается с помощью механизма обратного захвата глицина.
В центральной нервной системе глицин играет также и роль нейромодулятора, например, в гиппокампе NMDA-рецепторы, описанные в предыдущем разделе, испытывают модулирующее влияние со стороны глицина.
γ-Аминомасляную кислотувыбрасывают в качестве трансмиттера многие тормозные интернейроны, имеющиеся практически во всех отделах центральной нервной системы, и аксоны клеток Пуркинье мозжечка. ГАМК оказывает тормозное действие на постсинаптические структуры. Существует по меньшей мере два
различных постсинаптических механизма, которые запускаются благодаря различным рецепторам (ГАМКА и ГАМКС с одной стороны; ГАМКВ с другой стороны).
Серотонин(5-hydroxytryptamin) - биогенный амин, широко распространенный в ЦНС. В мозге его особенно много в области тектума. Оттуда наблюдается много проекций в лимбическую систему, к таламусу и гипоталамусу, в передний мозг, в мозжечок и в спинной мозг. По этим путям, очевидно, осуществляется контроль многих нейрональных функций.
На постсинаптической мембране были обнаружены различные серотониновые рецепторы, которые большей частью, благодаря вторичным мессенджерам, открывают каналы для ионов К+ и Са2+. Действие трансмиттера заканчивается включением механизма обратного захвата пресинаптической областью.
Гистамин- моноамин, выступающий в качестве трансмиттера. Особенно важную роль он играет как модулятор в мозге грудных детей. Гистаминергические нейроны у взрослых находятся в заднем гипоталамусе и связаны со многими участками мозга, где они оказывают влияние на состояние бодрствования, мышечную активность, прием пищи, сексуальные отношения и обменные процессы в мозге. Из-за участия этих нейронов в регуляции процессов сна и бодрствования многие антигистаминные препараты вызывают состояние сонливости.
Дофамин- биогенный амин, наиболее представленный в базальных ганглиях, где нейроны черной субстанции образуют дофаминергический путь к стриатуму, выполняя функцию контроля моторики.
Дофаминергические пути, которые исходят от area ventalis tegmentalis и проецируются к nucleus accumbeus, играют большую роль в патогенезе эпилепсии.
Существуют различные дофаминовые рецепторы, действующие через вторичные мессенджеры. Их постсинаптическое действие может быть тормозным или возбуждающим. Дофамин очень быстро захватывается обратно из синаптической щели в пресинаптическое окончание. Там он претерпевает превращения благодаря моноаминоксидазе. Вне нейрона, он подвергается воздействию катехол-О-метилтрансферазы.
Норадреналинкатехоламин, выполняющий функцию трансмиттера в ЦНС и синтезирующийся прежде всего нейронами locus coeruleus.Это ядро состоит не более чем из 1000 клеток, аксоны которых так многократно разветвляются, что можно найти адренергические окончания во
многих областях ЦНС. Они оказывают модулирующее влияние, например, на процессы созревания, обучения, переработку информации в мозгу, регуляцию сна и на эндогенное торможение боли. В периферической нервной системе норадреналин служит важным трансмиттером симпатических постганглионарных окончаний, например, на сердце и на гладких мышцах сосудов. В некоторых центральных синапсах как трансмиттер рассматривают адреналин.
Для катохоламинов существует четыре главных типа рецепторов: α1, α2, β1 и β2. Они отличаются по реакции на различные агонисты или антагонисты, а также по постсинаптическим эффектам. Рецепторы α1 управляют Са2+-каналами при помощи вторичного мессенджера IP3 и при активации повышают внутриклеточную концентрацию ионов Са2+. Активация рецепторов ведет к уменьшению концентрации вторичного мессенджера цАМФ, вызывая различные эффекты. Активация рецепторов β, например, на клетках Пуркинье мозжечка, повышает при помощи вторичного мессенджера цАМФ проводимость
мембраны для ионов К+ и, таким образом, образует ТПСП. Обратный захват и разрушение похожи на таковые для дофамина
Олигопептиды,которые действуют как трансмиттеры или нейромодуляторы - это приемущественно короткие полипептиды, состоящие из 2-30 аминокислотных остатков. Они функционируют как трансмиттеры или ко-трансмиттеры либо модулируют синаптические процессы. Так энкефалин, эндорфини динорфинслужат трансмиттерами в тех синапсах, в которых опиоидные вещества также оказывают действие. Опиоиды (например, морфин) являются сильными анальгетиками. Вышеназванные опиоидные пептиды тормозят распространение боли в спинном мозге. Кроме того, они играют большую роль в лимбической, автономной и моторной системах.
Другие нейропептиды: вещество Р, ангиотензин II, соматостатин, вазоактивный интестинальный полипептид (VIP), нейропептид Yи многие другие. Большинство названных веществ были открыты в качестве гормонов прежде, чем была определена их роль в синаптическом переносе.
Таблица 3-2. Примеры механизмов действия трансмиттеров на различные типы рецепторов

Типы ацетилхолиновных синапсов
Среди синапсов с химическим механизмом передачи электрического сигнала особое место занимает так называемый холинергический синапс, у которого медиатором служит АЦХ. Особенность этих синапсов заключается в том, что в организме присутствуют две их группы, подразделяющиеся по тому типу АЦХ-рецептора, который присутствует на постсинаптической мембране. Это АЦХ-рецепторы, чувствительные дополнительно к никотину (нАЦХ-рецептор и, соответственно, нАЦХ синапс), и АЦХ-рецепторы, чувствительные дополнительно к мускарину (мАЦХ-рецептор и, соответственно, мАЦХ синапс). АЦХ синапсы с никотиновым АЦХ-рецептором являются ионотропными, а АЦХ синапсы с мускариновым АЦХ-рецептором - метаботропными.
На примере ионотропного АЦХ синапса и метаботропного АЦХ синапса рассмотрим механизм проведения электрического сигнала.
В противоположность синапсу с ионотропнам рецептором (рис. 3-11 А), в котором трансмиттер непосредственно открывает ионный канал, у метаботропных рецепторов есть другие рецепторные белки, которые не являются ионными каналами
(рис. 3-11 Б).
В ионотропном никотиновом АЦХсинапсе две молекулы свободного АЦХ связываются с рецепторным белком, представляющим собой одну из структур ионного канала, что вызывает сдвиг заряда внутри макромолекулы рецептора и как следствие аллостерическое изменение его формы и формы самого канала. Центральный канал расширяется, его внутренний диаметр становится приблизительно равным 0,65 нм. Благодаря этому центральный канал становится проницаемым для ионов натрия. Однако для анионов канал не проходим из-за имеющихся на внутренних стенках зарядов. Коротко: активация нАЦХ-канала
вызывает проводимость постсинаптической мембраны для катионов, деполяризацию постсинаптической мембраны, формирование потенциала и, в итоге, сокращение мышцы.
В метаботропном мускариновом АЦХ синапсеАЦХрецептором служит белок, который не является ионным каналом. Он интересен в эволюционном аспекте, поскольку обладает большим химическим сходством со светочувствительным пигментом родопсином, α- и β- адренергическими и другими рецепторами. Ионные каналы, необходимые для возникновения потенциала на постсинаптической мембране, открываются там только благодаря процессам, определяемым вторичными посредниками. Как только трансмиттер связывается с рецептором, G-белок, имеющий три субъединицы, образует с рецептором комплекс. ГДФ, связанный с G-белком, заменяется на ГТФ. При этом образуется активированный G-белок, состоящий из ГТФ и α-субъединицы, который открывает калиевый ионный канал. Этот пример демонстрирует, что агонист гиперполяризовал бы постсинаптическую клетку, и, значит, затормозил бы ее активность.
У вторичных мессенджеров есть много возможностей для осуществления влияния на ионные каналы. С помощью различных вторичных мессенджеров определенные ионные каналы могут открываться или закрываться. Наряду с описанным механизмом открытия канала с помощью активированной α-субъединицы G-белка у многих синапсов при помощи ГТФ может также активироваться β- и γ-субъединицы, например, в сердце. В других метаботропных синапсах могут играть роль другие вторичные мессенджеры. Так, ионные каналы могут открываться с помощью цАМФ/IР3 или с помощью фосфорилирования протеинкиназы С. Этот процесс также запускается G-белком, который активирует фосфолипазу С, что ведет к образованию IP3. Дополнительно увеличивается образование DAG и протеинкиназы.
Рис. 3-11. Механизмы работы ионотропного синапса (А) и метаботропного синапса (Б)
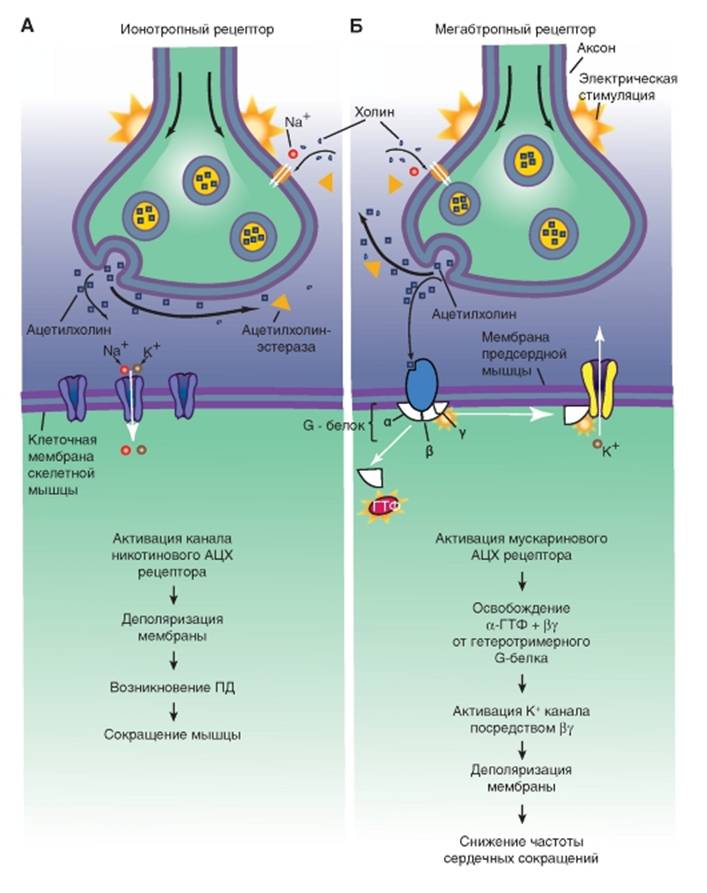
Ионотропный никотиновый холинергический синапс
На примере ионотропного никотинового холинергического синапса рассмотрим ацетилхолиновую передачу с участием ионотропного нАЦХ-рецептора. Итак, в этом синапсе в качестве трансмиттера из везикул выбрасывается АЦХ, и такой синапс называется холинергическим никотиновым синапсом. Примером холинергического синапса является нервно-мышечный синапс.
В постсинаптической мембране выделяют так называемую субсинаптическую мембранную зону непосредственного контакта пресинаптической мембраны с мембраной постсинаптической клетки, которую иначе называют активной зоной синапсов, где находятся протеины, связывающиеся с молекулами трансмиттера и поэтому называющиеся рецепторами. Обратите внимание, что существует два понятия, заложенные в термин «рецептор». В одном случае под термином «рецептор» подразумеваются нервные окончания чувствительного нейрона, или специализированные нервные клетки, но в другом случае это белковые структуры, встроенные в мембрану, которые имеют места связи для сигнальных молекул, например гормоны, трансмиттеры и т.д.
Рецепторный белок для нАЦХ-рецептора состоит из 5 субъединиц, вместе образующих пору - ионный канал, пронизывающий клеточную мембрану. Каждый из таких каналов может находиться в двух состояниях - открытом или закрытом. В открытом состоянии каналы имеют строго определенную проницаемость для ионов. Большей частью этот канал закрыт. Но если две молекулы АЦХ связываются с рецептором, то возникает сдвиг заряда внутри макромолекулы и как следствие аллостерическое изменение его формы. Центральный канал расширяется, и его внутренний диаметр становится приблизительно равным 0,65 нм. Благодаря этому центральный канал становится проходимым для катионов натрия и калия. Однако для анионов канал непроходим изза имеющихся на внутренних стенках зарядов.
В нормальном состоянии рецепторы для трансмиттеров находятся только в области субсинаптической мембраны. Это относится также и к нервно-мышечному синапсу. Однако, хотя АЦХ-рецепторы находятся преимущественно в субсинаптической мембране, крайне небольшое их количество встречается и на поверхности мышечной клетки. Но если двигательный нерв, например, из-за ранения разорван или сильно поврежден, то АЦХ-рецепторы образуются на всей поверхности мышечной клетки; мышца становится гиперчувствительна к АЦХ.
Рис. 3-12. Структура n-холинорецептора

Глутаматный синапс
Многие соединения используются в синапсах как трансмиттеры. Например, глутамат в мозге служит важнейшим трансмиттером для возбуждающих синапсов. Синапсы, которые используют в качестве трансмиттера глутамат, находятся приблизительно на 50% нейронов ЦНС. Они наиболее распространены в переднем мозге (telencephalon) и гиппокампе. Глутаматные синапсы образуют важнейшие возбуждающие входы систем мозга к коре большого мозга. Таким образом, глутамат представляет собой важнейший трансмиттер ЦНС. Именно поэтому, например, в качестве средства для наркоза применяют фармакологический препарат кетамин, представляющий собой антагонист глутамата.
Освобождение глутамата происходит в зависимости от концентрации ионов Ca2+ в пресинаптической области. Однако завершение синаптического переноса осуществляется не посредством его ферментативного разрушения в синаптической щели, а по механизму обратного захвата трансмиттера пресинаптическим нервным окончанием. Кроме того, в этом процессе участвует астроглия.
Глутамат прямо открывает неспецифический ионный канал для катионов. Существует, по крайней мере, три основных типа постсинаптических рецепторов, у каждого из которых много подтипов. Они различаются по своей способности связываться с экзогенными агонистами. К этим рецепторам относятся ионотропные рецепторы - лиганд-управляемые катионные каналы - NMDA (N-метил-D-аспартат), AMPA (α-ами- но-3-гидрокси-5-метил-4-изоксазол-пропионовая кислота) и метаботропный mGluR1-5, действие которого осуществляется через IP3/DAG.
На рисунке 3-13 показано, что освобожденный из пресинаптической области глутамат параллельно активирует два рецептора постсинаптической мембраны - ионотропный лиганд-управляемый рецептор, служащий катионным каналом AMPA, и метаботропный рецептор mGluR1-5. Рецептор mGluR1-5 активирует фосфолипазу С, которая расщепляет фосфатидилинозитол-4,5-дифосфат на DAG
и IP3. IP3 вызывает высвосвобождение Са2+ из эндоплазматического ретикулума. Кроме того, Са2+ поступает через потенциал-управляемые каналы мембраны клетки, что приводит не только к увеличению его уровня, но и активации высвобождения из эндоплазматического ретикулума. Повышение уровня Са2+ и появление DAG совместно активируют протеинкиназу С, которая меняет свойства AMPA, приводя к возникновению эффекта долговременной депрессии (Long-Term depression - LTD).
Процесс каждого синаптического переноса должен быстро заканчиваться, в противном случае ответ не возникал бы под влиянием вновь поступающих сигналов и наблюдался бы блок деполяризации.Организм обладает многими способами прекращения синаптического тока. В качестве первого можно назвать десенситизацию, т.е. уменьшение чувствительности рецептора к большим концентрациям трансмиттера, например в результате длительной синаптической активности. В этом случае, несмотря на непрерывное связывание трансмиттера с рецептором, конформация каналообразующего белка меняется так, что канал становится непроницаемым для ионов. При этом синаптический ток прекращается, и процесс переноса заканчивается. Десенситизация наиболее часто осуществляет быстрые механизмы уменьшения чувствительности рецептора. У большинства синапсов десенситизация рецептора может, однако, длиться минуты, до тех пор, пока канал реконфигурируется и станет вновь возбудимым.
Чтобы избежать длительной десенситизации есть другие возможности прекращения действия трансмиттера. Трансмиттер может быть либо быстро химически расщеплен на неактивные компоненты, либо удален из синаптической щели путем высокоселективного обратного захвата в пресинаптическое окончание. В ЦНС клетки глии могут также захватывать трансмиттер. Кроме того, на возбуждающих глутаматергических синапсах синаптическая область плотно покрыта отростками астроцитов. Какой из инактивирующих механизмов играет в синапсе большую роль, зависит от типа синапса.
Рис. 3-13. Один из механизмов работы глутаматного синапса

Фосфорилирование и дефосфорилирование в глутаматном синапсе
Глутаматный синапс содержит на постсинаптической мембране два типа ионотропных рецепторов. К ним относятся лиганд-управляемые катионные каналы - NMDA и AMPA. Первый тип рецептора назван NMDA-рецептором,поскольку с ним связывается NMDA. К другому типу относится АМРА-рецептор,связывающийся с AMPA.
На рисунке 3-14 А показано, что освобожденный из пресинаптической области глутамат параллельно активирует два ионотропных рецептора - лиганд-управляемых канала постсинаптической мембраны, являющихся катионными каналами AMPA и NMDA. Через катионный канал AMPA в постсинаптическую область входят ионы Na+, которые деполяризуют постсинаптическую мембрану. В отличие от AMPA, NMDA- канал открывается, если постсинаптическая мембрана достаточно деполяризована. Через этот канал в постсинаптическую область поступают и ионы Na+ и Са2+. Вход Са2+ в клетку приводит к активации протеинкиназы С. Параллельно Са2+ связывается в комплекс с кальмодулином и активирует Са2+/кальмодулин киназу II. Оба этих процесса направлены на фосфорилирование синаптических белков. В итоге запускается процесс введения дополнительных AMPA- рецепторов в постсинаптическую мембрану, как это показано на рисунке, который способствует длительному потенцированию - долговременному синаптическому потенцированию (Long-Term potentiation - LTP).
Но чрезмерное возбуждение многих NMDA синапсов может также необратимо повредить постсинаптические клетки (так называемаяэксайтотоксичность- цитотоксичность, свойственная возбуждающим нейротрансмиттерам, например,
глутамату и аспартату), что, по-видимому, осуществляется при действии значительного входящего тока ионов Ca2+. Очевидно, десенситизация наступает на рецепторах этого типа очень медленно. Эксайтотоксичность усиливает многие неврологические заболевания, такие, как нарушение слуха, течение болезни Альцгеймера или наследственные повреждения, вызванные первичной гипоксией.
На рисунке 3-14 Б, как и на предыдущем, показано, что глутаматный синапс содержит на постсинаптической мембране два типа ионотропных рецепторов. К ним относятся лигандуправляемые катионные каналы - NMDA и AMPA. Но на этом рисунке продемонстрирован противоположный эффект - не вставка дополнительных AMPA-рецепторов в постсинаптическую мембрану, а наоборот, интернализация AMPA-рецепторов из постсинаптической мембраны. Низкоамплитудный подъем концентрации Са2+ в клетке активирует протеинфосфатазу, находящуюся в постсинаптической зоне. Это ведет к дефосфорилированию синаптических белков и тем самым к интернализации AMPA-рецепто- ров из постсинаптической мембраны, уменьшая возможность связывания с AMPA-рецепторами освободившегося глутамата. Благодаря этому механизму возможно уменьшение синаптической активностидолговременная синаптическая депрессия (Long-Term depression - LTD).
На многих описанных синапсах вместо глутамата находится аспартат. Часто на NMDA-рецепто- рах глицин является котрансмиттером. Кетамин, применяемый для наркоза, представляет собой неконкурентный блокатор NMDA-рецепторов. Из синаптической щели глутамат удаляется либо посредством обратного захвата в пресинаптическую область, либо в клетки глии. Наряду с ионотропными рецепторами к глутамату существует еще ряд метаботропных глутаматных рецепторов.
Рис. 3-14. Глутамат и механизм работы синапса с этим трансмиттером через ионотропные рецепторы (лигандуправляемые катионные каналы) NMDA и AMPA, направленный на фосфорилирование (А) или дефосфорилирование (Б) синаптических белков и вставку дополнительных AMPA-рецепторов в постсинаптическую мембрану

Механизм долговременной потенциации и долговременной синаптической депрессии
На рисунке 3-15 показаны пути, приводящие к повышению уровня цАМФ и активации цАМФзависимой ПКА. Активация ферментативной активности цАМФ-зависимой протеинкиназы должна вовлекать отделение регуляторных субъединиц от комплекса. Эта активация происходит в присутствии микромолярных концентраций цАМФ. Каждая регуляторная субъединица связывает две его молекулы. Связывание цАМФ индуцирует конформационные изменения в регуляторных субъединицах и снижает афинность их связывания с каталитическими субъединицами. В результате этого регуляторные субъединицы отделяются от каталитических субъединиц, и каталитические субъединицы становятся активированными. Каталитические единицы ПКА попадают в ядро клетки и запускают процесс транскрипции.
На рисунке показано, что освобожденный из пресинаптической области глутамат активирует ионотропный рецептор - лиганд-управляемый канал постсинаптической мембраны, являющийся катионным каналом NMDA. Вход Са2+ в клетку приводит к связыванию Са2+ с кальмодулином, и этот комплекс активирует протеинкиназы. Аденилатциклаза переводит АТФ в цАМФ, что приводит к активации ПКА. Активация ПКА вследствие связывания четырех молекул цАМФ вызывает конформационные изменения в регуляторных субъединицах и снижает аффинность их связывания с каталитическими субъединицами, а также приводит к отделению регуляторных субъединиц от каталитических. Далее каталитические единицы проникают в ядро.
Долговременная потенциация (Long-Term potentiation - LTP) осуществляется через протеинкиназу А, активирующую регулятор транскрипции CREB - cAMP response element binding protein.
Рис. 3-15. Механизмы, определяющие кратковременные и долговременные изменения в синаптической передаче

Рецепторы NMDA и AMPA определяют работу глутаматного синапса
Некоторые из глутаматных синапсов, снабженные ионотропными рецепторами - лигандуправляемыми катионными каналами - NMDA и AMPA - обладают, по сравнению с обычными синапсами, дополнительным любопытным механизмом. Ионы Mg2+, которые находятся во внеклеточной жидкости, оказывают на них влияние в качестве неконкурентного блокатора,
выключая сопряженный с этим рецептором ионный канал. Таким образом, освобождение трансмиттера и связывание его с NMDA-каналом не приводит к эффекту. Если потенциал мембраны постсинаптической клетки благодаря возбуждающим синапсам, имеющим AMPA-канал, совсем немного деполяризуется, то связывание Mg2+ уменьшается. После этого Mg2+ освобождает ионный канал, и ионы натрия могут проникать в клетку, вызывая, таким образом, сильную деполяризацию.
Рис. 3-16. Потенциалы, возникающие на постсинаптической мембране глутаматного синапса, которые определяются работой ионотропных рецепторов - лигандуправляемых катионных каналов - NMDA и AMPA.
А - потенциалы, генерируемые АМРА в условиях блокады ионами Mg2+ NMDA и суммарный потенциал. Ионы Mg2+ неконкурентно блокируют ионный канал NMDA. Так что даже после связывания глутамата ионный ток не может течь. Б - если перед этим возбуждающий глутаматный синапс на клетке слегка кратковременно преддеполяризовать (сместить потенциал мембраны в более положительную область), то ионы Mg2+ не смогут больше быть связанными с NMDA-каналами. Блок Mg2+ снимается, и ионы Na+ и Са2+могут устремиться в клетку. Ионы Са2+ могут использоваться в качестве внутриклеточного вторичного мессенджера и регулировать дальнейшие процессы

ГАМК как трансмиттер
Многие тормозные интернейроны, присутствующие практически во всех отделах ЦНС, и аксоны клеток Пуркинье мозжечка выбрасывают в качестве трансмиттера γ-аминомасляную кислоту (ГАМК, GABA: γ-Aminobutyric acid). ГАМК оказывает тормозное действие на постсинаптические структуры. Существует по меньшей мере два различных постсинаптических механизма, запускающихся благодаря различным рецепторам (ГАМКА, ГАМКС с одной стороны; ГАМКВ с другой стороны).
ГАМКА-и ГАМКС-рецепторы непосредственно открывают каналы для ионов Cl-, что приводит к появлению входящего Cl-тока и тем самым к гиперполяризации в виде ТПСП. Барбитураты (препараты, применяемые для наркоза), стероидные анестетики и транквилизаторы (успокаивающие средства) из класса бензодиазепинов (например, диазепам) усиливают ингибиторное действие ГАМКА-рецепторов. Механизм их действия заключается в связывании с белком ионного канала, который уже взаимодействует с ГАМК, и таким образом в усилении действия ГАМК.
Канал построен из нескольких субъединиц. Одна из этих субъединиц связывает ГАМК, другая может дополнительно связать бензодиазепин, третья - связать барбитурат и еще одна - связать стероид. В настоящее время неясно, какие природные вещества (например, нейромодуляторы) оказывают действие на так называемые бензодиазепиновые или барбитуратные рецепторы. Названные субъединицы могут обладать различными химическими свойствами, определяемыми их химической структурой, что обусловливает различные фармакологические эффекты. БикукуллинÄ представляет собой конкурентный блокатор для ГАМКА-, но не для ГАМКС-рецептора. Яд пикротоксин, вызывающий судороги, является неконкурентным блокатором, закрывающим канал для ионов Cl-.
ГАМКВ открывают каналы для ионов К+ посредством G-белка. Агонистом служит баклофен. Пресинаптические ГАМКВ-рецепторы закрывают каналы Са2+ и тормозят освобождение трансмиттера. Действие ГАМК прекращается путем обратного захвата ГАМК пресинаптическим окончанием и клетками глии.
Рис. 3-17.γ-Аминомасляная кислота как трансмиттер в синапсе: расщепление, удаление и обратный захват

Глицин как трансмиттер
Аминокислота глицин выполняет функцию трансмиттера в тормозных синапсах и действует как нейромодулятор. Глицин выполняет специфические ингибиторные задачи. Большинство клеток Реншоу, через которые осуществляется торможение α-мотонейронов спинного мозга, высвобождают глицин. Стрихнин является конкурентным антагонистом, и его применение приводит к судорогам из-за отсутствия торможения
α-мотонейронов. Рецепторы глицина открывают С1--каналы, что способствует возникновению ТПСП. Синаптическое действие заканчивается с помощью механизма обратного захвата глицина.
В ЦНС глицин играет также и роль нейромодулятора, например в гиппокампе NMDA-рецепторы, описанные ранее, испытывают модулирующее влияние со стороны глицина.
Важно заметить, что хотя синапсы называются по наименованию их главного трансмиттера (например, холинергический).
Рис. 3-18. Глицин: расщепление, удаление и обратный захват трансмиттера

NO как трансмиттер
Оксид азота (NO)- это паракринный медиатор, выделяемый эндотелиальными клетками и некоторыми нейронами. Вследствие того, что NO быстро окисляется, его биологическая жизнь длится всего несколько секунд. По этой причине NO влияет только на клетки, находящиеся вблизи от места своего выделения. NO стимулирует растворимую гуанилатциклазу в клетках-мишенях и тем самым повышает в клетке мишени внутриклеточную концентрацию цГМФ. Это, в свою очередь, стимулирует цГМФ-зависимую протеинкиназу.
Оксид азота легко распространяется путем диффузии и может принимать на себя функции трансмиттера. При этом, например, пресинаптические процессы могут регулироваться с помощью обратной связи. Возможно, этот вид переноса информации играет большую роль в ЦНС. Механизмы прекращения действия подобных трансмиттеров
не позволяют включить их в классическую синаптическую схему.
Образование NO катализируется NO-синтазойNOS - Са2+-кальмодулин-зависимым ферментом, ускоряющим превращение аргинина в цитруллин и NO. Повышение цитозольного уровня Ca2+ приводит к увеличению образования и выделения NO. NO освобождается нервными окончаниями гранулярных клеток мозжечка и действует на постсинаптические клетки Пуркинье мозжечка. NO выделяется эндотелиальными клетками под влиянием агонистов типа ацетилхолина, присоединение которого к мускариновым рецепторам повышает внутриклеточный уровень Са2+. Освобождение NO эндотелиальными клетками вызывает вазодилатацию в близлежащих клетках гладких мышц сосудов. Кроме того, NO служит одним из нейротрансмиттеров, освобождаемых нейронами и иннервирующих кишечник. Действуя на гладкомышечные клетки желудочно-кишечного тракта, NO подавляет их сократительную активность.
Рис. 3-19. Оксид азота (NO) в качестве трансмиттера, освобождаемого нейронами

Возбуждающий постсинаптический потенциал (ВПСП)
Рассмотрим этот вопрос на примере АЦХ. Взаимодействуя с рецептором, молекулы АЦХ открывают неспецифические ионные каналы в постсинаптической мембране клетки так, что повышается их способность к проводимости для одновалентных катионов. Существует сильная движущая сила для натрия, и ионы Na+ устремляются внутрь клетки и деполяризуют ее мембрану. С другой стороны, канал проходим и для ионов K+, для которых сохраняется незначительный электрохимический градиент, направленный из внутриклеточной области к внеклеточной среде. Через постсинаптическую мембрану одновременно проходят и ионы K+, тем самым слегка противодействуя деполяризации, обусловленной входящим током ионов Na+. Работа описанных каналов ведет к базовому входящему току положительных ионов и, следовательно, к деполяризации постсинаптической мембраны, которая называется применительно к синапсам ВПСП. На концевой пластинке нервно-мышечного синапса ВПСП называют также потенциалом концевой пластинки. Так как участвующие ионные токи зависят от разности их потенциала равновесия и потенциала мембраны, то при уменьшенном потенциале покоя мембраны ток ионов Na+ становится всегда меньше, а ток ионов К+ - больше. Именно поэтому амплитуда ВПСП уменьшается.
В механизме генерации ВПСП участвуют и другие ионные каналы с другими свойствами (лигандуправляемые, а не потенциал-управляемые), и проводимость трансмиттер-управляемых каналов (лиганд-управляемых) зависит только от количества молекул трансмиттера, связавшихся с молекулами рецептора. Амплитуда ВПСП лежит в диапазоне от 100 μВдо (в некоторых случаях) 10 мВ. В зависимости от вида синапса, общая продолжительность ВПСП лежит в диапазоне от 5 до 100 мс.
Прежде всего, в зоне синапса образовавшийся локально ВПСП распространяется пассивно электротонически по всей постсинаптической мембране клетки. Этот процесс не подчиняется закону «все или ничего». Если большое число возбуждающих
синапсов активируются одновременно или почти одновременно, то возникает явление так называемой суммации, которое реализуется в виде возникновения ВПСП существенно большей амплитуды, что может деполяризовать мембрану всей постсинаптической клетки. Если величина этой деполяризации достигает в области постсинаптической мембраны порогового значения (10 мВ или больше), то на аксонном холмике нервной клетки молниеносно открываются потенциал-управляемые Na+-каналы, и клетка генерирует потенциал действия, который проводится вдоль аксона. В случае моторной концевой пластинки это приводит к мышечному сокращению. От начала ВПСП до образования потенциала действия проходит еще около 0,3 мс, так что при обильном освобождении трансмиттера постсинаптический потенциал может появиться уже через 0,5-0,6 мс после пришедшего в пресинаптическую область потенциала действия. В общих чертах, время «синаптической задержки», подразумевающее необходимое время между возникновением пре- и постсинаптического потенциала действия, всегда зависит от типа синапса.
Тормозной постсинаптический потенциал (ТПСП)
Решающими для ионного тока в мембране оказываются величина ее потенциала и количество открытых ионных каналов. Определяющим оказывается тип белка канала, на который действует трансмиттер. Так на одних синапсах находятся каналы для K+, тогда как на других есть каналы для Cl-. Последние распространены много чаще. Рассмотрим в виде примера рецептор метаботропного синапса, повышающий при связывании с трансмиттером проводимость для ионов К+. При нормальной величине потенциала мембраны это приводит к дальнейшему выходящему току ионов К+ и гиперполяризации потенциала мембраны. Возникает так называемый ТПСП. Принципиально похожая ситуация складывается, если гиперполяризующий мембрану ток связан с ионами Cl-. Cl- течет в клетку и гиперполяризует ее. Подобная картина характерна для очень многих клеток.
Рис. 3-20. Потенциалы и токи, возникающие на постсинаптической мембране.
А - процессы освобождения трансмиттера и формирование возбуждающего постсинаптического потенциала (ВПСП) после электрического возбуждения (стрелка), поступившего на пресинаптическое окончание, связаны с возникновением возбуждающего постсинаптического тока (ВПСТ) и генерацией вследствие этого ВПСП. Если ВПСП переходит порог, то возникает потенциал действия (ПД), который во время фазы нарастания благодаря потенциалуправляемым Na+каналам деполяризует мембрану в направлении ENa, т.е. к потенциалу равновесия для Na+. Б - процессы освобождения трансмиттера и формирование ТПСП связаны с ингибиторным постсинаптическим током (ТПСТ) и соответствующим ему ТПСП. При этом ток вызывает движение через мембрану ионов К+. Ионы Cl-могут играть роль, если потенциал мембраны позитивнее, чем потенциал равновесия для Cl-, который лежит от -75 до -70 мВ. В - токи мембраны при активации возбуждающих (ВПСТ) и ингибиторных синапсов (ТПСТ) и возникающие в этом случае результирующие постсинаптические потенциалы (ВПСП, ТПСП). При одновременной активации возбуждающих и тормозных синапсов возникающие мембранные токи суммируются, поэтому результирующий постсинаптический потенциал (красный) становится очень маленьким

Синаптические ионные токи
в условиях фиксации потенциала
На панели (А) представлена схема регистрации токов концевой пластинки нервно-мышечного препарата в условиях фиксации потенциала. На панели (Б) представлены синаптические токи, зарегистрированные при смещении мембранного потенциала тестовыми ступеньками в диапазоне от -120 до +38 мВ при поддерживаемом потенциале. При отрицательных значениях мембранного
потенциала синаптические токи имеют входящее направление. Если мембранный потенциал не фиксировать, то входящий ток приведет к деполяризации мышечного волокна. При положительных значениях мембранного потенциала синаптические токи направлены из клетки наружу. На панели (В) представлена зависимость амплитуды синаптического тока от мембранного потенциала. Эта зависимость близка к линейной, и потенциал реверсии синаптических токов находится около нуля.
Рис. 3-21. Синаптические ионные токи и потенциал реверсии, измененный в условиях фиксации потенциала

Взаимное влияние ВПСП и ТПСП
Если на мембране клетки активируются одновременно возбуждающие и тормозные синапсы, то ионный ток уменьшается. В этом случае организм обладает возможностью эффективно подавлять возбуждающие или тормозящие влияния на нервной клетке.
Нервная клетка усыпана тысячами синаптических окончаний, часть из которых возбуждающие, а часть - тормозные. Если соседствующие возбуждающие и тормозные синапсы (одновременно) активируются, то возникающие токи накладываются друг на друга. Результирующий постсинаптический потенциал (по абсолютной величине) меньше, чем только один ВПСП или только один ТПСП. При одновременной активации возбуждающего и тормозного синапсов результирующий ВПСП может вызывать незначительную деполяризацию мембраны клетки. Тогда клетка возбуждается менее сильно, т.е. тормозится. При этом является существенным не ТПСП, а гиперполяризация мембраны вследствие повышения ее проводимости для ионов К+ или Cl-. Тем самым потенциал мембраны поддерживается вблизи потенциала равновесия для ионов калия (или хлора) на уровне достаточно больших отрицательных значений, и деполяризующий эффект входящего тока натрия уменьшается. Входящий ток натрия компенсируется выходящим током калия или входящим током хлора.
Таким образом, ВПСП возникает благодаря повышению проводимости для натрия и
тем самым благодаря входящему току натрия, а ТПСП - благодаря выходящему току калия или входящему току хлора.
Исходя из этого можно было бы предположить, что понижение проводимости для калия должно деполяризовать мембрану клетки, между тем как уменьшение проводимости для натрия должно было бы привести к гиперполяризации. Это действительно так. Природа также использует этот механизм, а именно - закрытие ионных каналов в результате связывания трансмиттера с рецептором. Синапсы, у которых деполяризация вызывается уменьшением проводимости калия, находятся в ганглиях автономной нервной системы. Там, главным образом, присутствуют синапсы, у которых АЦХ, активируя входящий ток натрия, вызывает ВПСП. Но есть также и те синапсы, у которых АЦХ уменьшает существующую проводимость калия и тем самым вызывает (длительные) ВПСП. Уменьшение существующей проводимости натрия, приводящее к гиперполяризации мембраны клетки, можно наблюдать в палочках и колбочках сетчатки.
Еще необходимо отметить, что механизм возникновения постсинаптических потенциалов соответствует механизму образования так называемых рецепторных потенциалов в клетках органов чувств (рецепторных клетках), где ионные каналы открываются или закрываются с помощью определенного химического или физического раздражения. Сходство не удивляет. Синапс - это высоко специализированная структура, которая реагирует высокоспецифично на определенные химические вещества.
Рис. 3-22. ВПСП и ТПСП на мембране клетки взаимно влияют друг на друга
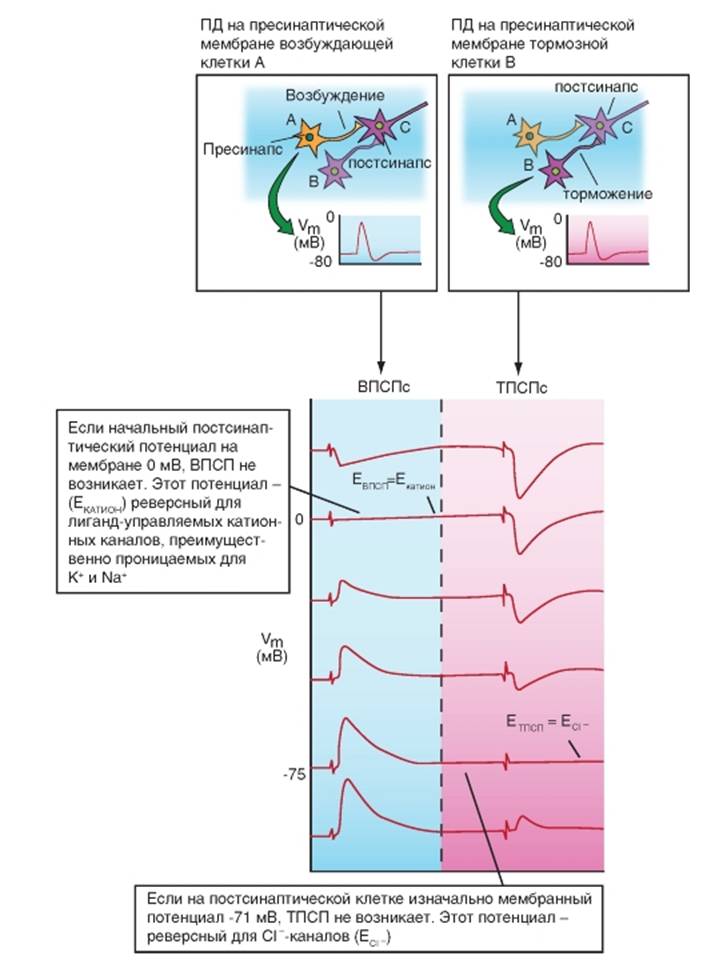
Лиганд-управляемые ионные каналы. Их токи
На примере двух различных типов лигандуправляемых ионных каналов (одиночного ионного канала, связанного с АЦХ-рецептором, и одиночного К+-канала, активируемого АЦХ) мы продемонстрируем условия, приводящие к их открытию, и токи, текущие через них.
Для описания первого типа лиганд-управляемых ионных каналов в качестве примера приведем никотиновый ацетилхолиновый рецептор, который сам служит ионным каналом. На рисунке 3-23 А1 показана регистрация тока в конфигурации outside-out,протекающего через одиночный ионный канал бычьего нАЦХ-рецептора, экспрессированного в ооцит ксенопуса. Этот лиганд-управляемый канал состоит из нескольких субъединиц. В первом случае (вверху) канал имеет конфигурацию α2βγδ, во втором случае (снизу) - конфигурацию α2βεδ. В обоих случаях
одиночный ток возникает при стимуляции канала АЦХ в концентрации 500 нМ. На рисунке 3-23 А2 показана реакция нАЦХ-рецептора эмбриональной и взрослой мышц на АЦХ. В обоих случаях реакции возникают только на аппликацию АЦХ.
В качестве второго типа лиганд-управляемого ионного канала рассмотрим К+-ионный канал, активируемый АЦХ. На рисунке 3-23 Б показана регистрация входящего К+-тока, активируемого АЦХ (К(ACh)-канал). Контрольная регистрация демонстрирует определенную активность канала. На фоне введенного в перфузионный раствор АЦХ в концентрации 100 нМ вероятность открытия канала не меняется, поскольку он находится под patch-пипеткой, и АЦХ не может проникнуть в эту область. Нижняя кривая демонстрирует регистрацию на фоне введенного в patch-пипетку АЦХ в концентрации 10 нМ. В этом случае наблюдается выраженная активация канала, поскольку соединение контактирует с его рецептором.
Рис. 3-23. Примеры токов АЦХ-управляемые ионные каналы.
А - ток через одиночный ионный канал бычьего n-холинорецептора, экспрессированного в ооцит ксенопуса (1) и мембрану эмбриональных и зрелых мышечных клеток (2).
Б - входящий К+-ток через К+-канал, активируемый АЦХ (регистрация в конфигурации cell-attached)
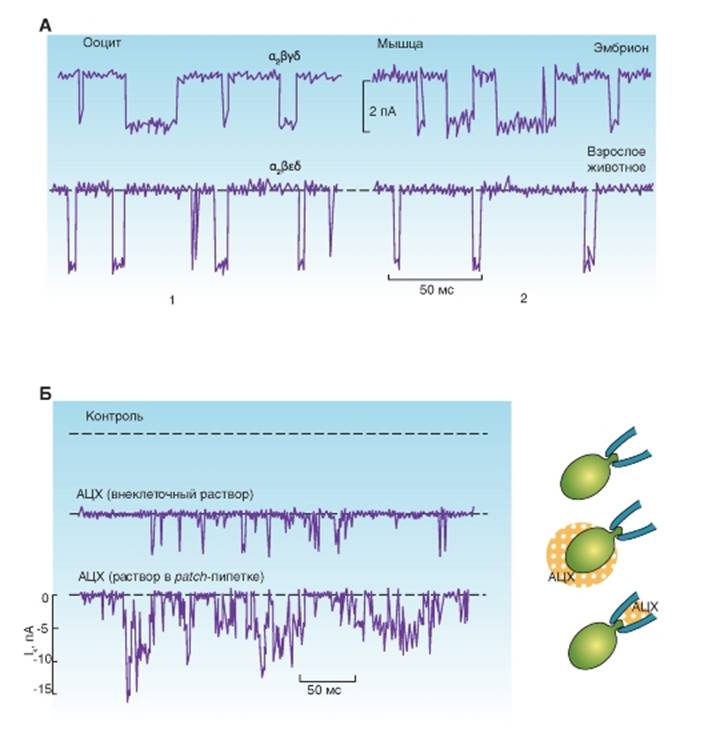
Patch-clamp для изучения канальных токов синапса
При применении метода patch-clamp в конфигурации outside-out, продемонстрированной на рис. 3-24 А, можно провести измерение тока, текущего через ионотропный одиночный ионный канал, расположенный во фрагменте мембраны под пипеткой, «вырезанной» из постсинаптической мембраны мышечной клетки. Когда АЦХ апплицирован на внешнюю поверхность мембраны, потенциал которой фиксирован на негативном уровне, можно увидеть повторяющиеся короткие открытия одиночного канала (рис. 3-24 Б), которые проявляются в виде резких падений тока в отрицательную область, соответствующих входящему ионному току (т.е. катионы входят в клетку). На рисунке 3-24 В представлено синхронное открытие многих ионотропных одиночных ионных каналов, активированных с помощью АЦХ, у синапса,
потенциал которого фиксирован на негативном уровне. Рисунок 3-24 В1 представляет собой запись эксперимента, в котором на фоне релиза АЦХ из пресинаптической терминали регистрировали одиночный канал. В этом случае канал открывается временно. На рисунке 3-24 В2 представлена запись эксперимента, в котором некоторое число каналов регистрировали одновременно. На фоне релиза АЦХ из пресинаптической терминали наблюдали открытие каналов почти синхронно. На рисунке 3-24 В3 представлена запись эксперимента, в котором регистрировали одновременно большое число каналов, находящихся на постсинаптической мембране. Эти каналы продуцировали так называемый макроскопический ток. На рисунке 3-24 Г показан типичный ВПСП, регистрируемый в режиме фиксации тока, а не фиксации потенциала. ВПСП - это деполяризация мембраны, которая может приводить к генерации потенциала действия.
Рис. 3-24. Активация ацетилхолинового рецептора - ионотропного одиночного ионного канала в нервномышечном синапсе

Соединения с синаптическим влиянием
Наряду с трансмиттером, другие соединения тоже могут влиять на рецепторный белок. Если их связывание с рецептором приводит к одинаковому с трансмиттером эффекту, то их называют агонистами,если же они путем связывания, напротив, препятствуют действию трансмиттера, их называют антагонистами.
Мы видели, что специфическая молекула трансмиттера связывается с белком, образующим канал, открывая его для ионов. Для этого на белке есть связывающий участок. Данный участок не является абсолютно специфическим. Для большинства синапсов установлен целый ряд эндогенных и экзогенных соединений, способных к взаимодействию со связывающим участком, многие из них представляют собой лекарства. Возьмем опять пример никотинового синапса. Его естественным трансмиттером служит АЦХ. Однако с рецептором, предназначенным для АЦХ, могут связываться сходные по структуре химические соединения, например - сукцинилхолин, который имитирует действие АЦХ, что приводит к возникновению ВПСП. Некоторые значительно отличающиеся по химическому строению молекулы, например никотин, также могут соединяться со связывающим участком рецепторного белка. Вещества, действующие подобно трансмиттеру, называют агонистами.Часто такие соединения используют для идентификации рецептора. Так, например, произошло с никотином, что породило название «никотиновый синапс».
Наряду с агонистами, существуют химические соединения, которые хотя и связываются с молекулой рецептора, но не могут открывать ионный канал. Занимая связывающий участок, они препятствуют рецепции естественного трансмиттера и возникновению его эффекта. В результате эти соединения блокируют ионный канал, препятствуя его открытию. Такие вещества называют антагонистами. Например, содержащийся
в яде кураре, которым индейцы смазывали наконечники стрел, d-тубокурарин,представляет собой конукрентный блокатордля никотиновых рецепторов. Он конкурирует с природным трансмиттером, связываясь с АЦХ-рецептором нервно-мышечного синапса, и препятствует произвольным сокращениям мышц, что приводит к смерти через остановку дыхания. Курареподобные вещества применяют в настоящее время на фоне анестезии при хирургических операциях для мышечной релаксации. Другим соединением, которое высоко специфично и конкурентно связывается с никотиновыми АЦХ-рецепторами, является змеиный яд α-бунгаротоксин. Он действует уже в наномолярной концентрации и может применяться в экспериментах для того, чтобы маркировать АЦХ-рецепторы на поверхности клетки.
Препараты типа кураре действуют на мускариновые синапсы, для которых классическим конкурентным блокатором служит атропин. Выше уже были представлены данные о возможности фармакологического влияния на холинергические синапсы. Таблица дает нам информацию о наличии некоторых типов синапсов. Обратите внимание на то, что наблюдаются существенные различия между никотиновыми и мускариновыми рецепторами, и что даже внутри одного типа рецептора есть подтипы, которые нередко существенно отличаются по своим свойствам. Кроме того, большая часть фармакологических препаратов не действует на синапсы ЦНС только потому, что они не могут проникнуть через гематоэнцефалический барьер и достигнуть возможных мест действия.
Блок деполяризации при действии сукцинилхолина и подобных веществ осуществляется благодаря незначительной стойкой деполяризации, возникающей под действием этих соединений. Она ведет к инактивации потенциал-управляемых Na+-каналов вблизи концевых пластинок, что препятствует возникновению потенциалов действия мышечного волокна. Наступает и десенситизация АЦХ-рецепторов.
Рис. 3-25. Свойства основных нейротрансмиттеров (см. таблицу)
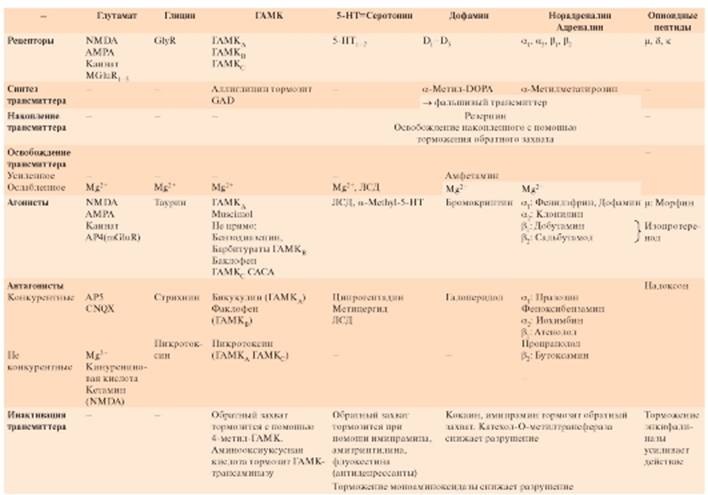

Глава 4. Физиология мышц
Общие представления о строении различных мышц
Многие клетки обладают ограниченной способностью преобразовывать химическую энергию в механическую силу и движение, но только в мышечных волокнах этот процесс занял главное место. Основная функция этих специализированных клеток состоит в генерировании силы и движений, которые организм использует, чтобы регулировать внутреннюю среду и перемещаться во внешнем пространстве.
На основании структуры, сократительных свойств и механизмов регуляции различают три вида мышечной ткани:
1) скелетные мышцы;
2) гладкая мускулатура;
3) сердечная мышца (миокард).
Скелетные мышцы, как следует из их названия, прикреплены, как правило, к костям скелета; благодаря сокращениям этих мышц поддерживается положение скелета в пространстве и происходят его движения. Сокращения возникают под влиянием импульсов от нервных клеток и обычно бывают произвольными.
На рисунке 4-1 А представлены волокна скелетной мышцы (верхняя панель), клетка сердечной мышцы (средняя панель) и клетка гладкой мышцы (нижняя панель). Клетка скелетной мышцы называется мышечным волокном.В процессе эмбрионального развития каждое мышечное волокно формируется путем слияния многих недифференцированных одноядерных клеток (миобластов)в одну цилиндрическую многоядерную клетку. Дифференцировка скелетных мышц завершается примерно к моменту рождения. В период от младенческого до взрослого состояния организма размеры дифференцированных мышечных волокон продолжают увеличиваться, но новые волокна из миобластов не образуются. У взрослого человека диаметр мышечных волокон достигает 10-100 мкм, длина - до 20 см.
Если в постнатальный период происходит повреждение скелетных мышечных волокон, они не могут замещаться путем деления сохранившихся волокон, однако новые волокна образуются из недифференцированных клеток, так называемых клеток-сателлитов,расположенных рядом с мышечными волокнами и подвергающихся дифференцировке аналогично эмбриональным миобластам. Возможности формирования новых волокон в скелетной мышце значительны, однако после сильного повреждения она целиком уже не восстанавливается. Важную роль в компенсации
утраченной мышечной ткани играет увеличение неповрежденных мышечных волокон.
На рисунке рис. 4-1 А, Г представлена также сердечная мышца (миокард), которая обеспечивает работу сердца.
Слои гладких мышц находятся в стенках полых внутренних органов и трубчатых образований: желудка, кишечника, мочевого пузыря, матки, кровеносных сосудов, бронхов. В результате сокращений гладких мышц проталкивается содержимое полых органов, регулируется ток жидкости в сосудах и протоках путем изменений их диаметра. Маленькие пучки гладкомышечных клеток находятся также в коже около волосяных сумок и в радужной оболочке глаза. Сокращениями гладких мышц управляет вегетативная нервная система, гормоны, аутокринные / паракринные факторы, другие местные химические сигналы. Некоторые гладкие мышцы спонтанно сокращаются даже при отсутствии сигналов. В отличие от скелетных мышц, гладкая мускулатура не имеет произвольной регуляции.
Несмотря на существенные различия между этими тремя видами мышц, у них сходный механизм генерирования силы. Сначала будут рассмотрены скелетные мышцы, затем гладкая мускулатура. Сердечная мышца характеризуется сочетанием ряда свойств двух первых видов мышц.
Наиболее примечательная характеристика волокон скелетной, а также сердечной мышц при изучении с помощью светового микроскопа - чередование светлых и темных полос, поперечных по отношению к длинной оси волокна. Благодаря этой особенности оба типа мышц относят к поперечнополосатым мышцам (рис. 4-1 А, верхняя и средняя панели). В гладкой мышце такая картина отсутствует (рис. 4-1 А, нижняя панель).
В скелетной мышцетолстые и тонкие филаменты образуют периодический рисунок вдоль каждой миофибриллы. Регулярно повторяющийся элемент этого рисунка известен как саркомер(от греч. sarco - мышца, mere - маленький) (увеличенный фрагмент на рис. 4-1 Б). Каждый саркомер включает в себя триаду:
1) цистерну саркоплазматического ретикулума;
2) поперечную тубулу;
3) еще одну цистерну саркоплазматического ретикулума (рис. 4-1 Б).
На рисунке 4-1 В представлено строение гладкой мышцы, которое отличается от скелетной.
Совмещенный рисунок 4-1 Г демонстрирует синхронную запись потенциалов действия, а также механограмму скелетной мышцы и мышцы сердца.
Рис. 4-1. Организация волокон и филаментов в скелетной и гладкой мышцах
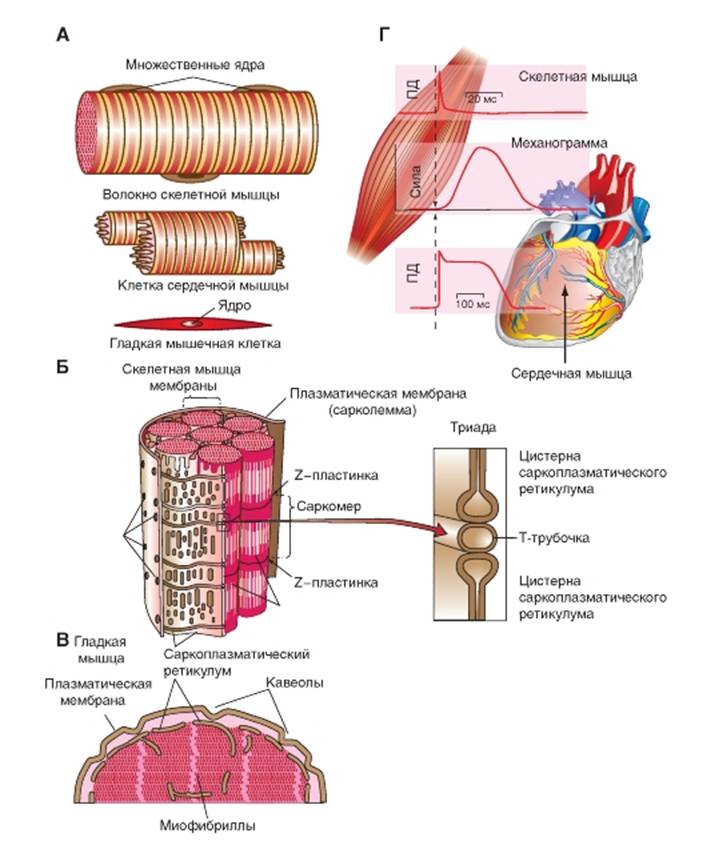
Типы мышц
Существуют три типа мышц: скелетные, гладкие и миокард. Скелетные мышцы прикреплены к костям, осуществляя их поддержку и движение. Гладкая мускулатура окружает полые и трубчатые органы. Сердечная мышца (миокард) обеспечивает работу сердца.
Скелетные мышцы
1. Скелетные мышцы состоят из цилиндрических мышечных волокон (клеток); каждый конец мышцы соединен посредством сухожилий с костями.
2. Волокна скелетных мышц характеризуются периодическим чередованием светлых и темных полос, отражающих пространственную организацию толстых и тонких филаментов в миофибриллах.
3. Тонкие филаменты, содержащие актин, прикреплены на обоих краях саркомера к Z-поло- сам; свободные концы тонких филаментов частично перекрываются с миозинсодержащими толстыми филаментами в А-полосе центральной части саркомера.
4. Во время активного укорочения скелетного мышечного волокна тонкие филаменты подтягиваются по направлению к центру саркомера в результате движений миозиновых поперечных мостиков, которые связываются с актином:
- две глобулярные головки каждого поперечного мостика содержат участок связывания с актином, а также фермент, расщепляющий АТФ;
- каждый рабочий цикл поперечного мостика состоит из четырех стадий. Во время сокращения поперечные мостики совершают повторные циклы, каждый из которых обеспечивает очень маленькое продвижение тонких филаментов;
- АТФ выполняет во время мышечного сокращения три функции.
5. В покоящейся мышце прикрепление поперечных мостиков к актину заблокировано молекулами тропомиозина, контактирующими с субъединицами актина тонких филаментов.
6. Сокращение инициируется в результате повышения цитоплазматической концентрации Са2+. При связывании ионов Са2+ с тропонином изменяется его конформация, благодаря чему тропомиозин смещается, открывая доступ к участкам связывания на молекулах актина; поперечные мостики связываются с тонкими филаментами:
- повышение цитоплазматической концентрации Са2+ запускается потенциалом действия
плазматической мембраны. Потенциал действия распространяется вглубь волокна вдоль поперечных трубочек к саркоплазматическому ретикулуму и вызывает высвобождение Са2+ из ретикулума;
- расслабление мышечного волокна после сокращения происходит в результате активного обратного транспорта Са2+ из цитоплазмы в саркоплазматический ретикулум.
7. Окончания двигательного аксона образуют нервно-мышечные соединения с мышечными волокнами двигательной единицы соответствующего мотонейрона. Каждое мышечное волокно иннервируется ветвью только одного мотонейрона:
- АЦХ, высвобождаемый из двигательных нервных окончаний при поступлении потенциала действия мотонейрона, связывается с рецепторами двигательной концевой пластинки мышечной мембраны; открываются ионные каналы, пропускающие Na+ и К+, благодаря чему концевая пластинка деполяризуется;
- одного потенциала действия мотонейрона достаточно, чтобы вызвать потенциал действия в волокне скелетной мышцы.
8. Существует определенная последовательность процессов, ведущих к сокращению скелетного мышечного волокна.
9. Понятие «сокращение» относится к включению рабочего цикла поперечных мостиков. Изменяется ли при этом длина мышцы, зависит от действия на нее внешних сил.
10. При активации мышечного волокна возможны три типа сокращения:
- изометрическое сокращение, когда мышца генерирует напряжение, но ее длина не меняется;
- изотоническое сокращение, когда мышца укорачивается, перемещая нагрузку;
- удлиняющее сокращение, когда внешняя нагрузка заставляет мышцу удлиняться во время сократительной активности.
11. Повышение частоты потенциалов действия мышечного волокна сопровождается увеличением механической реакции (напряжения или укорочения) до тех пор, пока не будет достигнут максимальный уровень тетанического напряжения.
12. Максимальное изометрическое тетаническое напряжение развивается в случае оптимальной длины саркомера Lо. При растяжении волокна более его оптимальной длины или уменьшении длины волокна менее Lо генерируемое им напряжение падает.
13. Скорость укорочения мышечного волокна снижается при повышении нагрузки. Максимальная скорость соответствует нулевой нагрузке.
14. АТФ образуется в мышечных волокнах следующими способами: перенос фосфата с креатинфосфата к АДФ; окислительное фосфорилирование АДФ в митохондриях; субстратное фосфорилирование АДФ в процессе гликолиза.
15. В начале физического упражнения главным источником энергии служит мышечный гликоген. При более длительном упражнении энергия образуется в основном за счет глюкозы и жирных кислот, поступающих с кровью; по мере дальнейшего продолжения физической деятельности возрастает роль жирных кислот. Когда интенсивность физической работы превысит ~70% от максимума, все более значительную часть образующейся АТФ начинает обеспечивать гликолиз.
16. Мышечное утомление обусловлено рядом факторов, включая изменения кислотности внутриклеточной среды, уменьшение запасов гликогена, нарушение электромеханического сопряжения, но не истощение АТФ.
17. Различают три типа скелетных мышечных волокон в зависимости от максимальной скорости укорочения и преобладающего способа образования АТФ: медленные оксидативные, быстрые оксидативные и быстрые гликолитические:
- разная максимальная скорость укорочения быстрых и медленных волокон обусловлена различиями АТФазы миозина: высокой и низкой АТФазной активности соответствуют быстрые и медленные волокна;
- быстрые гликолитические волокна имеют в среднем больший диаметр, чем оксидативные, и потому развивают более значительное напряжение, однако быстрее утомляются.
18. Все мышечные волокна одной двигательной единицы принадлежат к одному и тому же типу; большинство мышц содержат все три типа двигательных единиц.
19. Известны характеристики трех типов скелетных мышечных волокон.
20. Напряжение целой мышцы зависит от величины напряжения, развиваемого каждым волокном, и от количества активных волокон в мышце.
21. Мышцы, выполняющие тонкие движения, состоят из двигательных единиц с небольшим числом волокон, тогда как большие мышцы, обеспечивающие поддержание позы тела, состоят из гораздо более крупных двигательных единиц.
22. Быстрые гликолитические двигательные единицы содержат волокна большего диаметра и, кроме того, их двигательные единицы имеют более значительное число волокон.
23. Повышение мышечного напряжения происходит прежде всего путем увеличения количества активных двигательных единиц, т.е. их вовлечения. В начале сокращения первыми вовлекаются медленные оксидативные двигательные единицы, затем быстрые оксидативные и, наконец, уже при очень интенсивном сокращении, быстрые гликолитические единицы.
24. Вовлечение двигательных единиц сопровождается повышением скорости, с которой мышца перемещает нагрузку.
25. Силу и утомляемость мышцы можно изменить посредством тренировки:
- продолжительныеупражнения низкой интенсивности повышают способность мышечных волокон к образованию АТФ окислительным (аэробным) путем. Это происходит благодаря увеличению количества митохондрий и кровеносных сосудов в мышце. В итоге возрастает выносливость мышцы;
- кратковременные упражнения высокой интенсивности увеличивают диаметр волокон вследствие повышения синтеза актина и миозина. В итоге возрастает мышечная сила.
26. Движения суставов осуществляются посредством двух антагонистических групп мышц: сгибателей и разгибателей.
27. Мышцы вместе с костями представляют собой системы рычагов; чтобы конечность могла удержать груз, изометрическое напряжение мышцы должно существенно превысить массу этого груза, зато скорость перемещения плеча рычага гораздо больше, чем скорость укорочения мышцы.
Гладкие мышцы
1. Гладкие мышцы можно классифицировать на две большие группы: унитарные гладкие мышцы и мультиунитарные гладкие мышцы.
2. Гладкомышечные волокна - веретенообразные клетки без поперечной исчерченности, с одним ядром, способны к делению. Они содержат актиновые и миозиновые филаменты и сокращаются посредством механизма скользящих нитей.
3. Повышение концентрации Са2+ в цитоплазме ведет к связывания Са2+ с кальмодулином. Затем комплекс Са2+-кальмодулин связывается с киназой легких цепей миозина, активируя этот фермент, фосфорилирующий миозин. Только после фосфорилирования
гладкомышечный миозин может связываться с актином и осуществлять циклические движения поперечных мостиков.
4. Миозин гладких мышц гидролизует АТФ с относительно низкой скоростью, поэтому гладкие мышцы укорачиваются гораздо медленнее, чем поперечно-полосатые. Однако напряжение в расчете на единицу площади поперечного сечения для гладкой мышцы такое же, как для поперечно-полосатой.
5. Ионы Са2+, инициирующие сокращение гладкой мышцы, поступают из двух источников: саркоплазматического ретикулума и внеклеточной среды. В результате открывания кальциевых каналов плазматической мембраны и саркоплазматического ретикулума, которое опосредуется различными факторами, Са2+ поступает в цитоплазму.
6. Большинство стимулирующих факторов повышают цитоплазматическую концентрацию Са2+ не настолько, чтобы произошла активация всех поперечных мостиков клетки. Именно поэтому факторы, повышающие концентрацию Са2+ в цитоплазме, могут усиливать напряжение гладкой мышцы.
7. Существуют определенные типы стимулов, вызывающих сокращение гладкой мышцы благодаря открыванию кальциевых каналов плазматической мембраны и саркоплазматического ретикулума.
8. В плазматической мембране большинства гладкомышечных клеток (но не всех) при ее деполяризации могут генерироваться потенциалы действия. Восходящая фаза потенциала действия гладкой мышцы обусловлена входом Са2+ в клетку через открывшиеся кальциевые каналы.
9. В некоторыхгладких мышцах потенциалы действия генерируются спонтанно, при отсутствии внешних стимулов. Это происходит благодаря тому, что в плазматической мембране периодически возникают пейсмекерные потенциалы, деполяризующие мембрану до порогового уровня.
10. Гладкомышечные клетки лишены специализированных концевых пластинок. Некоторые гладкомышечные волокна подвергаются действию нейромедиаторов, высвобождаемых из варикозных утолщений одиночной ветви нерва, причем каждое волокно может находиться под влиянием нейромедиаторов более чем одного нейрона. Действие нейромедиаторов на сокращения гладких мышц может быть возбуждающим либо тормозным.
Мышца сердца
1. Потенциалы действия с быстрым ответом регистрируются от предсердных и желудочковых волокон миокарда и от специализированных волокон проводящей системы желудочков (волокна Пуркинье). Потенциал действия характеризуется большой амплитудой, крутым нарастанием и относительно длинным плато.
2. Потенциалы действия с медленным ответом регистрируются в клетках SA- и AV-узлов и в аномальных кардиомиоцитах, которые были частично деполяризованы. Потенциал действия характеризуется менее негативным потенциалом покоя, меньшей амплитудой, менее крутым нарастанием и более коротким плато, чем потенциал действия с быстрым ответом. Нарастание генерируется за счет активации Са2+-каналов.
3. Потенциалы действия характеризуются эффективным рефрактерным периодом (фаза абсолютной рефрактерности).
4. Автоматия характерна для некоторых клеток SA- и AV-узлов и для клеток проводящей системы желудочков. Признаком автоматии служит медленная деполяризация мембраны в течение фазы 4 (медленная диастолическая деполяризация).
5. В норме SA-узел инициирует импульс, вызывающий сокращение сердца. Этот импульс распространяется из SA-узла по ткани предсердий и в конечном счете достигает AV-узла. После задержки в AV-узле сердечный импульс распространяется по желудочкам.
6. Увеличение длины волокон миокарда, как бывает при увеличенном желудочковом наполнении (при преднагрузке) во время диастолы, вызывает более сильное сокращение желудочков. Соотношение между длиной волокон и силой сокращения известно как соотношение Франка-Старлинга или как закон сердца Франка-Старлинга.
7. Несмотря на то, что миокард состоит из отдельных клеток, отделенных друг от друга мембранами, кардиомиоциты, из которых состоят желудочки, сокращаются почти в унисон, как и кардиомиоциты предсердий. Миокард функционирует как синцитий с реакцией типа «все или ничего» при возбуждении. Проведение возбуждения от клетки к клетке осуществляется через высоко проницаемые контакты - gap junctions, которыми соединены цитозоли смежных клеток.
Рис. 4-2. Общие представления о строении различных мышц (см. табл.)
8. При возбуждении потенциалуправляемые кальциевые каналы открываются, и внеклеточный Са2+ поступает в клетку. Приток Са2+способствует высвобождению Са2+ из саркоплазматического ретикулума. Возросшая концентрация внутриклеточного Са2+ вызывает сокращение миофиламентов. Расслабление сопровождается восстановлением концентрации внутриклеточного Са2+ до уровня в состоянии покоя путем активного закачивания Са2+ назад в саркоплазматический ретикулум и обмена Са2+ на внеклеточный Na+ через сарколемму.
9. Скорость и сила сокращений зависят от внутриклеточной концентрации свободных ионов
кальция. Сила и скорость обратно пропорциональны друг другу, так что при отсутствии нагрузки скорость максимальна. Во время изоволюмического сокращения, когда нет внешнего укорочения, общая нагрузка максимальна, а скорость равна нулю.
10. При сокращении желудочков растягивание мышечных волокон кровью во время его наполнения служит преднагрузкой. Постнагрузкой является аортальное давление, преодолевая которое левый желудочек выталкивает кровь.
11. Сократительная способность отражает работу сердца при заданных величинах преднагрузки и постнагрузки.

* Число знаков «плюс» (+) указывает на относительные размеры саркоплазматического ретикулума в мышцах конкретного типа.
Физиология скелетных мышц
Понятие скелетная,или поперечно-полосатая мышцаотносится к группе мышечных волокон, связанных соединительной тканью (рис. 4-3 А). Обычно мышцы прикреплены к костям пучками коллагеновых волокон - сухожилиями,находящимися на обоих концах мышцы. В некоторых мышцах одиночные волокна имеют такую же протяженность, как и вся мышца, но в большинстве случаев волокна короче и часто располагаются под углом к продольной оси мышцы. Есть очень длинные сухожилия, они прикреплены к кости, удаленной от конца мышцы. Например, некоторые мышцы, осуществляющие движения пальцев рук, находятся в предплечье; шевеля пальцами, мы чувствуем, как двигаются мышцы кисти. Эти мышцы соединены с пальцами посредством длинных сухожилий.
При изучении с помощью светового микроскопа, основной характеристикой волокон скелетной мышцы оказалось чередование светлых и темных полос, поперечных по отношению к длинной оси волокна. Поэтому скелетные мышцы были названы поперечно-полосатыми.
Поперечная исчерченность волокон скелетной мышцы обусловлена особым распределением в их цитоплазме многочисленных толстых и тонких «нитей» (филаментов), объединяющихся в цилиндрические пучки диаметром 1-2 мкм - миофибриллы(рис. 4-3 Б). Мышечное волокно практически заполнено миофибриллами, они тянутся по всей его длине и на обоих его концах соединены с сухожилиями.
Толстые и тонкие филаменты образуют периодический рисунок вдоль каждой миофибриллы. Толстые филаментысостоят почти целиком из сократительного белка миозина. Тонкие филаменты(их толщина равна примерно половине диаметра толстого филамента) содержат сократительный белок актин,а также два других белка - тропонин
и тропомиозин, играющих важную роль в регуляции сокращения (см. ниже).
Толстые филаменты сосредоточены в средней части каждого саркомера, где они лежат параллельно друг другу; эта область выглядит как широкая темная (анизотропная) полоса, называемая А-полосой.В обеих половинах саркомера находится по набору тонких филаментов. Один конец каждого из них прикреплен к так называемой Z-пластинке(или Z-линии, или Z-полосе) - сети из переплетающихся белковых молекул, - а другой конец перекрывается с толстыми филаментами. Саркомер ограничен двумя последовательно расположенными Z-полосами. Таким образом, тонкие филаменты двух соседних саркомеров закреплены на двух сторонах каждой Z-полосы.
Светлая (изотропная) полоса - так называемая I-полоса- расположена между краями А-полос двух соседних саркомеров и состоит из тех участков тонких филаментов, которые не перекрываются с толстыми филаментами. Z-полоса делит I-полосу пополам.
В пределах А-полосы каждого саркомера различают еще две полоски. В центре А-полосы видна узкая светлая полоска - Н-зона.Она соответствует промежутку между противостоящими друг другу концами двух наборов тонких филаментов каждого саркомера, т.е. включает только центральные части толстых филаментов. Посередине Н-зоны находится совсем тонкая темная М-линия.Это сеть белков, соединяющих центральные части толстых филаментов. Кроме того, от Z-полосы к М-линии идут филаменты белка титина, связанные одновременно с белками М-линии и с толстыми филаментами. М-линия и титиновые филаменты поддерживают упорядоченную организацию толстых филаментов в середине каждого саркомера. Таким образом, толстые и тонкие филаменты не являются свободными, незакрепленными внутриклеточными структурами.
Рис. 4-3. Структура скелетных мышц.
А - организация цилиндрических волокон в скелетной мышце, прикрепленной к костям сухожилиями. Б - структурная организация филаментов в волокне скелетной мышцы, создающая картину поперечных полос. Показаны многочисленные миофибриллы в одиночном мышечном волокне, а также организация толстых и тонких филаментов в саркомере

Молекула актина
Это глобулярный белок, состоящий из одного полипептида, который полимеризуется с другими молекулами актина и образует две цепи, обвивающие друг друга (рис. 4-4 А). Такая двойная спираль представляет собой остов тонкого филамента. На каждой молекуле актина есть участок связывания миозина. В покоящемся мышечном волокне взаимодействие между актином и миозином предотвращают два белка - тропонини тропомиозин(рис. 4-4 Б).
Тропомиозин - стержневидная молекула из двух полипептидов, обвивающихся друг около друга; молекула соответствует в длину примерно семи мономерам актина. Цепи из молекул тропомиозина, уложенные конец в конец, располагаются вдоль всего тонкого филамента. Молекулы тропомиозина частично прикрывают участки связывания каждой молекулы актина,мешая контакту миозина с актином. В таком блокирующем положении молекула тропомиозина удерживается тропонином.
Тропонин - гетеротримерный белок. Он состоит из тропонина Т (отвечает за связывание с одиночной молекулой тропомиозина), тропонина С (связывает ион Са2+) и тропонина I (связывает актин и ингибирует сокращение). Каждая молекула тропомиозина связана с одной гетеротримерной молекулой тропонина, которая регулирует доступ к участкам связывания миозина на семи мономерах актина, прилегающих к молекуле тропомиозина.
Миозин
Это единое название большой семьи протеинов, имеющих определенные отличия в клетках разных тканей. Миозин присутствует у всех эукариотов. Около 60 лет назад было известно два типа миозина, которые сейчас называют миозин I и миозин II. Миозин II был первым из числа открытых миозинов, и именно он принимает участие в мышечном сокращении. Позднее были открыты миозин I и миозин V (рис. 4-4 В). В последнее время показано, что миозин II участвует в мышечном сокращении, тогда как миозин I и миозин V вовлечены в работу подмембранного (кортикального) цитоскелета. В настоящее время идентифицировано более 10 классов миозина. На рисунке 4-4 Г показано два варианта схемы строения миозина, который состоит из головки, шейки и хвоста. Молекула миозина состоит из двух больших полипептидов (тяжелых цепей) и четырех меньших (легких цепей). Эти полипептиды составляют молекулу с двумя глобулярными «головками», которые содержат оба вида цепей, и длинным стержнем («хвостом») из двух переплетенных тяжелых цепей. Хвост каждой молекулы миозина располагается вдоль оси толстого филамента, а две глобулярные головки выступают по бокам, их иначе называют поперечными мостиками.На каждой глобулярной головке находятся по два участка связывания: для актина и для АТФ. Участки связывания АТФ обладают также свойствами фермента АТФазы, гидролизующей связанную молекулу АТФ.
На рисунке 4-4 Д представлена упаковка молекул миозина. Выступающие головки миозина и есть поперечные мостики.
Рис. 4-4. Строение актина и миозина

Саркоплазматический ретикулум
В состоянии покоя в мышечном волокне концентрация свободного, ионизированного Са2+ в цитоплазме вокруг толстых и тонких филаментов очень низка, около 10-7 моль/л. При такой концентрации ионы Са2+ занимают очень небольшое количество участков связывания на молекулах тропонина (тропонина С), поэтому тропомиозин блокирует связывание с актином поперечных мостиков. После потенциала действия концентрация ионов Са2+ в цитоплазме быстро возрастает, и они связываются с тропонином, устраняя блокирующий эффект тропомиозина и инициируя цикл поперечных мостиков. Источником поступления Са2+ в цитоплазму служитсаркоплазматический ретикулуммышечного волокна.
Саркоплазматический ретикулуммышц гомологичен эндоплазматическому ретикулуму других клеток. Он располагается вокруг каждой миофибриллы наподобие «рваного рукава», сегментами которого окружены А- и I-полосы. Концевые части каждого сегмента расширяются в виде так называемых латеральных мешков(терминальных цистерн), соединенных друг с другом серией более тонких трубок. В латеральных мешках депонируется Са2+, высвобождающийся после возбуждения плазматической мембраны (рис. 4-5 А).
Отдельную систему составляют поперечные трубочки (Т-трубочки),которые пересекают мышечное волокно на границе полос А-I, проходят между латеральными мешками двух смежных саркомеров и выходят на поверхность волокна, составляя единое целое с плазматической мембраной. Просвет Т-трубочки заполнен внеклеточной жидкостью, окружающей мышечное волокно (рис. 4-5 Б). Мембрана Т-трубочек, так же как плазматическая мембрана, способна к проведению потенциала действия. Возникнув в
плазматической мембране (рис. 4-5 В), потенциал действия быстро распространяется по поверхности волокна и по мембране Т-трубочек вглубь клетки. Достигнув области Т-трубочек, прилегающей к латеральным мешкам, потенциал действия активирует потенциалзависимые «воротные» белки мембраны Т-трубочек, физически или химически сопряженные с кальциевыми каналами мембраны латеральных мешков. Таким образом, деполяризация мембраны Т-трубочек, обусловленная потенциалом действия, приводит к открыванию кальциевых каналов мембраны латеральных мешков, содержащих Са2+ в высокой концентрации, и ионы Са2+выходят в цитоплазму. Повышение цитоплазматического уровня Са2+ обычно бывает достаточным для активации всех поперечных мостиков мышечного волокна.
Процесс сокращения продолжается, пока ионы Са2+ связаны с тропонином, т.е. до тех пор, пока их концентрация в цитоплазме не вернется к низкому исходному значению. Мембрана саркоплазматического ретикулума содержит Са-АТФазу - интегральный белок, осуществляющий активный транспорт Са2+ из цитоплазмы обратно в полость саркоплазматического ретикулума. Как только что говорилось, Са2+ высвобождается из ретикулума в результате распространения потенциала действия по Т-трубочкам; для возвращения Са2+ в ретикулум нужно гораздо больше времени, чем для его выхода. Именно поэтому, повышенная концентрация Са2+ в цитоплазме сохраняется в течение некоторого времени, и сокращение мышечного волокна продолжается после завершения потенциала действия.
Подведем итог. Сокращение обусловлено высвобождением ионов Са2+, хранящихся в саркоплазматическом ретикулуме. Когда Са2+поступает обратно в ретикулум, сокращение заканчивается и начинается расслабление.
Рис. 4-5. Саркоплазматический ретикулум и его роль в механизме сокращения мышцы.
А - схема организации саркоплазматического ретикулума, поперечных трубочек и миофибрилл. Б - схема анатомической структуры поперечных трубочек и саркоплазматического ретикулума в индивидуальном волокне скелетной мышцы. В - роль саркоплазматического ретикулума в механизме сокращения скелетной мышцы

Электромеханическое сопряжение
Это последовательность процессов, в результате которых потенциал действия плазматической мембраны мышечного волокна приводит к запуску сокращения мышцы или к так называемому циклу поперечных мостиков, который будет продемонстрирован далее.
Плазматическая мембрана скелетных мышц электрически возбудима и способна генерировать распространяющийся потенциал действия посредством механизма, аналогичного тому, который действует в нервных клетках. Потенциал действия в волокне скелетной мышцы длится 1-2 мс и заканчивается раньше, чем появятся какие-либо признаки механической активности (рис. 4-6 А). Начавшаяся механическая активность может продолжаться более 100 мс. Электрическая активность плазматической мембраны не оказываетпрямоговлияния на сократительные белки, а вызывает повышение цитоплазматической концентрации ионов Са2+, которые продолжают активировать сократительный аппарат и после прекращения электрического процесса.
Сокращение мышц
В физиологии мышц термин «сокращение» не обязательно следует понимать как «укорочение». Прежде всего, рассматривается факт активации поперечных мостиков - участков генерирования силы в мышечном волокне. После сокращения механизм, инициирующий развитие силы, выключается.
Силу, с которой мышца, при ее сокращении, действует на предмет, называют мышечным напряжением (tension); сила действия предмета (обычно его массы) на мышцу - это нагрузка (load). Силы мышечного напряжения и нагрузки противодействуют друг другу. Приведет ли сила, генерируемая мышечным волокном, к его укорочению, зависит от относительных величин напряжения и
нагрузки. Чтобы мышечное волокно укоротилось и таким образом переместило нагрузку, его напряжение должно быть больше противодействующей нагрузки.
Если мышца развивает напряжение, но не укорачивается (и не удлиняется), сокращение называют изометрическим(длина мышцы постоянна). Такое сокращение происходит, когда мышца удерживает нагрузку в постоянном положении либо развивает силу по отношению к нагрузке, масса которой больше, чем мышечное напряжение. Если мышца укорачивается, а нагрузка на нее остается постоянной, сокращение называют изотоническим(напряжение мышцы постоянно).
Модель скользящих нитей
При укорочении волокна каждый поперечный мостик, прикрепившийся к тонкому филаменту, совершает поворот наподобие вращения лодочного весла. Вращательные движения множества поперечных мостиков подтягивают тонкие филаменты от обоих краев А-полосы к ее середине, и саркомер укорачивается (рис. 4-6 Б). Один «гребок» поперечного мостика создает очень маленькое перемещение тонкого филамента относительно толстого. Однако, за весь период активного состояния (возбуждения) мышечного волокна каждый поперечный мостик повторяет свое вращательное движение много раз, обеспечивая значительное смещение миофиламентов. Детальный молекулярный механизм этого явления будет рассматриваться далее.
Во время генерирования силы, укорачивающей мышечное волокно, перекрывающиеся толстые и тонкие филаменты каждого саркомера, подтягиваемые движениями поперечных мостиков, сдвигаются друг относительно друга. Длина толстых и тонких филаментов при укорочении саркомера не изменяется (рис. 4-6 В). Этот механизм мышечного сокращения известен как модель скользящих нитей.
Рис. 4-6. Феномен электромеханического сопряжения.
А - соотношение между временным ходом потенциала действия в мышечном волокне и возникающим в результате этого сокращением мышечного волокна с последующим его расслаблением. Б - поперечные мостики толстых филаментов, связываясь с актином тонких филаментов, подвергаются конформационному изменению, благодаря которому тонкие филаменты подтягиваются к середине саркомера. (На схеме изображены лишь два из примерно 200 поперечных мостиков каждого толстого филамента). В - модель скользящих нитей. Скольжение перекрывающихся толстых и тонких филаментов друг относительно друга приводит к укорочению миофибриллы без изменений длины филаментов. I-диск и Н-зона при этом уменьшаются
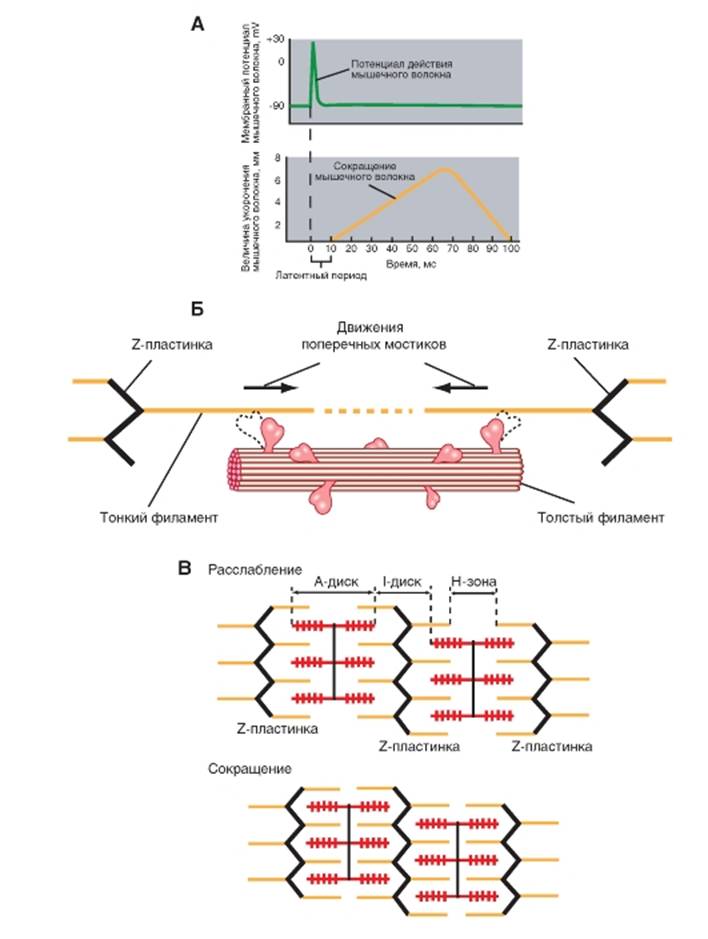
Специфические белки скелетной мышцы
Как было отмечено, толстые и тонкие филаменты образуют периодический рисунок вдоль каждой миофибриллы. Регулярно повторяющийся элемент - саркомер. Толстые филаменты состоят почти целиком из сократительного белка миозина. Тонкие филаменты содержат сократительный белок актин, тропонин и тропомиозин. Толстые филаменты сосредоточены в средней части каждого саркомера, где они лежат параллельно друг другу. Эта область имеет вид широкой темной полосы, называемой А-полосой (рис. 4-7 А). В обеих половинах саркомера находится по набору тонких филаментов. Один конец каждого из них прикреплен к так называемой Z-полосе (или Z-линии) - сети из переплетающихся белковых молекул. Другой конец перекрывается с толстыми филаментами. Саркомер ограничен двумя последовательно расположенными Z-полосами. Таким образом, тонкие филаменты двух соседних саркомеров закреплены на двух сторонах каждой Z-полосы. Светлая полоса - I-полоса, расположена между краями А-полос двух соседних саркомеров и состоит из тех участков тонких филаментов, которые не перекрываются с толстыми филаментами. Z-полоса делит I-полосу пополам.
Два конца каждого толстого филамента молекулы миозина ориентированы в противоположных направлениях так, что концы их хвостов направлены по отношению к центру филамента (рис. 4-7 Б). Благодаря этому при гребковых движениях поперечных мостиков прикрепившиеся к ним тонкие
филаменты левой и правой половины саркомера проталкиваются к его середине, в результате саркомер укорачивается. То есть во время генерирования силы, укорачивающей мышечное волокно, перекрывающиеся толстые и тонкие филаменты каждого саркомера сдвигаются друг относительно друга, подтягиваемые движениями поперечных мостиков. Длина толстых и тонких филаментов при укорочении саркомера не изменяется
(рис. 4-7 Б).
Известно, что в пределах А-полосы каждого саркомера различаются еще две полоски. В центре А-полосы видна узкая светлая полоска - Н-зона. Она соответствует промежутку между противостоящими друг другу концами двух наборов тонких филаментов каждого саркомера, т.е. включает только центральные части толстых филаментов. Посередине Н-зоны находится совсем тонкая темная М-линия. Это сеть белков, соединяющих центральные части толстых филаментов. На рис. 4-7 В показаны известные в настоящее время дополнительные белки. От Z-полосы к М-линии идут филаменты белка титина,связанные одновременно с белками М-линии и с толстыми филаментами. М-линияи титиновые филаментыподдерживают упорядоченную организацию толстых филаментов в середине каждого саркомера. Таким образом, толстые и тонкие филаменты не являются свободными, незакрепленными внутриклеточными структурами. Кроме того, на рис. 4-7 В показан белок CapZ,определяющий стабилизацию филаментов актина. Показан также тропомодулин.На рисунке представлен и гигантский протеин - небулин.
Рис. 4-7. Строение скелетной мышцы в норме (А), на фоне расслабления (Б) и сокращения (В). Дополнительные белки, найденные в скелетной мышце (Г)
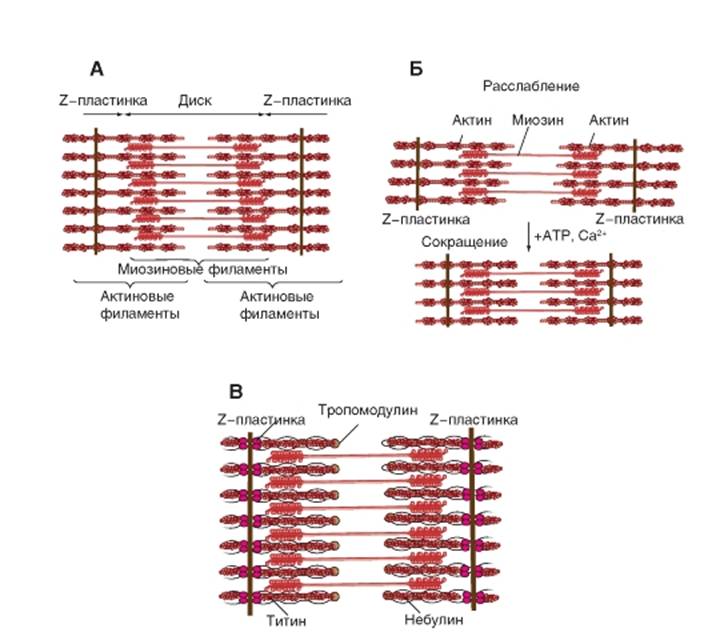
Молекула актина и миозина
Тонкий филамент(рис. 4-8 А) состоит из актина, тропомиозина и тропонина. Основа тонкого филамента - двойная закрученная цепь α- спирального полимера молекулы актина. Иначе говоря, это две цепи, закрученные относительно друг друга. Такая двойная спираль представляет собой остов тонкого филамента. Каждый спиральный оборот единичной нити филамента, или F-актин, состоит из 13 единичных мономеров в виде глобул и равен в длину примерно 70 нм. На каждой единичной молекуле актина есть участок связывания миозина. F-актин связан с двумя важнейшими регуляторными актинсвязывающими белками - тропомиозином и тропонином. Эти белки в покоящемся мышечном волокне предотвращают взаимодействие между актином и миозином. Коротко, молекулы тропомиозина частично закрывают участки связывания каждой единичной молекулы актина, мешая контакту миозина с актином. В таком состоянии блокирования участков связывания каждой единичной молекулы актина молекула тропомиозина удерживает тропонин. Рассмотрим тропомиозин и тропонин подробнее.
Тропомиозин - длинная молекула, состоящая из двух полипептидов, обвивающих друг друга. Молекула тропомиозина соответствует в длину примерно семи мономерам актина. Цепи из молекул тропомиозина, уложенные конец в конец, располагаются вдоль всего тонкого филамента. Молекулы тропомиозина частично прикрывают участки связывания каждой молекулы актина,блокируя возможность контакта миозина с актином. В таком блокирующем положении молекула тропомиозина удерживается тропонином.
Тропонин - гетеротримерный белок. Он состоит из тропонина Т, который отвечает за связывание с одиночной молекулой тропомиозина, тропонина С, который связывает ион Са2+, и тропонина I, который связывает актин и ингибирует сокращение. Каждая молекула тропомиози-
на связана с одной гетеротримерной молекулой тропонина, регулирующей доступ к участкам связывания миозина на семи мономерах актина, прилегающих к молекуле тропомиозина.
Молекула миозина(рис. 4-8 Б) - единое название большой семьи протеинов, имеющих определенные отличия в клетках разных тканей. В мышечном сокращении участвует миозин II,открытый первым из числа всех миозинов. В целом, молекула миозина II состоит из двух больших полипептидов (так называемых тяжелых цепей) и четырех меньших (так называемых легких цепей). У миозина II две тяжелые цеписоставляют молекулу, содержащую две глобулярные «головки»(по одной у каждого полипептида) и соответственно две незакрученные «шейки».В некоторой литературе шейку тяжелой цепи переводят как «плечо молекулы миозина». Далее два больших полипептида, т.е. две тяжелые цепи, начинают закручиваться относительно друг друга. Их начальный регион закручивания получил название «шарнирный регион тяжелых цепей».Затем следует длинный стержень из двух переплетенных тяжелых цепей, получивший название «хвост».Хвост каждой молекулы миозина располагается вдоль оси толстого филамента, а две глобулярные головки вместе с шейками и шарнирным регионом, выступающие по бокам, иначе называют «поперечными мостиками».На каждой глобулярной головке у миозина II находятся по две легких цепи. Одна - так называемая легкая регуляторная цепь, другая - легкая основная цепь. Легкая основная цепь участвует в стабилизации головки миозина. Легкая регуляторная цепь регулирует активность фермента АТФазы миозина, гидролизующей связанную молекулу АТФ. Действие легкой регуляторной цепи миозина заключается в изменении регуляции посредством фосфорилирования с помощью Са2+-зависимой или Са2+-независимой киназ.
Взаимодействие тонкого филамента и одиночной пары головок от миозина толстого филамента показано на рис. 4-8 В.
Рис. 4-8. Молекулярная организация тонких и толстых филаментов.
А - тонкий филамент. Б - молекула миозина. В - взаимодействие тонкого и толстого филамента

Взаимодействие актина и миозина
Рассмотрим вопрос, что позволяет поперечным мостикам, т.е. глобулярным головкам (вместе с шейками и шарнирным регионом), связываться с актином и начинать совершать определенное движение. Если говорить предельно коротко, то в основе мышечного сокращения лежит цикл, в котором головки миозина II связываются с участками связывания актина. Эти поперечные мостики создают искривление, что соответствует перемещению молекулы, после чего головки миозина отделяются от актина. Для этих циклов берется энергия гидролиза АТФ. Мышцы имеют механизмы регуляции циклов поперечных мостиков. Увеличение [Ca2+]in инициирует продолжение формирования циклов поперечных мостиков. При возбуждении происходит увеличение [Ca2+]in от уровня покоя (10-7 М и меньше) до более чем 10-5 М.
Начнем с того, что потенциал действия в волокне скелетной мышцы длится 1-2 мс и заканчивается раньше, чем появятся какие-либо признаки механической активности. Начавшаяся механическая активность может продолжаться более 100 мс. Электрическая активность плазматической мембраны не оказывает прямоговлияния на сократительные белки, а вызывает повышение цитоплазматической концентрации ионов Са2+, которые продолжают активировать сократительный аппарат и после прекращения электрического процесса. То есть сокращение обусловлено высвобождением ионов Са2+, хранящихся в саркоплазматическом ретикулуме. Когда Са2+
поступает обратно в ретикулум, сокращение заканчивается и начинается расслабление. Источником энергии для кальциевого насоса служит АТФ: это одна из трех главных функций АТФ в мышечном сокращении.
Итак, сокращение инициируется в результате увеличения [Ca2+]in. Молекула гетеротримерного тропонина содержит ключевой Ca2+-сенситивный регулятор - тропонин С. Каждая молекула тропонина С в скелетной мышце имеет два высокоаффинных Ca2+-связывающих места, которые участвуют в связывании тропонина С с тонким филаментом. Связывание Ca2+ в этих высокоаффинных местах постоянно и не меняется в течение активности мышцы. Каждая молекула тропонина С в скелетной мышце имеет также два дополнительных низкоаффинных Ca2+-связывающих места. Взаимодействие Ca2+ с ними индуцирует конформационные изменения в тропониновом комплексе, приводящие к двум эффектам. Первый эффект заключается в том, что С-терминаль ингибиторного тропонина I двигается в направлении от центра связывания актина с миозином (расположенном на актине), тем самым осуществляя движение молекулы тропомиозина также в сторону от центра связывания актина с миозином (расположенном на актине). Другой эффект осуществляется через тропонин Т, и заключается в выталкивании тропомиозина от центра связывания актина с миозином в так называемый актиновый желобок. Это приводит к тому, что центр связывания с миозином на актине открывается, и головка миозина может взаимодействовать с актином, создавая цикл поперечных мостиков.
Рис. 4-9. Принципы взаимодействия актина и миозина в скелетной и сердечной мышцах
Механизм сокращения
Последовательность событий, начиная от связывания поперечного мостика с тонким филаментом и до момента, когда система готова к повторению процесса, называется рабочим циклом поперечных мостиков.Каждый цикл состоит из четырех основных фаз. Фаза 1 - головка миозина прочно связана с молекулой актина в актомиозиновый комплекс. Для отделения головки миозина в цитозоле необходим АТФ, и его подход к миозину показан стрелкой на схеме. Фаза 2 - если головка миозина связывается с АТФ, то уменьшается аффинность головки миозина к актину. Из-за уменьшения аффинности головка миозина отделяется от молекулы актина. При устранении действия на головку миозина АТФ цикл продолжается дальше. В мышце это происходит, исключительно, благодаря расщеплению АТФ до АДФ+Рi в результате работы фермента АТФазы миозина. Этот шаг зависит от наличия Mg2+. Фаза 3 - если на головке миозина после расщепления АТФ на АДФ и Pi оба, АДФ и Pi, связаны. При этом головка миозина выпрямляется. Аффинность образования актомиозинового комплекса опять повышается, и головка миозина может вновь присоединить молекулу актина со слабой связью. Фаза 4 - инициация слабой связи переходит быстро в более сильную связь с головкой миозина, нагруженной АДФ. Переход в это состояние представляет собой собственно ступень генерации силы. Этот процесс объясняют вращением головки миозина, благодаря которой поворот миозина осуществляет сдвиг на шаг филамент актина.
В цикле поперечных мостиков АТФ выполняет две разные роли:
1) гидролизАТФ поставляет энергию для движения поперечного мостика;
2) связывание(но не гидролиз) АТФ с миозином сопровождается отделением миозина от актина и создает возможность повторения цикла поперечных мостиков.
Химические и физические явления во время четырех стадий цикла поперечных мостиков можно представить иначе. Молекула АТФ, связанная с миозином, расщепляется с освобождением химической энергии и образованием высокоэнергетической конформации миозина поперечного мостика; с этой формой миозина (М*) остаются связанными продукты гидролиза АТФ-АДФ и неорганический фосфат (Pi).
Энергию активной конформации миозина можно сравнить с потенциальной энергией растянутой пружины.

Гидролиз АТФ.
Далее происходит связывание высокоэнергетической формы миозина с актином (А) тонкого филамента:

Связывание актина.
При связывании высокоэнергетической формы миозина с актином запускается освобождение напряженной конформации высокоэнергетического поперечного мостика; в результате связанный с актином поперечный мостик совершает свое вращательное движение и одновременно теряет АДФ и Pi.

Движение поперечного мостика.
Процесс последовательного получения и освобождения энергии миозином можно сравнить с работой мышеловки. В ней энергия запасается при растягивании пружины (в мышце - при гидролизе АТФ), а освобождается при отпускании пружины (в мышце - при связывании миозина с актином).
Во время движения поперечного мостика миозин очень прочно прикреплен к актину; только после разрыва этой связи он может снова получить энергию и повторить цикл. Связь между актином и миозином разрывается при соединении с миозином новой молекулы АТФ.
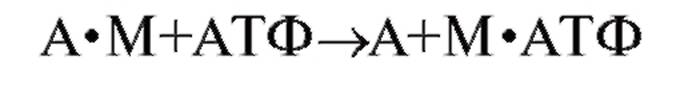
Диссоциация поперечного мостика от актина.
Обеспечиваемое АТФ разделение актина и миозина - пример аллостерической регуляции активности белка. Связывание АТФ с одним участком миозина снижает сродство его молекулы к актину, связанному с другим участком. Следовательно, АТФ действует как модулятор, регулирующий связывание актина с миозином. Отметим, что на этой стадии АТФ не расщепляется, т.е. служит не источником энергии, а только модулирующей молекулой, которая обеспечивает аллостерическую модуляцию миозиновой головки и тем самым ослабляет связь миозина с актином.
Рис. 4-10. Механизм сокращения. Представлен рабочий цикл поперечных мостиков - головки миозина (вместе с шейкой и шарнирным регионом).
На панели (А) процесс представлен в виде замкнутого цикла из четырех фаз. На панели (Б) процесс представлен в виде последовательных шагов более детально
Одиночное сокращение мышцы
Если мышца развивает напряжение, но не укорачивается (и не удлиняется), сокращение называется изометрическим(длина мышцы постоянна). Такое сокращение происходит, когда мышца удерживает нагрузку в постоянном положении, либо развивает силу по отношению к нагрузке, масса которой больше, чем мышечное напряжение. Если мышца укорачивается, а нагрузка на нее остается постоянной, сокращение называется изотоническим(напряжение мышцы постоянно).
Механический ответ отдельного мышечного волокна на одиночный потенциал действия называется одиночным сокращением(twitch).Основные характеристики одиночного изометрического сокращенияпоказаны на рис. 4-11 А. Начало мышечного напряжения запаздывает на несколько миллисекунд по отношению к потенциалу действия. В течение этого латентного периодапроходят все этапы электромеханического сопряжения. Интервал от начала развития напряжения до момента его максимума это время сокращения.Оно различно для разных типов волокон скелетных мышц. Время сокращения быстрых волокон не превышает 10 мс, тогда как для более медленных волокон оно не меньше 100 мс. Длительность сокращения определяется тем, как долго цитоплазматическая концентрация Са2+ остается повышенной, обеспечивая продолжение циклической активности поперечных мостиков. Время сокращения обусловлено активностью Са-АТФазы саркоплазматического ретикулума, которая в быстрых волокнах выше, чем в медленных.
Характеристики изотонического сокращения зависят также от массы поднимаемой нагрузки (рис. 4-11 Б), а именно, при более тяжелой нагрузке:
1) латентный период продолжительнее;
2) скорость укорочения (величина укорочения мышцы в единицу времени), длительность сокращения и величина укорочения мышцы - меньше.
Сравнение одиночных сокращений одного и того же мышечного волокна при разных режимах его деятельности показывает (рис. 4-11 В), что латентный период больше для изотонического сокращения, чем для изометрического, тогда как длительность механического процесса меньше в случае изотонического сокращения (т.е. при укорочении), чем изометрического (т.е. при генерировании силы).
Рассмотрим подробнее последовательность явлений во время изотонического одиночного сокращения. При возбуждении мышечного волокна поперечные мостики начинают развивать силу, однако укорочение не начнется, пока мышечное напряжение не превысит нагрузку на волокно. Таким образом, укорочению предшествует период изометрического сокращения,в течение которого возрастает напряжение. Чем тяжелее нагрузка, тем больше потребуется времени, чтобы напряжение сравнялось с величиной нагрузки и началось укорочение. Если нагрузку повышать, то, в конце концов, мышечное волокно не сможет ее поднять, скорость и степень укорочения будут равны нулю и сокращение станет полностью изометрическим.
Заметим, что силу, с которой мышца при ее сокращении действует на предмет, называют мышечным напряжением (tension). Сила действия предмета (обычно его массы) на мышцу - это нагрузка (load). Кривая мышечного сокращения в отечественной литературе издревле называется «механограммой», т.е. записью механической активности мышцы. В мировой литературе обычно применяют понятия resting tension (force) для описания силы, с которой покоящаяся мышца действует на предмет (в mN), и active tension (force)для описания силы, с которой мышца при ее сокращении действует на предмет.
Силы мышечного напряжения и нагрузки противодействуют друг другу. Приведет ли сила, генерируемая мышечным волокном, к его укорочению, зависит от относительных величин напряжения и нагрузки. Чтобы мышечное волокно укоротилось и, таким образом, переместило нагрузку, его напряжение должно быть больше противодействующей нагрузки.
Рис. 4-11. Одиночное мышечное сокращение.
А - одиночное изометрическое сокращение волокна скелетной мышцы после одного потенциала действия. Б - одиночные изотонические сокращения при разных нагрузках. Величина, скорость и продолжительность укорочения уменьшаются с увеличением нагрузки, тогда как интервал времени от стимула до начала укорочения возрастает с увеличением нагрузки. В - одиночное изотоническое сокращение волокна скелетной мышцы после одного потенциала действия

Виды мышечных сокращений
Поскольку длительность одного потенциала действия в скелетном мышечном волокне составляет 1-2 мс, а одиночное сокращение может продолжаться 100 мс, момент инициации второго потенциала действия может попасть на период механической активности. На рисунке 4-12 А- В представлены изометрические сокращения мышечного волокна в ответ на три последовательных стимула. Изометрическое сокращение в ответ на первый стимул S1 продолжалось 150 мс (рис. 4-12 А). Второй стимул S2, поданный через 200 мс после S1, когда мышечное волокно уже полностью расслабилось, вызвал второе сокращение, идентичное первому, а третий стимул S3 с таким же интервалом - третье идентичное сокращение. На рисунке 4-12 Б интервал S1-S2 остался равным 200 мс, а третий стимул был подан через 60 мс после S2, когда механический ответ на S2 начал снижаться, но еще не закончился. Стимул S3 вызвал сократительный ответ, максимальное напряжение которого превысило ответ на S2. На рисунке 4-12 В интервал S2-S3 был уменьшен до 10 мс, и максимальный механический ответ увеличился еще больше, причем ответ на S3 оказался слитным продолжением ответа на S2.
Увеличение мышечного напряжения при последовательных потенциалах действия, возникающих до окончания фазы механической активности, называется суммацией.При слиянии одиночных сокращений во время ритмического раздражения наблюдается тетанус(тетаническое сокращение). При низких частотах раздражения механический ответ может быть волнообразным, так как волокно частично расслабляется в промежутках между стимулами; это зубчатый тетанус.Если частоту раздражения повысить, получается гладкий тетанус, без осцилляций (рис. 4-12 Г).
По мере повышения частоты потенциалов действия величина напряжения возрастает в результате суммации до тех пор, пока гладкий тетанус не достигнет максимума, после которого напряжение не будет увеличиваться при дальнейшем повышении частоты раздражения.
Чтобы объяснить причинысуммации, нужнорассмотреть, какие процессы происходят в мышечных волокнах. Но сначала следует получить сведения об упругих свойствах мышцы. Мышца содержит пассивные упругие элементы (участки толстых и тонких филаментов, а также сухожилия), последовательно соединенные с сократительными элементами (генерирующими силу). Последовательные
упругие элементы действуют как пружины, через которые активная сила, генерируемая поперечными мостиками, передается к нагрузке. Временной ход напряжения при изометрическом сокращении включает период, необходимый для растяжения последовательных упругих элементов.
Напряжение мышечного волокна в конкретный момент времени зависит от следующих факторов:
1) число поперечных мостиков, прикрепленных к актину и находящихся на 2-й стадии цикла поперечных мостиков в каждом саркомере;
2) сила, создаваемая каждым поперечным мостиком;
3) длительность активного состояния поперечных мостиков.
Один потенциал действия вызывает в мышечном волокне высвобождение такого количества Са2+, которое достаточно для насыщения тропонина, поэтому все участки связывания миозина на тонких филаментах изначально доступны. Однако связывание высокоэнергетической формы поперечных мостиков с этими участками (1-я стадия цикла поперечного мостика) занимает некоторое время, а кроме того, как было отмечено выше, необходимо время для растяжения последовательных упругих элементов. В результате, несмотря на изначальную доступность всех участков связывания при одиночном сокращении, максимальное напряжение развивается не сразу. Еще одно обстоятельство: почти сразу после высвобождения ионов Са2+ начинается их обратный перенос в саркоплазматический ретикулум, так что концентрация Са2+ в цитоплазме постепенно снижается относительно прежнего высокого уровня и, следовательно, на актиновых нитях остается все меньше участков связывания миозина, способных взаимодействовать с поперечными мостиками.
Иная ситуация во время тетанического сокращения. Каждый очередной потенциал действия вызывает высвобождение Са2+ из саркоплазматического ретикулума раньше, чем заканчивается обратный перенос всех ионов Са2+, находящихся в цитоплазме после предыдущего потенциала действия. Благодаря этому устойчиво поддерживается повышенная цитоплазматическая концентрация Са2+и, значит, не уменьшается количество доступных для связывания с миозином участков на актиновых филаментах. В итоге количество доступных для связывания участков остается на максимальном уровне, циклическая активность поперечных мостиков обеспечивает достаточное растяжение последовательных упругих элементов и передачу максимального напряжения к концам мышечного волокна.
Рис. 4-12. Соотношение между частотой и напряжением.
А-В - суммация сокращений в результате уменьшения промежутков времени между стимулами S2 и S3. Г - изометрические сокращения, вызванные серией стимулов с частотой 10/с (зубчатый тетанус) и 100/с (слитный тетанус); для сравнения показано одиночное сокращение
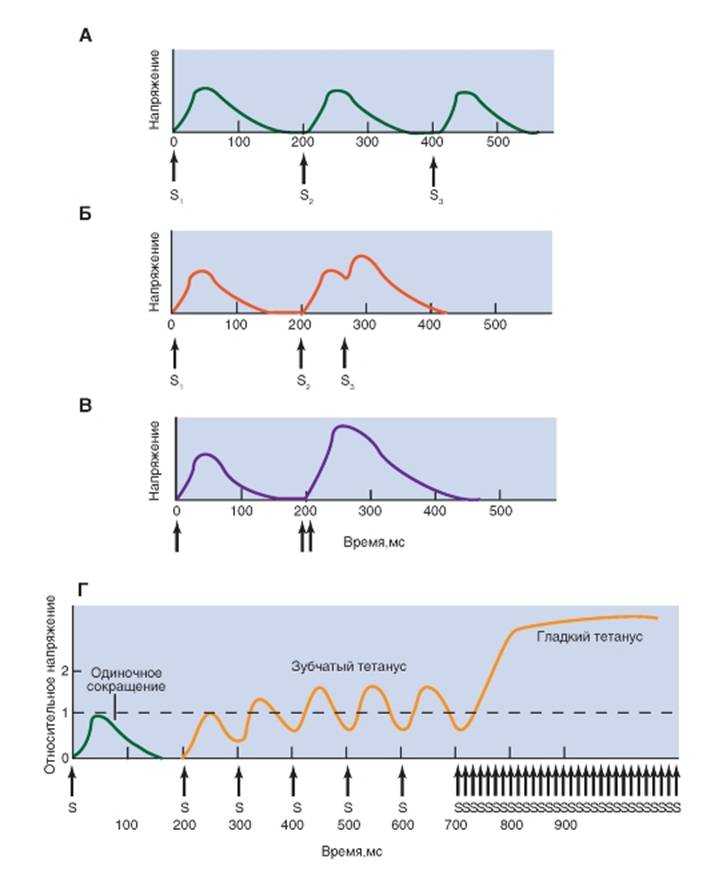
Соотношение между нагрузкой и скоростью укорочения
Скорость укорочения мышечного волокна уменьшается при увеличении нагрузки (рис. 4-13 А). Скорость укорочения максимальна при отсутствии нагрузки и равна нулю, когда нагрузка соответствует силе максимального изометрического напряжения. Если нагрузка станет больше, чем максимальное изометрическое напряжение, будет происходить удлинениемышечного волокна со скоростью, возрастающей с увеличением нагрузки; при очень большой нагрузке волокно разорвется.
Скорость укорочения определяется частотой повторения рабочих циклов каждого поперечного мостика и в конечном итоге частотой расщепления молекул АТФ, поскольку в каждом цикле поперечного мостика расщепляется одна молекула АТФ. Если нагрузка на поперечный мостик увеличивается, молекулы АТФ подвергаются гидролизу реже (по ряду причин) и, следовательно, снижается скорость укорочения.
Соотношение между длиной мышцы и ее напряжением
Пассивныеупругие свойства расслабленной мышцы обусловлены, главным образом, особенностями организации белка титина, молекула которого одним концом прикреплена к Z-поло- се, другим - к толстому филаменту, и действует подобно пружине. По мере растяжения мышцы пассивное напряжение расслабленного волокна возрастает, но не за счет активных движений поперечных мостиков, а благодаря растягиванию титиновых нитей. Если растянутое волокно отпустить, его длина вернется к равновесному состоянию, также как сокращается в аналогичной ситуации полоска резины. Растяжение приводит не только к пассивному напряжению мышечного волокна, но и к изменению его активного напряжения при сокращении. Поэтому сила, генерируемая во время сокращения, зависит от исходной длины мышечного волокна. Это проиллюстрировано экспериментом, когда мышечное волокно растягивают, и при каждой длине регистрируют величину активного напряжения в ответ на стимулы (рис. 4-13 Б). Длина, при которой волокно генерирует наибольшее активное изометрическое напряжение, называется оптимальной длиной,
При длине мышечного волокна, равной 60% от Lo, волокно не генерирует напряжения в ответ
на стимул. По мере растяжения волокна от этого исходного уровня активное изометрическое напряжение возрастает при каждом значении длины вплоть до максимума при длине Lo. В ходе дальнейшего удлинения волокна его напряжение падает.При длине, составляющей 175% и более от Lo, волокно не реагирует на раздражение.
Когда скелетные мышцы расслаблены, длина большинства их волокон приближается к Lo и, следовательно, оптимальна для генерирования силы. Длина расслабленных волокон меняется под действием нагрузки или в результате растягивания, обусловленного сокращением других мышц, однако пассивное изменение длины расслабленных волокон ограничено, поскольку мышцы прикреплены к костям. Пассивное изменение длины редко превышает 30%, а часто бывает гораздо меньше. В этом диапазоне значений исходной длины активное напряжение мышцы никогда не становится ниже половины напряжения, развиваемого при Lo (рис. 4-13 Б).
Соотношение между исходной длиной волокна и его способностью развивать активное напряжение во время сокращения можно объяснить с позиций модели скользящих нитей. При растяжении расслабленного мышечного волокна происходит вытягивание тонких филаментов из пучков толстых филаментов, так что зона перекрывания уменьшается. Если волокно растянуто до 1,75 Lo, филаменты уже не перекрываются. Поперечные мостики не могут связываться с актином, и напряжение не развивается. При меньшем растяжении (постепенное изменение длины от 1,75 Lo до Lo) зона перекрывания филаментов увеличивается, и напряжение, развиваемое при стимуляции, возрастает прямо пропорционально увеличению количества поперечных мостиков в зоне перекрывания. Самая большая зона перекрывания бывает при длине Lo; тогда к тонким филаментам может прикрепляться наибольшее количество поперечных мостиков, и генерируемое напряжение максимально.
Если длина волокна меньше Lo, развиваемое напряжение снижается ввиду ряда обстоятельств. Во-первых, пучки тонких филаментов с противоположных концов саркомера начинают взаимно перекрываться, мешая прикреплению поперечных мостиков и развитию силы. Во-вторых, по неясным пока причинам при уменьшении длины волокна снижается сродство тропонина к Са2+ и, следовательно, на тонких филаментах уменьшается количество участков, доступных для связывания с поперечными мостиками.
Рис. 4-13. Два основных соотношения: нагрузка - скорость укорочения мышцы, длина - напряжение мышцы.
А - скорость укорочения и удлинения волокна скелетной мышцы в зависимости от нагрузки. Отметим, что сила, действующая на поперечные мостики во время удлиняющего сокращения больше, чем максимальное изометрическое напряжение. Б - изменения активного изометрического тетанического напряжения в зависимости от длины мышечного волокна. Голубая область соответствует физиологическому диапазону значений длины волокон в мышце, прикрепленной к кости

Функциональная роль АТФ в процессе сокращения скелетной мышцы
1. В результате вызываемого миозином гидролиза АТФ поперечные мостики получают энергию для развития тянущего усилия.
2. Связывание АТФ с миозином сопровождается отсоединением поперечных мостиков, прикрепленных к актину.
3. Гидролиз АТФ под действием Са-АТФазы саркоплазматического ретикулума поставляет энергию для активного транспорта Са2+ в латеральные мешки саркоплазматического ретикулума, что приводит к снижению цитоплазматического Са2+ до исходного уровня. Соответственно сокращение завершается, и мышечное волокно расслабляется.
В скелетных мышцах при их переходе от состояния покоя к сократительной активности - в 20 раз (или даже в несколько сотен раз) резко одномоментно повышается скорость расщепления АТФ. Небольшой запас АТФ в скелетной мышце достаточен лишь для нескольких одиночных сокращений. Чтобы поддерживать длительное сокращение, молекулы АТФ должны образовываться в процессе метаболизма с такой же скоростью, с какой они расщепляются во время сокращения.
Существуют три способа образования АТФ во время сокращения мышечного волокна (рис. 4-14):
1) фосфорилирование АДФ путем переноса фосфатной группы от креатинфосфата;
2) окислительное фосфорилирование АДФ в мито - хондриях;
3) фосфорилирование АДФ в процессе гликолиза в цитоплазме.
Благодаря фосфорилированию АДФ креатинфосфатом обеспечивается очень быстрое образование АТФ в самом начале сокращения:

В течение периода покоя концентрация креатинфосфата в мышечном волокне возрастает до уровня, примерно в пять раз превышающего содержание АТФ. В начале сокращения, когда начинаются снижение концентрации АТФ и увеличение концентрации АДФ вследствие расщепления АТФ под действием АТФазы миозина, реакция сдвигается в сторону образования АТФ за счет креатинфосфата. При этом переход энергии совершается с такой большой скоростью, что в начале сокращения
концентрация АТФ в мышечном волокне изменяется мало, в то время как концентрация креатинфосфата падает быстро.
Хотя АТФ образуется за счет креатинфосфата очень быстро, посредством единственной ферментативной реакции, количество АТФ лимитировано исходной концентрацией креатинфосфата в клетке. Чтобы мышечное сокращение могло продолжаться дольше нескольких секунд, необходимо участие двух других, упоминавшихся выше, источников образования АТФ. После начала сокращения, обеспечиваемого за счет использования креатинфосфата, подключаются более медленные, требующие участия многих ферментов пути окислительного фосфорилирования и гликолиза, благодаря которым скорость образования АТФ увеличивается до уровня, соответствующего скорости расщепления АТФ.
При умеренной мышечной активности АТФ образуется преимущественно путем окислительного фосфорилирования, и в течение первых 5-10 мин главным ресурсом для этого служит гликоген. В последующие ~30 мин доминирующими становятся источники энергии, доставляемые кровью, причем глюкоза и жирные кислоты участвуют примерно в одинаковой мере. На более поздних этапах сокращения преобладает утилизация жирных кислот, а глюкоза расходуется меньше.
Если интенсивность мышечной работы такова, что скорость расщепления АТФ превышает 70% от ее максимального уровня, существенно возрастает вклад гликолиза в образование АТФ. Глюкоза для этого процесса поступает из двух источников: из крови или за счет запасов гликогена в мышечных волокнах. По мере усиления мышечной активности увеличивается доля АТФ, обеспечиваемая путем анаэробного процесса - гликолиза; соответственно образуется больше молочной кислоты.
По окончании мышечной работы запасы богатых энергией соединений (креатинфосфата и гликогена) в мышце снижены. Для восстановления запасов обоих соединений нужна энергия, поэтому мышца, уже находясь в состоянии покоя, продолжает некоторое время усиленно потреблять кислород. Благодаря усиленному потреблению кислорода в период после мышечной работы покрывается так называемый кислородный долг;и интенсивное образование АТФ путем окислительного фосфорилирования направлено на восстановление энергетических ресурсов в виде креатинфосфата и гликогена.
Рис. 4-14. Энергетический метаболизм скелетной мышцы.
Три ресурса для образования АТФ во время мышечного сокращения: 1 - креатинфосфат; 2 - окислительное фосфорилирование; 3 - гликолиз

Типы волокон скелетных мышц
Волокна скелетных мышц неодинаковы по своим механическим и метаболическим особенностям. Типы волокон различаются на основе следующих характеристик:
1) в зависимости от максимальной скорости укорочения - волокна быстрые и медленные;
2) в зависимости от главного пути образования АТФ - волокна оксидативные и гликолитические.
Быстрые и медленные мышечные волокна содержат изоферменты миозина, расщепляющие АТФ с разной максимальной скоростью, чему соответствует различная максимальная скорость рабочего цикла поперечных мостиков и, следовательно, разная максимальная скорость укорочения волокна. Высокая АТФазная активность миозина свойственна быстрым волокнам,более низкая АТФазная активность - медленным волокнам.Хотя в быстрых волокнах скорость рабочего цикла примерно в 4 раза выше, чем в медленных, поперечные мостики обоих типов генерируют одинаковую силу.
Другой подход к классификации волокон скелетных мышц основан на различиях ферментативных механизмов синтеза АТФ. В некоторых волокнах много митохондрий и, следовательно, обеспечивается высокий уровень окислительного фосфорилирования; этооксидативные волокна.Количество образующейся в них АТФ зависит от снабжения мышцы кровью, с которой поступают молекулы кислорода, и богатых энергией соединений. Волокна этого типа окружены многочисленными капиллярами. Кроме того, в них присутствует связывающий кислород белок - миоглобин,который увеличивает скорость диффузии кислорода, а также выполняет функцию кратковременного кислородного депо в мышечной ткани. Благодаря значительному содержанию миоглобина оксидативные волокна окрашены в темно-красный цвет; их часто называют красными мышечными волокнами.
В гликолитических волокнах,наоборот, мало митохондрий, но высокое содержание ферментов гликолиза и большие запасы гликогена. Эти волокна окружены относительно небольшим числом капилляров, и миоглобина в их ткани немного, что соответствует ограниченному использованию кислорода. Вследствие недостатка
миоглобина гликолитические волокна выглядят светлыми и получили название белых мышечных волокон.
На основании двух рассмотренных характеристик (скорость укорочения и тип метаболизма) можно выделить три типа волокон скелетных мышц.
1. Медленные оксидативные волокна(тип I) - низкая активность миозиновой АТФазы и высокая окислительная способность (рис. 4-15 А).
2. Быстрые оксидативные волокна(тип IIа) - высокая активность миозиновой АТФазы и высокая окислительная способность (рис. 4-15 Б).
3. Быстрые гликолитические волокна(тип IIб) - высокая активность миозиновой АТФазы и высокая гликолитическая способность
(рис. 4-15 В).
Отметим, что не обнаружен четвертый теоретически возможный вариант - медленные гликолитические волокна.
Волокна варьируют не только по своим биохимическим особенностям, но и по размерам: у гликолитических волокон диаметр существенно больше, чем у оксидативных. Это сказывается на величине развиваемого ими напряжения. Что касается числа толстых и тонких филаментов на единицу площади поперечного сечения, то оно примерно одинаково для всех типов скелетных мышечных волокон. Таким образом, чем больше диаметр волокна, тем большее число параллельно задействованных толстых и тонких филаментов участвует в генерировании силы, и тем больше максимальное напряжение мышечного волокна. Отсюда следует, что гликолитическое волокно, которое имеет больший диаметр, развивает в среднем более значительное напряжение, по сравнению с напряжением оксидативного волокна.
Кроме того, рассмотренные три типа мышечных волокон характеризуются разной устойчивостью к утомлению. Быстрые гликолитические волокна утомляются через короткое время, тогда как медленные оксидативные волокна очень выносливы, что позволяет им длительно поддерживать сократительную активность практически при постоянном уровне напряжения. Быстрые оксидативные волокна занимают промежуточное место по способности противостоять развитию утомления.
Характеристики трех типов волокон скелетных мышц обобщены в табл. 4-1.
Рис. 4-15. Типы волокон скелетных мышц. Скорость развития утомления в волокнах трех типов.
Каждая вертикальная линия соответствует сократительному ответу на короткое тетаническое раздражение. Сократительные ответы в период между 9-й и 60-й мин пропущены

Таблица 4-1.Характеристики трех типов волокон скелетных мышц

Напряжение мышцы
Силу, с которой мышца при ее сокращении действует на предмет, называют мышечным напряжением (tension); сила действия предмета (обычно его масса) на мышцу - это нагрузка (load). Если мышце задать фоновую нагрузку, как обычно осуществляют при измерениях, то эту фоновую нагрузку называют preload - преднагрузкойили предрастяжением.Часто это пишут в русскоязычном написании - «прелод».Силы мышечного напряжения и нагрузки противодействуют друг другу. Приведет ли сила, генерируемая мышечным волокном, к его укорочению, зависит от относительных величин напряжения и нагрузки. Чтобы мышечное волокно укоротилось и таким образом переместило нагрузку, его напряжение должно быть больше противодействующей нагрузки.
Если мышца развивает напряжение, но не укорачивается (и не удлиняется), сокращение называют изометрическим(длина мышцы постоянна) (рис. 4-16 А). Такое сокращение происходит, когда мышца удерживает нагрузку в постоянном положении либо развивает силу по отношению к нагрузке, масса которой больше, чем мышечное напряжение. Если мышца укорачивается, а нагрузка на нее остается постоянной, сокращение называют изотоническим(напряжение мышцы постоянно) (рис. 4-16 Б).
Третий тип сокращения - удлиняющее сокращение (эксцентрическое сокращение),когда действующая на мышцу нагрузка больше, чем напряжение, развиваемое поперечными мостиками. В такой ситуации нагрузка растягивает мышцу, несмотря на противодействующую силу, создаваемую движениями поперечных мостиков. Эксцентрическое сокращение происходит, если поддерживаемый мышцей объект смещается вниз (примеры: человек садится из положения стоя или спускается вниз по
лестнице). Следует подчеркнуть, что в подобных условиях удлинение мышечных волокон не активный процесс, осуществляемый сократительными белками, а результат действия на мышцу внешней силы. При отсутствии внешней силы, удлиняющей мышцу, волокно при его стимуляции будет только укорачиваться,но не удлиняться. Все три типа сокращения (изометрическое, изотоническое и эксцентрическое) - это естественные события повседневной деятельности.
При каждом типе сокращения поперечные мостики ритмически повторяют цикл, состоящий из четырех стадий. На 2-й стадии изотонического сокращения поперечные мостики, связанные с актином, совершают вращательное движение, заставляя саркомеры укорачиваться. По-другому происходит при изометрическом сокращении: изза нагрузки, действующей на мышцу, связанные с актином поперечные мостики не могут сдвинуть тонкие филаменты, но передают им силу - изометрическое напряжение. Во время 2-й стадии эксцентрического сокращения поперечные мостики испытывают действие нагрузки, которая тянет их назад к Z-пластинке, при этом они остаются прикрепленными к актину и развивают усилие. Стадии 1, 3 и 4 проходят одинаково при всех трех типах сокращений. Таким образом, при каждом типе сокращения сократительные белки претерпевают одинаковые химические изменения. Конечный результат (укорочение, отсутствие изменений длины или удлинение) определяется величиной нагрузки на мышцу.
На рисунке 4-16 В показана зависимость «длина-tension» при изометрическом сокращении, а на рис. 4-16 Г только «активный» фрагмент этой зависимости, т.е. разница между «пассивной» кривой и общей кривой. Далее показаны (рис. 4-16 Д) характерные кривые, отражающие зависимость «нагрузка-скорость».
Рис. 4-16. Изометрическое и изотоническое сокращение.
А - экспериментальный препарат для изучения мышечных сокращений в изометрических условиях. Б - экспериментальный препарат для изучения мышечных сокращений в изотонических условиях. В - пассивная кривая, демонстрирующая мышечное напряжение (tension),которое измеряется при различных длинах мышцы перед сокращением. Суммарная кривая, демонстрирующая мышечное напряжение(tension), которая измеряется при различных длинах мышцы в течение сокращения. Г - активное мышечное напряжение (active tension)представляет собой разницу между суммарным и пассивным мышечным напряжением на панели (С). Д - три кривые голубого цвета показывают, что скорость укорочения мышцы быстрее, если мышца натянута массой

Опорно-двигательный аппарат
Сокращающаяся мышца передает усилие костям через сухожилия. Если усилие достаточно, то при укорочении мышцы кости перемещаются. При сокращении мышца развивает только тянущее усилие, так что кости, к которым она прикреплена, по мере ее укорочения подтягиваются друг к другу. При этом может происходить сгибаниеконечности в суставе (флексия) или разгибание(экстензия) - выпрямление конечности (рис. 4- 17 А). В этих противоположно направленных движениях должны участвовать, по крайней мере, две разные мышцы - сгибатель и разгибатель. Мышечные группы, осуществляющие движения сустава в противоположных направлениях, называют антагонистами.Как показано на рис. 4-17 А, при сокращении двуглавой мышцы плеча (m. biceps) рука сгибается в локтевом суставе, тогда как сокращение мышцы-антагониста - трехглавой мышцы плеча (m. triceps) заставляет руку разгибаться. Обе мышцы создают при сокращении только тянущее усилие по отношению к предплечью.
Группы мышц-антагонистов необходимы не только для сгибания и разгибания, но и для движения конечностей в стороны или для вращения. Некоторые мышцы при сокращении могут создавать два типа движения в зависимости от сократительной активности других мышц, действующих на ту же конечность. Например, при сокращении икроножной мышцы (m. gastrocnemius) нога сгибается в колене, например, во время ходьбы (рис. 4-17 Б). Однако, если икроножная мышца сокращается одновременно с четырехглавой мышцей бедра (m. quadriceps femoris), которая выпрямляет ногу в голени, коленный сустав не может согнуться, так что движение возможно только в голеностопном суставе. Происходит разгибание стопы, т.е. человек приподнимается на кончиках пальцев ног - «встает на цыпочки».
Мышцы, кости и суставы тела представляют собой системы рычагов. Принцип действия рычага можно проиллюстрировать на примере сгибания предплечья (рис. 4-17 В): двуглавая мышца оказывает тянущее усилие, направленное вверх, на участок предплечья примерно на расстоянии 5 см от локтевого сустава. В рассматриваемом примере кисть руки удерживает нагрузку 10 кг, т.е. на расстоянии примерно 35 см от локтя действует направленная вниз сила величиной 10 кг. Согласно законам физики, предплечье находится в состоянии механического равновесия (т.е. суммарная сила, действующая на систему, равна нулю), когда произведение направленной вниз силы (10 кг) на расстояние от места ее приложения до локтя (35 см) равно произведению изометрического напряжения мышцы (Х) на расстояние от нее до локтя (5 см). Итак, 10х35=5хХ; отсюда Х=70 кг. Отметим, что работа этой системы механически невыгодна, поскольку сила, развиваемая мышцей, гораздо больше, чем масса удерживаемой нагрузки (10 кг).
Однако механически невыгодные условия работы большинства механизмов мышечных рычагов компенсируются за счет повышения маневренности. На рисунке 4-17 показано, что укорочению двуглавой мышцы на 1 см соответствует перемещение кисти на расстояние 7 см. Поскольку укорочение мышцы на 1 см и перемещение кисти на 7 см совершаются за одно и то же время, скорость движения кисти в семь раз больше, чем скорость укорочения мышцы. Система рычагов играет роль усилителя, благодаря которому небольшие относительно медленные движения двуглавой мышцы преобразуются в более быстрые движения кисти. Так мяч, брошенный подающим игроком баскетбольной команды, летит со скоростью 90-100 миль/ч (примерно 150-160 км/ч), хотя мышцы игрока укорачиваются во много раз медленнее.
Рис. 4-17. Мышцы и кости действуют как система рычагов.
А - мышцы-антагонисты, осуществляющие сгибание и разгибание предплечья. Б - сокращение икроножной мышцы приводит к сгибанию нижней конечности, когда четырехглавая мышца бедра расслаблена, или к разгибанию, когда последняя сокращается, не позволяя коленному суставу сгибаться. В - механическое равновесие сил, действующих на предплечье, когда рука держит груз 10 кг. Г - рычажная система руки действует как усилитель по отношению к скорости сокращения двуглавой мышцы плеча, увеличивая скорость перемещения кисти. Система является также усилителем диапазона перемещений кисти (при укорочении мышцы на 1 см кисть перемещается на 7 см)
Нервно-мышечное соединение
Сигналом длязапускасокращения служит потенциал действия плазматической мембраны волокна скелетной мышцы. В скелетных мышцах потенциалы действия можно вызвать только одним способом - раздражением нервных волокон.
Волокна скелетных мышц иннервируются аксонами нервных клеток, называемых мотонейронами(или соматическими эфферентными нейронами). Тела этих клеток расположены в стволе мозга или в спинном мозге. Аксоны мотонейронов покрыты миелиновой оболочкой, а их диаметр больше, чем у других аксонов, поэтому они проводят потенциалы действия с высокой скоростью, обеспечивая поступление сигналов из ЦНС к волокнам скелетных мышц лишь с минимальной задержкой.
Войдя в мышцу, аксон мотонейрона разделяется на множество ветвей, каждая из которых образует одно соединение с мышечным волокном. Один мотонейрон иннервирует много мышечных волокон, но каждым мышечным волокном управляет ветвь только от одного мотонейрона. Мотонейрон вместе с мышечными волокнами, которые он иннервирует, составляет двигательную единицу.Мышечные волокна одной двигательной единицы находятся в одной и той же мышце, но не в виде компактной группы, а рассеяны по мышце. Когда в мотонейроне возникает потенциал действия, все мышечные волокна его двигательной единицы получают стимул к сокращению.
При подходе аксона к поверхности мышечного волокна миелиновая оболочка заканчивается, и аксон образует терминальную часть (нервное окончание) в виде нескольких коротких отростков, располагающихся в желобках на поверхности мышечного волокна. Область плазматической мембраны мышечного волокна, лежащая непосредственно под нервным окончанием, обладает особыми свойствами и называется двигательной концевой пластинкой.Структура, состоящая из нервного окончания и двигательной концевой пластинки, известна как нервно-мышечное соединение(нервно-мышечный синапс).
Терминали аксонов мотонейрона (двигательные нервные окончания) содержат везикулы, заполненные АЦХ. Поступающий от мотонейрона потенциал действия деполяризует плазматическую мембрану нервного окончания, вследствие чего открываются потенциалуправляемые Са2+-каналы, и в нервное окончание входит Са2+ из внеклеточной среды. Ионы Са2+ связываются с белками,
обеспечивающими слияние мембраны везикул с плазматической мембраной нервного окончания, и происходит освобождение АЦХ в синаптическую щель, разделяющую нервное окончание и двигательную концевую пластинку. Молекулы АЦХ диффундируют от нервного окончания к двигательной концевой пластинке, где они связываются с ацетилхолиновыми рецепторами никотинового типа, при этом открываются ионные каналы, проницаемые как для Na+, так и для K+. Из-за разницы трансмембранных электрохимических градиентов этих ионов, входящий в мышечное волокно поток Na+ больше, чем выходящий поток К+, благодаря чему возникает местная деполяризация двигательной концевой пластинки - потенциал концевой пластинки(ПКП). ПКП аналогичен ВПСП в межнейронных синапсах. Однако амплитуда одиночного ПКП существенно выше, чем амплитуда ВПСП, потому что в нервно-мышечном соединении высвобождаемый нейромедиатор попадает на более обширную поверхность, где он связывается с гораздо большим количеством рецепторов, и где, следовательно, открывается намного больше ионных каналов. По этой причине амплитуда одиночного ПКП обычно бывает более чем достаточной для того, чтобы в смежной с концевой пластинкой области плазматической мышечной мембраны возник местный электрический ток, инициирующий потенциал действия. Затем потенциал действия распространяется по поверхности мышечного волокна посредством такого же механизма, что и в мембране аксона. Большинство нервно-мышечных соединений расположено в срединной части мышечного волокна, откуда возникший потенциал действия распространяется к обоим концам волокна. В скелетной мышце человека никогда не возникают тормозные потенциалы. Все нервномышечные соединения - возбуждающие.
Наряду с рецепторами АЦХ на двигательной концевой пластинке присутствует фермент ацетихолинэстераза(АЦХ-эстераза), которая расщепляет АЦХ. По мере того как концентрация свободного АЦХ снижается вследствие его расщепления АЦХ-эстеразой, уменьшается количество АЦХ, способного связываться с рецепторами. Когда не остается рецепторов, связанных с АЦХ, ионные каналы концевой пластинки становятся закрытыми. Деполяризация концевой пластинки завершается, мембранный потенциал возвращается к уровню покоя, и концевая пластинка вновь способна отвечать на АЦХ, высвобождаемый при поступлении к нервному окончанию следующего потенциала действия.
Рис. 4-18. Возбуждение мембраны мышечного волокна: нервно-мышечное соединение

Электромеханическое сопряжение
Ранние исследования изолированного сердца позволили обнаружить, что для сокращения сердечной мышцы необходимы оптимальные концентрации Na+, K+ и Ca2+. Без Na+ сердце невозбудимо, оно не станет биться, так как потенциал действия зависит от внеклеточных ионов натрия. Напротив, потенциал покоящейся мембраны не зависит от трансмембранного градиента ионов Na+. В нормальных условиях внеклеточная концентрация K+ составляет около 4 мМ. Снижение концентрации внеклеточного K+ не оказывает большого влияния на возбуждение и сокращение сердечной мышцы. Однако увеличение концентрации внеклеточного K+ до достаточно высоких уровней вызывает деполяризацию, потерю возбудимости клеток миокарда и остановку сердца в диастоле. Ca2+ также существенно важен для сердечных сокращений. Удаление Ca2+ из внеклеточной жидкости приводит к уменьшению силы сердечных сокращений и последующей остановке сердца в диастоле. Напротив, увеличение концентрации внеклеточного Ca2+ усиливает сердечные сокращения, а очень высокие концентрации Ca2+ приводят к остановке сердца в систоле. Свободный внутриклеточный Ca2+ служит ионом, отвечающим за сократительную способность миокарда.
На двух панелях рисунка показаны механизмы электромеханического сопряжения в сердце, описанные ниже. Возбуждение сердечной мышцы начинается, когда волна возбуждения быстро распространяется вдоль сарколеммы клеток миокарда от клетки к клетке через щелевые контакты. Возбуждение также распространяется внутрь клеток через поперечные трубки, которые инвагинированы в сердечные волокна на Z-полосах. Электростимуляция в области Z-по- лосы или аппликация ионизированного Са2+ в области Z-полосы сердечных волокон, освобожденных от оболочки (с удаленными сарколеммами), вызывает локальное сокращение соседних миофибрилл. Во время плато потенциала действия повышается проницаемость сарколеммы для Са2+. Са2+ входит в клетку по его электрохимическому градиенту через кальциевые каналы сарколеммы и ее инвагинаций, т.е. через мембраны Т-системы.
Считается, что открытие кальциевых каналов происходит в результате фосфорилирования протеинов каналов с помощью циклической аденозинмонофосфатзависимой протеинкиназы (цАМФзависимой протеинкиназы). Первоначальным источником внеклеточного Са2+служит интерстициальная жидкость (10-3 М Са2+). Некоторое
количество Са2+ может также быть связано с сарколеммой и с гликокаликсом,мукополисахаридом, покрывающим сарколемму. Количество кальция, попадающего внутрь клетки из внеклеточного пространства, недостаточно для того, чтобы вызвать сокращение миофибрилл. Вошедший внутрь кальций («запускающий или триггерный» Са2+) запускает высвобождение Са2+ из саркоплазматического ретикулума (где есть запас внутриклеточного Са2+). Концентрация свободного Са2+ в цитоплазме возрастает от уровня покоя (resting level) примерно в 10-7 М до уровней от 10-6 до 10-5 М во время возбуждения. Затем Са2+ связывается с белком тропонином С. Кальциево-тропониновый комплекс взаимодействует с тропомиозином, чтобы снять блок с активных участков между актиновыми и миозиновыми филаментами. Это снятие блока позволяет образовываться циклическим поперечным связям между актином и миозином и, следовательно, позволяет миофибриллам сокращаться.
Механизмы, повышающие концентрацию Са2+ в цитозоли, увеличивают развиваемую силу сердечных сокращений (active force), а механизмы, которые снижают концентрацию Са2+ в цитозоли, уменьшают ее. Например, катехоламины увеличивают поступление Са2+в клетку путем фосфорилирования каналов через цАМФ-зависимую протеинкиназу. К тому же катехоламины, подобно другим агонистам, увеличивают силу сердечных сокращений путем повышения чувствительности сократительного механизма к Са2+. Повышение концентрации внеклеточного Са2+ или уменьшение градиента Na+ через сарколемму также приводит к увеличению концентрации Са2+ в цитозоле.
Градиент натрия может быть понижен путем увеличения внутриклеточной концентрации Na+ или путем понижения внеклеточной концентрации Na+. Сердечные гликозиды повышают внутриклеточную концентрацию Na+ путем «отравления» Na+/К+-АТФазы, что приводит к аккумуляции Na+ в клетках. Повышение концентрации Na+ в цитозоле изменяет направление Na+/Са2+-обменника (Na+/Ca2+-exchanger) на противоположное, так что из клетки удаляется меньше Са2+. Пониженная концентрация внеклеточного Na+ служит причиной того, что меньше Na+ входит в клетку, и, таким образом, меньше Na+ заменяется на Са2+.
Достигнутое механическое напряжение (tension) уменьшается за счет снижения концентрации внеклеточного Са2+, увеличения трансмембранного градиента Na+ или применения блокаторов Са2+- каналов, которые препятствуют входу Са2+ в клетки миокарда.
Рис. 4-19. Электромеханическое сопряжение в сердце
Физиология гладких мышц
Гладкое мышечное волокно - это веретеновидная клетка диаметром от 2 до 10 мкм. В отличие от многоядерных волокон скелетных мышц, которые после завершения дифференцировки уже не могут делиться, гладкие мышечные волокна обладают единственным ядром и способны к делению на протяжении всей жизни организма. Деление начинается в ответ на разнообразные паракринные сигналы, часто - на повреждение ткани.
Значительное разнообразие факторов, модифицирующих сократительную деятельность гладких мышц различных органов, затрудняет классификацию гладких мышечных волокон. Однако есть общий принцип, основанный на электрических характеристиках плазматической мембраны. В соответствии с этим принципом большинство гладких мышц можно отнести к одному из двух типов:унитарные гладкие мышцы(single-unit smooth muscles) с волокнами, связанными в единое целое (рис. 4-20 А), клетки которых взаимодействуют через gap junction, и мультиунитарные гладкие мышцы(multiunit smooth muscles) с индивидуальной иннервацией волокон (рис. 4-20 Б).
Унитарные гладкие мышцы
В мышцах этого типа активность (электрическая и механическая) осуществляется разными клетками синхронно, т.е. на стимулы мышца реагирует как единое целое. Это обусловлено тем, что мышечные волокна связаны друг с другом gap junction (щелевыми контактами), через которые потенциал действия может посредством локальных токов распространяться от одной клетки в соседние. Таким образом, электрическая активность, возникшая в любой клетке унитарных гладких мышц, передается ко всем волокнам (рис. 4-20 А).
Некоторые волокна унитарных гладких мышц обладают пейсмекерными свойствами. В них спонтанно возникают потенциалы действия, которые проводятся через gap junction к волокнам, не обладающим такой активностью. Большинство клеток унитарных гладких мышц не являются пейсмекерными.
На сократительную активность унитарных гладких мышц оказывают влияние электрическая активность нервов, гормоны, локальные факторы;
эти влияния опосредуются механизмами, рассмотренными выше применительно к деятельности всей гладкой мускулатуры. Характер иннервации унитарных гладких мышц существенно варьирует в разных органах. Во многих случаях нервные окончания сосредоточены в тех областях мышцы, где находятся пейсмекерные клетки. Активность всей мышцы может регулироваться посредством изменений частоты потенциалов действия пейсмекерных клеток.
Еще одна особенность унитарных гладких мышц состоит в том, что часто ее волокна сокращаются в ответ на растяжение. Сокращения возникают при растяжении стенок многих полых органов (например, матки), когда возрастает объем их внутреннего содержимого.
Примеры унитарных гладких мышц: мышцы стенок желудочно-кишечного тракта, матки, тонких кровеносных сосудов.
Мультиунитарные гладкие мышцы
Между клетками мультиунитарных гладких мышц мало gap junction, каждое волокно действует независимо от соседних, и мышца ведет себя как множество самостоятельных элементов. Мультиунитарные гладкие мышцы обильно снабжены ветвлениями вегетативных нервов (рис. 4-20 Б). Общий ответ всей мышцы зависит от количества активированных волокон и от частоты нервных импульсов. Хотя поступающие нервные импульсы сопровождаются деполяризацией и сократительными ответами волокон, потенциалы действия в мультиунитарных гладких мышцах, как правило, не генерируются. Сократительная активность мультиунитарных гладких мышц усиливается либо ослабевает в результате поступления с кровью гормонов, однако мультиунитарные гладкие мышцы не сокращаются при растяжении. Примеры мультиунитарных гладких мышц: мышцы в стенках бронхов и крупных артерий и др.
Следует подчеркнуть, что большинство гладких мышц не обладают свойствами исключительно унитарных либо мультиунитарных гладких мышц. В действительности существует непрерывное множество вариаций гладких мышц с разными сочетаниями свойств того и другого типа; унитарные гладкие мышцы и мультиунитарные гладкие мышцы - это две крайности.
Рис. 4-20. Структура гладких мышц

Потенциалы гладких мышц
Некоторые типы гладких мышечных волокон генерируют потенциалы действия спонтанно, при отсутствии всякого нейрогенного или гормонального воздействия. Потенциал покоя плазматической мембраны таких волокон не поддерживается на постоянном уровне, а подвергается постепенной деполяризации до тех пор, пока он не достигнет порогового уровня и не произойдет генерирование потенциала действия. После реполяризации мембраны вновь начинается ее деполяризация (рис. 4-21), так что возникает серия потенциалов действия, вызывающая тоническую сократительную активность. Спонтанные сдвиги потенциала, деполяризующие мембрану до порогового уровня, называются пейсмекерными потенциалами.(Как показано в других главах, часть волокон сердечной мышцы и некоторые типы нейронов ЦНС тоже обладают пейсмекерными потенциалами и могут спонтанно генерировать потенциалы действия при отсутствии внешних стимулов).
Интересно, что в гладких мышцах, способных к генерированию потенциалов действия, переносчиками положительных зарядов в клетку в фазу нарастания потенциала действия служат ионы Са2+, а не Na+, т.е. при деполяризации мембраны открываются потенциалзависимые кальциевые каналы, и потенциалы действия в гладкой мускулатуре имеют кальциевую природу, а не натриевую.
В отличие от поперечно-полосатой мышцы, в гладкой мышце цитоплазматическая концентра-
ция Са2+ может увеличиваться (или уменьшаться) в результате градуальныхдеполяризационных (или гиперполяризационных) сдвигов мембранного потенциала, увеличивающих (или уменьшающих) число открытых кальциевых каналов плазматической мембраны.
Какую роль в электромеханическом сопряжении играет внеклеточный Са2+? В плазматической мембране гладких мышечных клеток находятся кальциевые каналы двух типов - потенциалзависимые и управляемые химическими посредниками. Поскольку концентрация Са2+ во внеклеточной жидкости в 10 000 раз выше, чем в цитоплазме, открывание кальциевых каналов плазматической мембраны сопровождается входом Са2+ в клетку. Благодаря небольшим размерам волокна, вошедшие ионы Са2+ быстро достигают путем диффузии внутриклеточных участков связывания.
Еще одно различие заключается в том, что если в скелетной мышце одиночный потенциал действия высвобождает достаточное количество Са2+ для включения всех поперечных мостиков волокна, то в гладкой мышце в ответ на большинство стимулов активируется только часть поперечных мостиков. Именно поэтому, гладкое мышечное волокно генерирует напряжение постепенно, по мере изменения цитоплазматической концентрации Са2+. Чем значительнее прирост концентрации Са2+, тем большее число поперечных мостиков активируется, и тем больше генерируемое напряжение.
Рис. 4-21. Электрические потенциалы гладких мышц

Источники поступления кальция в цитоплазму
Повышение концентрации Са2+ в цитоплазме, благодаря чему инициируется сокращение гладкой мышцы, обеспечивается из двух источников: (1) саркоплазматического ретикулума и (2) внеклеточной среды, из которой Са2+ входит в клетку через кальциевые каналы плазматической мембраны. Относительный вклад этих двух источников Са2+ варьирует для разных гладких мышц. Некоторые из них в большей мере зависят от внеклеточной концентрации Са2+, другие - от Са2+, депонированного в саркоплазматическом ретикулуме.
Саркоплазматический ретикулум гладких мышц
Что касается саркоплазматического ретикулума, то в гладкой мышце он развит слабее, чем в скелетной мышце, и не имеет специфической организации, которая коррелировала бы с расположением толстых и тонких филаментов (рис. 4- 22 А). Кроме того, в гладкой мышце отсутствуют Т-трубочки, соединенные с плазматической мембраной. Поскольку диаметр гладкого мышечного волокна невелик, а сокращение развивается медленно, нет функциональной необходимости в быстром распространении возбуждающего сигнала вглубь волокна. Вместе с тем между участками плазматической мембраны и саркоплазматического ретикулума наблюдаются особые структуры,
аналогичные специализированным контактам между мембранами Т-трубочек и латеральных мешков в поперечно-полосатых волокнах. Эти структуры осуществляют сопряжение между потенциалом действия плазматической мембраны и высвобождением Са2+ из саркоплазматического ретикулума. В инициации высвобождения Са2+ из областей саркоплазматического ретикулума, находящихся в центре волокна, участвуют вторичные посредники, высвобождаемые плазматической мембраной или образующиеся в цитоплазме в ответ на связывание внеклеточных химических медиаторов с рецепторами плазматической мембраны (рис. 4-22 В).
В некоторых гладких мышцах концентрация Са2+ достаточна для поддержания активности поперечных мостиков на определенном низком уровне даже при отсутствии внешних стимулов. Такое явление носит название тонус гладкой мускулатуры.Интенсивность тонуса изменяют факторы, воздействующие на цитоплазматическую концентрацию Са2+.
Удаление Са2+ из цитоплазмы, необходимое для того, чтобы волокно расслабилось, происходит посредством активного транспорта Са2+ обратно в саркоплазматический ретикулум, а также через плазматическую мембрану во внеклеточную среду. Скорость удаления Са2+ в гладкой мышце гораздо меньше, чем в скелетной. Отсюда и разная продолжительность одиночного сокращения - несколько секунд для гладкой мышцы и доли секунды для скелетной.
Механизмы обмена кальцием представлены на
рис. 4-22 Г.
Рис. 4-22. Саркоплазматический ретикулyм гладких мышц.
А - структура саркоплазматического ретикулума. Б - источники поступления кальция через ионные каналы. В - источники поступления кальция через насосы и обменники
Сокращения гладких мышц
В цитоплазме гладких мышечных волокон присутствуют два вида филаментов: толстые миозинсодержащие и тонкие актинсодержащие. Тонкие филаменты прикреплены либо к плазматической мембране, либо к цитоплазматическим структурам - так называемым плотным тельцам(функциональные аналоги Z-полос поперечно-полосатых волокон). В расслабленном гладком мышечном волокне филаменты обоего вида ориентированы под косым углом к длинной оси клетки. Во время укорочения волокна участки плазматической мембраны, находящиеся между точками прикрепления актина, выбухают. Толстые и тонкие филаменты не объединены в миофибриллы, как в поперечно-полосатых мышцах, и не образуют регулярно повторяющихся саркомеров, поэтому не наблюдается поперечная исчерченность. Тем не менее сокращение гладких мышц происходит посредством механизма скользящих нитей.
Концентрация миозина в гладкой мышце составляет лишь около одной трети от его содержания в поперечно-полосатой мышце, в то время как содержание актина может быть в два раза больше. Несмотря на эти различия, максимальное напряжение на единицу площади поперечного сечения, развиваемое гладкими и скелетными мышцами, схоже.
Соотношение между изометрическим напряжением и длиной для гладких мышечных волокон количественно такое же, как для волокон скелетной мышцы. При оптимальной длине волокна развивается максимальное напряжение, а при сдвигах длины в обе стороны от ее оптимального значения напряжение уменьшается. Однако гладкая мышца, по сравнению со скелетной мышцей, способна развивать напряжение в более широком диапазоне значений длины. Это важное адаптационное свойство, если учесть, что большинство гладких мышц входит в состав стенок полых органов, при изменении объема которых меняется и длина мышечных волокон. Даже при относительно большом увеличении объема, как, например, при заполнении мочевого пузыря, гладкие мышечные волокна в его стенках сохраняют в определенной мере способность к развитию напряжения; в поперечно-полосатых волокнах подобное растяжение могло бы привести к расхождению толстых и тонких филаментов за пределы зоны их перекрывания.
Так же как в поперечно-полосатой мышце, в гладких мышечных волокнах сократительная активность регулируется изменениями цитоплазматической концентрации ионов Са2+. Однако эти два типа мышц существенно различаются по механизму влияния Са2+ на активность поперечных мостиков и изменений концентрации Са2+ в ответ на стимуляцию.
Рис. 4-23. В гладкой мышце толстые и тонкие филаменты ориентированы под углом к осям волокна и прикреплены к плазматической мембране или к плотным тельцам в цитоплазме. При активации мышечных клеток толстые и тонкие филаменты скользят друг относительно друга так, что клетки укорачиваются и утолщаются

Активация поперечных мостиков
В тонких филаментах гладких мышц нет связывающего Са2+-белка тропонина С, который опосредует триггерную роль Са2+ по отношению к активности поперечных мостиков в скелетной мышце и в миокарде. Вместо этого цикл поперечных мостиков в гладкой мышце контролируется Са2+-регулируемым ферментом, фосфорилирующим миозин. Только фосфорилированная форма миозина в гладкой мышце может связываться с актином и обеспечивать циклы движений поперечных мостиков.
Рассмотрим процесс сокращения гладкой мышцы в деталях. Увеличение уровня Са2+ в цитоплазме инициирует медленную цепь событий, приводящих, с одной стороны, к освобождению активного центра связывания с миозином на актине и, с другой стороны, к увеличению активности АТФазы миозина, и без этого увеличения активности АТФазы миозина в гладкой мышце сокращение не может начаться.
Первая фаза процесса активации головки миозина заключается в связывании 4 ионов Са2+ с кальмодулином(СаМ), который в этом смысле очень похож на тропонин С поперечно-полосатой мышцы. Далее комплекс Са2+-СаМ активирует фермент, называемый киназой легкой цепи миозина(КЛЦМ) (myosin light chain kinase, MLCK). КЛЦМ содержит АТФ-связывающий домен и активный центр, обеспечивающий перенос фосфата с АТФ на белок-акцептор. По этому механизму КЛЦМ, в свою очередь, фосфорилирует легкую регуляторную цепь, ассоциированную с головкой молекулы миозина II. Фосфорилирование легкой цепи меняет конформацию головки миозина II, которая достаточно изменена увеличением своей АТФазной активности, что и позволяет ей взаимодействовать с актином. То есть система работает как молекулярный мотор (рис. 4-23 А).
На рисунке 4-23 Б представлены два независимых каскада, приводящих к сокращению гладкой мышцы. Каскад (1) включает механизм освобождения от блокирования активного центра актина, с которым должен связаться миозин. Каскад (2) включает механизм активации головки миозина. Итог этих двух каскадов состоит в формировании актомиозинового комплекса.
Рассмотрим первый каскад освобождения от блокирования активного центра актина. Два белка, кальдесмон и кальпомин, блокируют возможность связи актина с миозином. Оба представляют собой Са2+-СаМ, связывающие протеины, и оба связывают актин. С одной стороны, Са2+ связывается с СаМ, и комплекс Са2+-СаМ действует двояко на кальпонин. Первый эффект - комплекс Са2+-СаМ связывается с кальпонином. Второй эффект - комплекс Са2+-СаМ активирует Са2+-СаМ-зависимую протеинкиназу, которая фосфорилирует кальпонин. Оба эффекта уменьшают ингибирование кальпонином АТФазной
активности миозина. Кальдесмон также ингибирует АТФазную активность миозина гладкой мышцы. С другой стороны, Са2+ связывается с СаМ, а комплекс Са2+-СаМ связывается через Pi с кальдесмоном, что сдвигает последний от центра связывания актина с миозином. Центр связывания на актине открывается.
Рассмотрим второй каскад, который представлен на панели А. Первая фаза процесса активации головки миозина заключается в связывании четырех ионов Са2+ с СаМ. Сформировавшийся комплекс Са2+-СаМ активирует КЛЦМ. КЛЦМ фосфорилирует легкую регуляторную цепь, ассоциированную с головкой молекулы миозина II. Фосфорилирование легкой цепи меняет конформацию головки миозина II, которая достаточно изменена увеличением своей АТФазной активности, что и позволяет ей взаимодействовать с актином.
В итоге актомиозиновый комплекс оказывается сформированным.
Гладкомышечная изоформа АТФазы миозина характеризуется очень низкой максимальной активностью, примерно в 10-100 раз ниже, чем активность АТФазы миозина скелетной мышцы. Поскольку от скорости гидролиза АТФ зависит скорость циклических движений поперечных мостиков и соответственно скорость укорочения, гладкая мышца сокращается гораздо медленнее, чем скелетная. Кроме того, гладкая мышца не утомляется во время продолжительной активности.
Чтобы после сокращения гладкая мышца расслабилась, необходимо дефосфорилирование миозина, так как дефосфорилированный миозин не может быть связан с актином. Этот процесс катализируется фосфатазой легких цепей миозина, активной в течение всего времени покоя и сокращения гладкой мышцы. При повышении цитоплазматической концентрации Са2+ скорость фосфорилирования миозина активной киназой становится выше, чем скорость его дефосфорилирования фосфатазой, и количество фосфорилированного миозина в клетке возрастает, обеспечивая развитие напряжения. Когда концентрация Са2+ в цитоплазме снижается, скорость дефосфорилирования становится выше, чем скорость фосфорилирования, количество фосфорилированного миозина падает, и гладкая мышца расслабляется.
При сохранении повышенного уровня цитоплазматического Са2+ скорость гидролиза АТФ миозином поперечных мостиков падает, несмотря на сохраняющееся изометрическое напряжение. Если фосфорилированный поперечный мостик, прикрепленный к актину, подвергается дефосфорилированию, он окажется в состоянии стойкого ригидного напряжения, оставаясь неподвижным. Когда такие дефосфорилированные поперечные мостики связываются с АТФ, они диссоциируют от актина гораздо медленнее. Таким образом, обеспечивается способность гладкой мышцы длительно поддерживать напряжение при невысоком потреблении АТФ.

Глава 5. Нервная система
Отделы ЦНС
У ЦНС много функций. Она собирает и перерабатывает поступающую от ПНС информацию об окружающей среде, формирует рефлексы и другие поведенческие реакции, планирует (подготавливает) и осуществляет произвольные движения.
Кроме того, ЦНС обеспечивает, так называемые, высшие познавательные (когнитивные) функции. В ЦНС происходят процессы, связанные с памятью, обучаемостью и мышлением. ЦНС включает спинной мозг (medulla spinalis) и головной мозг (encephalon)(рис. 5-1). Спинной мозг подразделяется на последовательные отделы (шейный, грудной, поясничный, крестцовый и копчиковый), каждый из которых состоит из сегментов.
На основе сведений о закономерностях эмбрионального развития головной мозг подразделяют на пять отделов: myelencephalon(продолговатый мозг), metencephalon (задний мозг), mesencephalon (средний мозг), diencephalon (промежуточный мозг) иtelencephalon (конечный мозг). В головном мозге взрослого myelencephalon (продолговатый мозг)
включает продолговатый мозг (medulla oblongata, от medulla), metencephalon (задний мозг) - варолиев мост (pons Varolii) и мозжечок(cerebellum);mesencephalon (средний мозг) - midbrain; diencephalon (промежуточный мозг) - таламус (thalamus) и гипоталамус(hypothalamus), telencephalon (конечный мозг) - базальные ядра (nuclei basales) и кору большого мозга (cortex cerebri) (рис. 5-1 Б). В свою очередь, кора каждого полушария состоит из долей, которые названы так же, как соответствующие кости черепа: лобная (lobus frontalis), теменная (l. parietalis), височная (l. temporalis) и затылочная (l. occipitalis) доли. Полушариясоединены мозолистым телом (corpus callosum) - массивным пучком аксонов, пересекающих среднюю линию между полушариями.
На поверхности ЦНС лежат несколько слоев соединительной ткани. Это мозговые оболочки: мягкая(pia mater), паутинная(arachnoidea mater) и твердая (dura mater). Они защищают ЦНС. Подпаутинное (субарахноидальное)пространство между мягкой и паутинной оболочками заполнено цереброспинальной (спинно-мозговой) жидкостью (ЦСЖ).
Рис. 5-1. Строение центральной нервной системы.
А -головной и спинной мозг со спинальными нервами. Обратите внимание на относительные размеры компонентов центральной нервной системы. C1, Th1, L1 и S1 - первые позвонки шейных, грудных, поясничных и крестцовых отделов соответственно. Б - основные компоненты центральной нервной системы. Показаны также четыре главные доли коры больших полушарий: затылочная, теменная, лобная и височная

Отделы головного мозга
Основные структуры головного мозга представлены на рис. 5-2 А. В ткани головного мозга есть полости - желудочки,заполненные ЦСЖ (рис. 5-2 Б, В). ЦСЖ оказывает амортизирующее действие и регулирует внеклеточную среду около нейронов. ЦСЖ образуется главным образом сосудистыми сплетениями,которые выстланы специализированными клетками эпендимы. Сосудистые сплетения находятся в боковых, третьем и четвертом желудочках. Боковые желудочкирасположены по одному в каждом из двух больших полушарий мозга. Они соединяются с третьим желудочкомчерез межжелудочковые отверстия (монроевы отверстия).Третий желудочек лежит на средней линии между двумя половинами промежуточного мозга. Он соединен с четвертым желудочкомпосредством водопровода мозга (сильвиев водопровод),пронизывающего средний мозг. «Дно» четвертого желудочка образуют мост и продолговатый мозг, а «крышу» - мозжечок. Продолжением четвертого желудочка в каудальном направлении являетсяцентральный каналспинного мозга, обычно закрытый у взрослого человека.
ЦСЖ поступает из желудочков моста в субарахноидальное (подпаутинное) пространствочерез три отверстия в крыше четвертого желудочка: срединную апертуру(отверстие Мажанди) и две латеральные апертуры(отверстия Лушки). Вышедшая из системы желудочков ЦСЖ циркулирует в субарахноидальном пространстве, окружающем головной и спинной мозг. Расширения этого пространства названы субарахноидальными (подпаутинными)
цистернами.Одна из них - люмбальная (поясничная) цистерна,из которой получают путем люмбальной пункции пробы ЦСЖ для клинических анализов. Значительная часть ЦСЖ всасывается через снабженные клапанами арахноидальные ворсинкив венозные синусы твердой мозговой оболочки.
Общий объем ЦСЖ в желудочках мозга - примерно 35 мл, тогда как подпаутинное пространство содержит около 100 мл. Каждую минуту образуется примерно 0,35 мл ЦСЖ. При такой скорости обновление ЦСЖ происходит приблизительно четыре раза в сутки.
У человека в положении лежа давление ЦСЖ в спинно-мозговом субарахноидальном пространстве достигает 120-180 мм вод.ст. Скорость образования ЦСЖ относительно независима от давления в желудочках и в субарахноидальном пространстве, а также от системного кровяного давления. В то же время скорость обратного всасывания ЦСЖ прямо связана с давлением ЦСЖ.
Внеклеточная жидкость в ЦНС непосредственно сообщается с ЦСЖ. Следовательно, состав ЦСЖ влияет на состав внеклеточной среды вокруг нейронов головного и спинного мозга. Основные компоненты ЦСЖ в поясничной цистерне перечислены в табл. 5-1. Для сравнения приведены концентрации соответствующих веществ в крови. Как показано в данной таблице, содержание К+, глюкозы и белков в ЦСЖ ниже, чем в крови, а содержание Na+ и Cl- - выше. Кроме того, в ЦСЖ практически нет эритроцитов. Благодаря повышенному содержанию Na+ и Cl- обеспечивается изотоничность ЦСЖ и крови, несмотря на то, что в ЦСЖ относительно мало белков.
Таблица 5-1. Состав цереброспинальной жидкости и крови

Рис. 5-2. Головной мозг.
А - среднесагиттальный срез головного мозга. Обратите внимание на относительное расположение коры больших полушарий, мозжечка, таламуса и ствола мозга, а также различных комиссур. Б и В - система желудочков мозга in situ - вид сбоку (Б) и спереди (В)

Организация спинного мозга
Спинной мозглежит в позвоночном канале и у взрослых представляет собой длинный (45 см у мужчин и 41-42 см у женщин) несколько сплюснутый спереди назад цилиндрический тяж, который вверху (краниально) непосредственно переходит в продолговатый мозг, а внизу (каудально) оканчивается коническим заострением на уровне II поясничного позвонка. Знание этого факта имеет практическое значение (чтобы не повредить спинной мозг при поясничном проколе с целью взятия спинно-мозговой жидкости или с целью спинно-мозговой анестезии, надо вводить иглу шприца между остистыми отростками III и IV поясничных позвонков).
Спинной мозг на своем протяжении имеет два утолщения, соответствующих нервным корешкам верхней и нижней конечностей: верхнее из них называется шейным утолщением, а нижнее - поясничным. Из этих утолщений обширнее поясничное, но дифференцированнее шейное, что связано с более сложной иннервацией руки как органа труда.
В межпозвоночных отверстиях вблизи места соединения обоих корешков задний корешок имеет утолщение - спинно-мозговой узел(ganglion spinale), содержащий ложно-униполярные нервные клетки (афферентные нейроны) с одним отростком, который делится затем на две ветви. Одна из них, центральная, идет в составе заднего корешка в спинной мозг, а другая, периферическая, продолжается в спинно-мозговой нерв. Таким образом,
в спинно-мозговых узлах отсутствуют синапсы, так как здесь лежат клеточные тела только афферентных нейронов. Этим названные узлы отличаются от вегетативных узлов ПНС, так как в последних вступают в контакты вставочные и эфферентные нейроны.
Спинной мозг состоит из серого вещества, содержащего нервные клетки, и белого вещества, слагающегося из миелиновых нервных волокон.
Серое вещество образует две вертикальные колонны, помещенные в правой и левой половине спинного мозга. В середине его заложен узкий центральный канал, содержащий спинно-мозговую жидкость. Центральной канал представляет собой остаток полости первичной нервной трубки, поэтому вверху он сообщается с IV желудочком головного мозга.
Серое вещество, окружающее центральный канал, носит название промежуточного вещества. В каждой колонне серого вещества различают два столба: передний и задний. На поперечных разрезах эти столбы имеют вид рогов: переднего, расширенного, и заднего, заостренного.
Серое вещество состоит из нервных клеток, группирующихся в ядра, расположение которых в основном соответствует сегментарному строению спинного мозга и его первичной трехчленной рефлекторной дуге. Первый чувствительный нейрон этой дуги лежит в спинно-мозговых узлах, периферический отросток его идет в составе нервов к органам и тканям и связывается там с рецепторами, а центральный проникает в спинной мозг в составе задних чувствительных корешков.
Рис. 5-3. Спинной мозг.
А - нервные пути спинного мозга; Б - поперечный срез спинного мозга. Проводящие пути

Строение нейрона
Функциональная единица нервной системы - нейрон.Типичный нейрон обладает воспринимающей поверхностью в виде клеточного тела (сомы)и нескольких отростков - дендритов,на которых находятся синапсы,т.е. межнейронные контакты. Аксон нервной клетки образует синаптические связи с другими нейронами или с эффекторными клетками. Коммуникативные сети нервной системы складываются из нейронных цепей,образованных синаптически взаимосвязанными нейронами.
Сома
В соме нейронов находятся ядрои ядрышко(рис. 5-4), а также хорошо развитый аппарат биосинтеза, который производит компоненты мембран, синтезирует ферменты и другие химические соединения, необходимые для специализированных функций нервных клеток. К аппарату биосинтеза в нейронах относятся тельца Ниссля- плотно прилегающие друг к другу сплюснутые цистерны гранулярного эндоплазматического ретикулума, а также хорошо выраженный аппарат Гольджи.Кроме того, сома содержит многочисленныемитохондриии элементы цитоскелета, в том числе нейрофиламентыи микротрубочки.В результате неполной деградации мембранных компонентов образуется пигмент липофусцин,накапливающийся с возрастом в ряде нейронов. В некоторых группах нейронов ствола мозга (например, в нейронах черной субстанции и голубого пятна) заметен пигмент мелатонин.
Дендриты
Дендриты, выросты клеточного тела, у некоторых нейронов достигают длины более 1 мм, и на их долю приходится более 90% площади поверхности нейрона. В проксимальных частях дендритов (ближе к клеточному телу)
содержатся тельца Ниссля и участки аппарата Гольджи. Однако главные компоненты цитоплазмы дендритов - микротрубочки и нейрофиламенты. Было принято считать дендриты электрически не возбудимыми. Однако теперь известно, что дендриты многих нейронов обладают потенциалуправляемой проводимостью. Часто это обусловлено присутствием кальциевых каналов, при активации которых генерируются кальциевые потенциалы действия.
Аксон
Специализированный участок тела клетки (чаще сомы, но иногда - дендрита), от которого отходит аксон, называется аксонным холмиком.Аксон и аксонный холмик отличаются от сомы и проксимальных участков дендритов тем, что в них нет гранулярного эндоплазматического ретикулума, свободных рибосом и аппарата Гольджи. В аксоне присутствуют гладкий эндоплазматический ретикулум и выраженный цитоскелет.
Нейроны можно классифицировать по длине их аксонов. У нейронов 1-го типа по Гольджиаксоны короткие, оканчивающиеся, так же как дендриты, близко к соме. Нейроны 2-го типа по Гольджихарактеризуются длинными аксонами, иногда более 1 м.
Нейроны сообщаются друг с другом с помощью потенциалов действия,распространяющихся в нейронных цепях по аксонам. Потенциалы действия поступают от одного нейрона к следующему в результате синаптической передачи.В процессе передачи достигший пресинаптического окончанияпотенциал действия обычно запускает высвобождение нейромедиаторного вещества, которое либо возбуждает постсинаптическую клетку,так что в ней возникает разряд из одного или нескольких потенциалов действия, либо тормозитее активность. Аксоны не только передают информацию в нейронных цепях, но и доставляют путем аксонального транспорта химические вещества к синаптическим окончаниям.
Рис. 5-4. Схема «идеального» нейрона и его основных компонентов.
Большинство афферентных входов, поступающих по аксонам других клеток, оканчиваются синапсами на дендритах (Д), но некоторые - синапсами на соме. Возбуждающие нервные окончания чаще располагаются дистально на дендритах, а тормозные нервные окончания чаще находятся на соме

Органеллы нейрона
На рисунке 5-5 представлена сома нейронов. В соме нейронов показаны ядро и ядрышко, аппарат биосинтеза, который производит компоненты мембран, синтезирует ферменты и другие химические соединения, необходимые для специализированных функций нервных клеток. В него входят тельца Ниссля - плотно прилегающие друг к другу сплюснутые цистерны гранулярного
эндоплазматического ретикулума, а также хорошо выраженный аппарат Гольджи. Сома содержит митохондрии и элементы цитоскелета, в том числе нейрофиламенты и микротрубочки. В результате неполной деградации мембранных компонентов образуется пигмент липофусцин, накапливающийся с возрастом в ряде нейронов. В некоторых группах нейронов ствола мозга (например, в нейронах черной субстанции и голубого пятна) заметен пигмент мелатонин.
Рис. 5-5. Нейрон.
А - органеллы нейрона. На схеме типичные органоиды нейрона показаны такими, какими они видны в световой микроскоп. Левая половина схемы отражает структуры нейрона после окрашивания по Нисслю: ядро и ядрышко, тельца Ниссля в цитоплазме сомы и проксимальных дендритах, а также аппарат Гольджи (неокрашенный). Обратите внимание на отсутствие телец Ниссля в аксонном холмике и аксоне. Часть нейрона после окрашивания солями тяжелых металлов: видны нейрофибриллы. При соответствующем окрашивании солями тяжелых металлов можно наблюдать аппарат Гольджи (в данном случае не показан). На поверхности нейрона находятся несколько синаптических окончаний (окрашены солями тяжелых металлов). Б - Схема соответствует электронно-микроскопической картине. Видны ядро, ядрышко, хроматин, ядерные поры. В цитоплазме видны митохондрии, шероховатый эндоплазматический ретикулум, аппарат Гольджи, нейрофиламенты и микротрубочки. На наружной стороне плазматической мембраны - синаптические окончания и отростки астроцитов

Типы нейронов
Нейроны очень разнообразны. Нейроны разного типа выполняют специфичные коммуникативные функции, что отражается на их строении. Так, нейроны ганглиев задних корешков (спинальных ганглиев)получают информацию не путем синаптической передачи, а от сенсорных нервных окончаний в органах. Клеточные тела этих нейронов лишены дендритов (рис. 5-6 А5) и не получают синаптических окончаний. Выйдя из клеточного тела, аксон такого нейрона разделяется на две ветви, одна из которых(периферический отросток)
направляется в составе периферического нерва к сенсорному рецептору, а другая ветвь (центральный отросток)входит в спинной мозг (в составе заднего корешка)либо в ствол мозга (в составе черепного нерва).
Нейроны другого типа, такие, как пирамидные клеткикоры больших полушарий и клетки Пуркиньекоры мозжечка, заняты переработкой информации (рис. 5-6 А1, А2). Их дендриты покрыты дендритными шипиками и характеризуются обширной поверхностью. Они имеют огромное количество синаптических входов.
Рис. 5-6. Типы нейронов
А - нейроны разнообразной формы: 1 - нейрон, напоминающий пирамиду. Нейроны такого типа, называемые пирамидными клетками, характерны для коры больших полушарий. Обратите внимание на отросткишипики, усеивающие поверхность дендритов; 2 - клетки Пуркинье, названные по имени впервые описавшего их чешского нейроанатома Яна Пуркинье. Они находятся в коре мозжечка. У клетки грушевидное тело; по одну сторону от сомы располагается обильное сплетение дендритов, по другую - аксон. Тонкие ветви дендритов покрыты шипиками (на схеме не показаны); 3 - постганглионарный симпатический мотонейрон; 4 - альфа-мотонейрон спинного мозга. Он, так же как постганглионарный симпатический мотонейрон (3), мультиполярный, с радиальными дендритами; 5 - сенсорная клетка спинального ганглия; не имеет дендритов. Ее отросток разделяется на две ветви: центральную и периферическую. Поскольку в процессе эмбрионального развития аксон образуется в результате слияния двух отростков, эти нейроны считаются не униполярными, а псевдоуниполярными. Б - типы нейронов

Виды ненейронных клеток
Еще одна группа клеточных элементов нервной системы - нейроглия(рис. 5-7 А), или поддерживающие клетки. В ЦНС человека число нейроглиальных клеток на порядок больше, чем число нейронов: 1013 и 1012 соответственно. Нейроглия не принимает прямого участия в краткосрочных коммуникативных процессах в нервной системе, но способствует осуществлению этой функции нейронами. Так, нейроглиальные клетки определенного типа образуют вокруг многих аксонов миелиновую оболочку,значительно увеличивающую скорость проведения потенциалов действия. Это позволяет аксонам быстро передавать информацию к удаленным клеткам.
Типы нейроглии
Глиальные клетки поддерживают деятельность нейронов (рис. 5-7 Б). В ЦНС к нейроглии относят астроцитыи олигодендроциты,а в ПНС - шванновские клеткии клетки-сателлиты.Кроме того, центральными глиальными клетками считаются клетки микроглиии клетки эпендимы.
Астроциты(получившие название благодаря своей звездчатой форме) регулируют микросреду вокруг нейронов ЦНС, хотя контактируют они только с частью поверхности центральных нейронов (рис. 5-7 А). Однако их отростками окружены группы синаптических окончаний, которые в результате изолированы от соседних синапсов. Особые отростки - «ножки»астроцитов образуют контакты с капиллярами и с соединительной тканью на поверхности ЦНС - с мягкой мозговой оболочкой(рис. 5-7 А). Ножки ограничивают свободную диффузию веществ в ЦНС. Астроциты могут активно поглощать К+ и нейромедиаторные вещества, затем метаболизируя их. Таким образом, астроциты играют буферную роль, перекрывая прямой доступ для ионов и нейромедиаторов во внеклеточную среду вокруг нейронов. В цитоплазме астроцитов находятся глиальные
филаменты, выполняющие в ткани ЦНС механическую опорную функцию. В случае повреждения отростки астроцитов, содержащие глиальные филаменты, подвергаются гипертрофии и формируют глиальный «рубец».
Другие элементы нейроглии обеспечивают электрическую изоляцию нейронных аксонов. Многие аксоны покрыты изолирующеймиелиновой оболочкой.Это многослойная обертка, спирально намотанная поверх плазматической мембраны аксонов. В ЦНС миелиновую оболочку создают мембраны клеток олигодендроглии(рис. 5-7 Б3). В ПНС миелиновая оболочка образована мембранамишванновских клеток(рис. 5-7 Б2). Немиелинизированные (безмякотные) аксоны ЦНС не имеют изолирующего покрытия.
Миелин увеличивает скорость проведения потенциалов действия благодаря тому, что ионные токи во время потенциала действия входят и выходят только в перехватах Ранвье(областях прерыва между соседними миелинизирующими клетками). Таким образом, потенциал действия «перескакивает» от перехвата к перехвату - так называемое сальтаторное проведение.
Кроме того, в состав нейроглии входят клеткисателлиты,инкапсулирующие нейроны ганглиев спинальных и черепных нервов, регулируя микросреду вокруг этих нейронов наподобие того, как это делают астроциты. Еще один вид клеток - микроглия,или латентные фагоциты. В случае повреждения клеток ЦНС микроглия способствует удалению продуктов клеточного распада. В этом процессе участвуют другие клетки нейроглии, а также фагоциты, проникающие в ЦНС из кровотока. Ткань ЦНС отделена от ЦСЖ, заполняющей желудочки мозга, эпителием, сформированным эпендимными клетками(рис. 5-7 А). Эпендима обеспечивает диффузию многих веществ между внеклеточным пространством мозга и ЦСЖ. Специализированные эпендимные клетки сосудистых сплетений в системе желудочков секретируют значительную
долю ЦСЖ.
Рис. 5-7. Ненейронные клетки.
А - схематическое представление ненейронных элементов центральной нервной системы. Изображены два астроцита, ножки отростков которых заканчиваются на соме и дендритах нейрона, а также контактируют с мягкой мозговой оболочкой и/или капиллярами. Олигодендроцит формирует миелиновую оболочку аксонов. Показаны также клетки микроглии и клетки эпендимы. Б - разные типы клеток нейроглии в центральной нервной системе: 1 - фибриллярный астроцит; 2 - протоплазматический астроцит. Обратите внимание на астроцитарные ножки, контактирующие с капиллярами (см. 5-7 А); 3 - олигодендроцит. Каждый из его отростков обеспечивает формирование одной или более межперехватных миелиновых оболочек вокруг аксонов центральной нервной системы; 4 - клетки микроглии; 5 - клетки эпендимы

Схема распространения информации по нейрону
В зоне синапса локально образовавшийся ВПСП распространяется пассивно электротонически по всей постсинаптической мембране клетки. Это распространение не подчиняется закону «все или ничего». Если большое число возбуждающих синапсов возбуждаются одновременно или почти одновременно, то возникает явление суммации,проявляющееся в виде возникновения ВПСП существенно большей амплитуды, что может деполяризовать мембрану всей постсинаптической клетки. Если величина этой деполяризации достигает в области постсинаптической мембраны определенного порогового значения (10 мВ или больше), то на аксонном холмике нервной клетки молниеносно открываются потенциалуправляемые №+-каналы, и клетка генерирует потенциал действия, проводящийся вдоль ее аксона. При обильном освобождении трансмиттера постсинаптический потенциал может появиться уже через 0,5-0,6 мс после пришедшего в пресинаптическую область потенциала действия. От начала ВПСП до образования потенциала действия проходит еще около 0,3 мс.
Пороговый стимул- самый слабый стимул, надежно различаемый сенсорным рецептором. Для этого стимул должен вызывать рецепторный потенциал такой амплитуды, которая достаточна для активации хотя бы одного первичного афферентного волокна. Более слабые стимулы могут вызвать подпороговый рецепторный потенциал, однако они не приведут к возбуждению центральных сенсорных нейронов и, следовательно, не будут восприняты. Кроме того, количество
возбужденных первичных афферентных нейронов, необходимое для сенсорного восприятия, зависит от пространственнойивременной суммациив сенсорных путях (рис. 5-8 Б, Г).
Взаимодействуя с рецептором, молекулы АЦХ открывают неспецифические ионные каналы в постсинаптической мембране клетки так, что повышается их способность к проводимости одновалентных катионов. Работа каналов ведет к базовому входящему току положительных ионов, и, следовательно, к деполяризации постсинаптической мембраны, которая применительно к синапсам называется возбуждающим постсинаптическим потенциалом.
Ионные токи, участвующие в возникновении ВПСП, ведут себя иначе, нежели токи натрия и калия во время генерации потенциала действия. Причина заключается в том, что в механизме генерации ВПСП участвуют другие ионные каналы с другими свойствами (лигандуправляемые, а не потенциалуправляемые). При потенциале действия активируются потенциалуправляемые ионные каналы, и с увеличивающейся деполяризацией открываются следующие каналы, так что процесс деполяризации усиливает сам себя. В то же время проводимость трансмиттеруправляемых каналов (лигандуправляемых) зависит только от количества молекул трансмиттера, связавшихся с молекулами рецептора (в результате чего открываются трансмиттеруправляемые ионные каналы) и, следовательно, от числа открытых ионных каналов. Амплитуда ВПСП лежит в диапазоне от 100 μВдо в некоторых случаях 10 мВ. В зависимости от вида синапса, общая продолжительность ВПСП у некоторых синапсов находится в диапазоне от 5 до 100 мс.
Рис. 5-8. Информация течет от дендритов к соме, к аксону, к синапсу.
На рисунке представлены типы потенциалов в разных местах нейрона в зависимости от пространственной и временной суммации
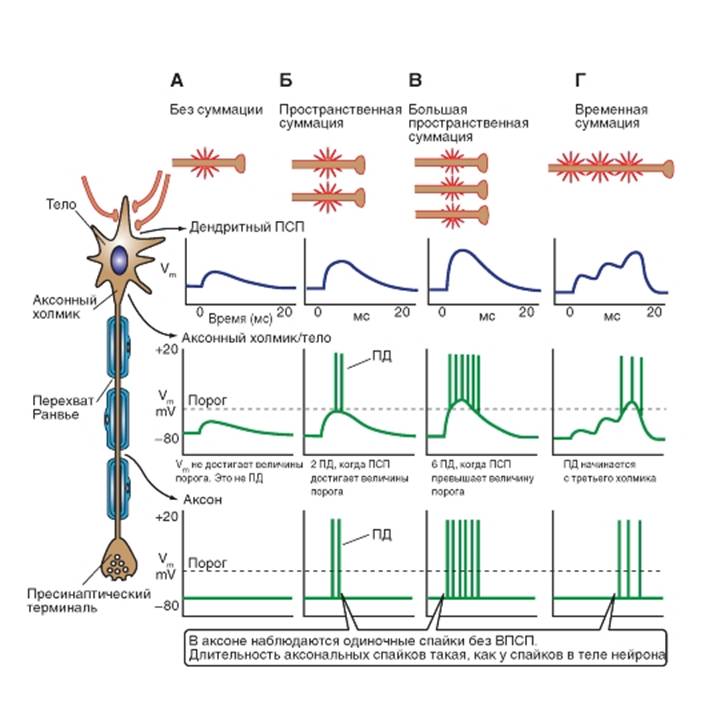
Рефлекс- это ответная реакция на специфичный стимул, осуществляющаяся при обязательном участии нервной системы. Нейронная цепь, обеспечивающая конкретный рефлекс, называется рефлекторной дугой.
В наиболее простом виде рефлекторная дуга соматической нервной системы(рис.5-9 А), как правило, состоит из сенсорных рецепторов определенной модальности (первое звено рефлекторной дуги), информация с которых поступает в центральную нервную систему по аксону чувствительной клетки, расположенной в спинальном ганглии вне пределов центральной нервной системы (второе звено рефлекторной дуги). В составе заднего корешка спинного мозга аксон чувствительной клетки входит в задние рога спинного мозга где образует синапс на вставочном нейроне. Аксон вставочного нейрона идет не прерываясь в передние рога, где образует синапс на α-мотонейроне (вставочный нейрон и α-мотонейрон, как структуры, находящиеся в центральной нервной системе, являются третьим звеном рефлекторной дуги). Аксон α-мотонейрона выходит из передних рогов в составе переднего корешка спинного мозга (четвертое звено рефлекторной дуги) и направляется в скелетную мышцу (пятое звено рефлекторной дуги), образуя мионевральные синапсы на каждом мышечном волокне.
Наиболее простая схема рефлекторной дуги вегетативной симпатической нервной системы
(рис. 5-9 Б), обычно состоит из сенсорных рецепторов (первое звено рефлекторной дуги), информация с которых поступает в центральную нервную систему по аксону чувствительной клетки, расположенной в спинальном или другом чувствительном ганглии вне пределов центральной нервной системы (второе звено рефлекторной дуги). Аксон чувствительной клетки в составе заднего корешка входит в задние рога спинного мозга, где образует синапс на вставочном нейроне. Аксон вставочного нейрона идет в боковые рога, где образует синапс на преганглионарном симпатическом нейроне (в грудном и поясничном отделах). (Вставочный нейрон и преганглионарный симпатический
нейрон - это третье звено рефлекторной дуги). Аксон преганглионарного симпатического нейрона выходит из спинного мозга в составе передних корешков (четвертое звено рефлекторной дуги). Дальнейшие три варианта путей этого типа нейрона объединены на схеме. В первом случае аксон преганглионарного симпатического нейрона уходит в паравертебральный ганглий где образует синапс на нейроне, аксон которого идет к эффектору (пятое звено рефлекторной дуги), например, к гладкой мускулатуре внутренних органов, к секреторным клеткам и др. Во втором случае аксон преганглионарного симпатического нейрона уходит в превертебральный ганглий, где образует синапс на нейроне, аксон которого идет к внутреннему органу (пятое звено рефлекторной дуги). В третьем случае, аксон преганглионарного симпатического нейрона уходит в мозговой слой надпочечников, где образует синапс на специальной клетке, выделяющей адреналин в кровь (все это - четвертое звено рефлекторной дуги). В этом случае, адреналин через кровь поступает ко всем структурам - мишеням, имеющим к нему фармакологические рецепторы (пятое звено рефлекторной дуги).
В наиболее простом виде рефлекторная дуга вегетативной парасимпатической нервной системы(рис. 5-9 В) состоит из сенсорных рецепторов - первое звено рефлекторной дуги (расположенных, например. в желудке), которые посылают информацию в центральную нервную систему по аксону чувствительной клетки, расположенной в ганглии, находящемся по ходу блуждающего нерва (второе звено рефлекторной дуги). Аксон чувствительной клетки передает информацию напрямую в продолговатый мозг, где образуется синапс на нейроне, аксон которого (также в пределах продолговатого мозга) образует синапс на парасимпатическом преганглионарном нейроне (третье звено рефлекторной дуги). От него аксон, например в составе блуждающего нерва, возвращается в желудок и образует синапс на эфферентной клетке (четвертое звено рефлекторной дуги) аксон которой ветвится по ткани желудка (пятое звено рефлекторной дуги), образуя нервные окончания.
Рис. 5-9. Схемы основных рефлекторных дуг.
А - Рефлекторная дуга соматической нервной системы. Б - Рефлекторная дуга вегетативной симпатической нервной системы. В - Рефлекторная дуга вегетативной парасимпатической нервной системы

Вкусовые рецепторы
Знакомые всем нам вкусовые ощущенияна самом деле представляют собой смеси четырех элементарных вкусовых качеств: соленого, сладкого, кислого и горького. Особенно эффективно вызывают соответствующие вкусовые ощущения четыре вещества: хлорид натрия (NaCl), сахароза, соляная кислота (НС1) и хинин.
Пространственное распределение и иннервация вкусовых почек
Вкусовые почки содержатся во вкусовых сосочках разного типа на поверхности языка, нёба, глотки и гортани (рис. 5-10 А). На передней и боковой части языка расположены грибовидныеи листовидные
сосочки,а на поверхности корня языка - желобоватые.В состав последних может входить несколько сотен вкусовых почек, общее число которых у человека достигает нескольких тысяч.
Специфическая вкусовая чувствительность не одинакова в разных зонах поверхности языка (рис. 5-10 Б, В). Сладкий вкус лучше всего воспринимается кончиком языка, соленый и кислый - боковыми зонами, а горький - основанием (корнем) языка.
Вкусовые почки иннервируются тремя черепными нервами, два из которых показаны на рис. 5-10 Г. Барабанная струна(chorda tympani- ветвь лицевого нерва) снабжает вкусовые почки передних двух третей языка, языкоглоточный нерв- задней трети (рис. 5-10 Г).Блуждающий нервиннервирует некоторые вкусовые почки гортани и верхней части пищевода.
Рис. 5-10 Химическая чувствительность - вкус и его основы.
А - вкусовая почка. Организация вкусовых почек в сосочках трех типов. Показана вкусовая почка с вкусовым отверстием на вершине и отходящими снизу нервами, а также хеморецепторные клетки двух типов, поддерживающие (опорные) и вкусовые клетки. Б - представлены три типа сосочков на поверхности языка. В - распределение зон четырех элементарных вкусовых качеств на поверхности языка. Г - иннервация двух передних третей и задней трети поверхности языка лицевым и языкоглоточным нервами

Вкусовая почка
Вкусовые ощущения возникают при активации хеморецепторов во вкусовых почках (вкусовых луковицах). Каждая вкусовая почка(calicilus gustatorius) содержит от 50 до 150 сенсорных (хеморецептивных, вкусовых) клеток, а также включает поддерживающие (опорные) и базальные клетки (рис. 5-11 А). Базальная часть сенсорной клетки образует синапс на окончании первичного афферентного аксона. Есть два типа хеморецептивных клеток, содержащих разные синаптические пузырьки: с электронно-плотным центром либо круглые прозрачные пузырьки. Апикальная поверхность клеток покрыта микроворсинками, направленными к вкусовой поре.
Хеморецепторные молекулы микроворсиноквзаимодействуют со стимулирующими молекулами, попадающими во вкусовую пору(вкусовое отверстие) из жидкости, омывающей вкусовые почки. Эта жидкость частично продуцируется железами между вкусовыми почками. В результате сдвига мембранной проводимости в сенсорной клетке возникает рецепторный потенциал, и высвобождается возбуждающий нейромедиатор, под влиянием которого в первичном афферентном волокне развивается генераторный потенциал и начинается импульсный разряд, передаваемый в ЦНС.
Кодирование четырех первичных вкусовых качеств не основывается на полной избирательности сенсорных клеток. Каждая клетка отвечает на стимулы более чем одного вкусового качества, однако наиболее активно, как правило, только на одно. Различение вкусового качества зависит от пространственно упорядоченного входа от популяции сенсорных клеток. Интенсивность стимула кодируется количественными характеристиками вызванной им активности (частотой импульсов и количеством возбужденных нервных волокон).
На рис. 5-11 показан механизм работы вкусовых почек, включающийся на разные по вкусу вещества.
Клеточные механизмы восприятия вкуса сводятся к различным способам деполяризации мембраны клетки и дальнейшему открытию потенциал управляемых кальциевых каналов. Вошедший кальций делает возможным освобождение медиатора, что приводит к появлению генераторного потенциала в окончании чувствительного нерва. Каждый стимул деполяризует мембрану разными путями. Соленый стимул взаимодействует с эпителиальными натриевыми каналами (ENaC), открывая их для натрия. Кислый стимул может самостоятельно открыть ENaC или же благодаря снижению pH закрыть калиевые каналы, что также приведет к деполяризации мембраны вкусовой клетки. Сладкий вкус возникает за счет взаимодействия сладкого стимула с чувствительным к нему рецептором, связанным с G-белком. Активированный G-белок стимулирует аденилатциклазу, которая повышает содержание цАМФ и далее активирует зависимую протеинкиназу, которая, в свою очередь, фосфорилируя калиевые каналы, закрывает их. Все это также приводит к деполяризации мембраны. Горький стимул может деполяризовать мембрану тремя путями: (1) закрытием калиевых каналов, (2) путем взаимодействия с G-белком (гастдуцином) активировать фосфодиэстеразу (PDE), тем самым, снижая содержание цАМФ. Это (по не совсем понятным причинам) вызывает деполяризацию мембраны. (3) Горький стимул связывается с G-белком, способным активировать фосфолипазу С (PLC), в результате увеличивается содержание инозитол 1,4,5 трифосфат (IP3), который приводит к освобождению кальция из депо.
Глютамат связывается с гютаматрегулиру- емыми неселективными ионными каналами и открывает их. Это сопровождается деполяризацией и открытием потенциал управляемых кальциевых каналов.
(PIP2) - фосфатидил инозитол 4,5бифосфат (DAG) - диацилглицерол
Рис. 5-11. Клеточные механизмы восприятия вкуса

Центральные вкусовые пути
Тела клеток, которым принадлежат вкусовые волокна VII, IX и Х черепных нервов, находятся соответственно в коленчатом, каменистом и узловатом ганглиях (рис. 5-12 Б). Центральные отростки их афферентных волокон входят в продолговатый мозг, включаются в состав одиночного тракта и оканчиваются синапсами в ядре одиночного тракта (nucleus solitarius) (рис. 5-12 А). У ряда животных, в том числе некоторых видов грызунов, вторичные вкусовые нейроны ядра одиночного тракта проецируются рострально к ипсилатеральномупарабрахиальному ядру.
В свою очередь, парабрахиальное ядро посылает проекции к мелкоклеточной (правоцеллюлярной) части вентрального заднемедиального (ВЗМмк) ядра (МК - мелкоклеточная часть ВЗМ)таламуса (рис. 5-12 В). У обезьян проекции ядра одиночного тракта к ВЗМмк-ядру являются прямыми. ВЗМмк-ядро связано с двумя разными вкусовыми областями коры мозга. Одна из них - часть лицевого представительства (SI), другая находится в островковой доле (insula - островок) (рис. 5-12 Г). Центральный вкусовой путь необычен в том отношении, что его волокна не переходят на другую сторону мозга (в отличие от соматосенсорных, зрительных и слуховых путей).
Рис. 5-12. Пути проводящие вкусовую чувствительность.
А - окончание вкусовых афферентных волокон в ядре одиночного тракта и восходящие пути к парабрахиальному ядру, вентробазальному таламусу и коре большого мозга. Б - периферическое распределение вкусовых афферентных волокон. В и Г - вкусовые области таламуса и коры большого мозга обезьян

Обоняние
У приматов и человека (микросматов) обонятельная чувствительностьразвита гораздо хуже, чем у большинства животных (макросматов). Поистине легендарна способность собак находить след по запаху, также как привлечение насекомыми особей другого пола с помощью феромонов.Что касается человека, то у него обоняние играет роль в эмоциональной сфере; запахи эффективно способствуют извлечению информации из памяти.
Обонятельные рецепторы
Обонятельный хеморецептор (сенсорная клетка) - это биполярный нейрон (рис. 5-13 В). Его апикальная поверхность несет неподвижные реснички, реагирующие на пахучие вещества, растворенные в покрывающем их слое слизи. От более глубоко расположенного края клетки отходит немиелинизированный аксон. Аксоны объединяются в обонятельные пучки (fila olfactoria),проникающие в череп через отверстия в решетчатой пластинке (lamina cribrosa) решетчатой кости (os ethmoidale). Волокна обонятельного нерва оканчиваются синапсами в обонятельной луковице, а центральные обонятельные структуры находятся в основании черепа сразу под лобной долей. Обонятельные рецепторные клетки входят в состав слизистой оболочки специализированной обонятельной зоны носоглотки, общая поверхность которой с двух сторон составляет примерно 10 см2 (рис. 5-13 А). У человека около 107 обонятельных рецепторов. Так же как вкусовые рецепторы, обонятельные рецепторы имеют короткую продолжительность жизни (около 60 дней) и непрерывно замещаются.
Молекулы пахучих веществ попадают к обонятельной зоне через ноздри при вдохе или из ротовой полости во время еды. Нюхательные движения усиливают поступление этих веществ, временно соединяющихся с обонятельным связывающим белком слизи, секретируемой железами слизистой оболочки носовой полости.
Первичных обонятельных ощущений больше, чем вкусовых. Насчитываются запахи, по крайней мере, шести классов: цветочный, эфирный(фруктовый), мускусный, камфарный, гнилостныйи едкий.Примерами их природных источников могут служить соответственно роза, груша, мускус, эвкалипт, тухлые яйца и уксус. В обонятельной слизистой оболочке еще находятся рецепторы тройничного нерва. При клиническом тестировании обоняния следует избегать болевых или температурных раздражений этих соматосенсорных рецепторов.
Несколько молекул пахучего вещества вызывают в сенсорной клетке деполяризующий рецепторный потенциал, запускающий разряд импульсов в афферентном нервном волокне. Однако для поведенческой реакции необходима активация некоторого числа обонятельных рецепторов. Рецепторный потенциал, по-видимому, возникает в результате повышения проводимости для Na+. Вместе с тем активируется G-белок. Следовательно, в обонятельном преобразовании (трансдукции) участвует каскад вторичных посредников.
Обонятельное кодирование имеет много общего с вкусовым. Каждый обонятельный хеморецептор отвечает на запахи более чем одного класса. Кодирование конкретного качества запаха обеспечивается ответами многих обонятельных рецепторов, а интенсивность ощущения определяется количественными характеристиками импульсной активности.
Рис. 5-13. Химическая чувствительность - обоняние и его основы.
АиБ - схема расположения обонятельной зоны слизистой оболочки в носоглотке. Вверху находится решетчатая пластинка, а над ней - обонятельная луковица. Обонятельная слизистая оболочка распространяется и на боковые стороны носоглотки. В и Г - обонятельные хеморецепторы и поддерживающие клетки. Г - обонятельный эпителий. Д - схема процессов в обонятельных рецепторах

Центральные обонятельные пути
Обонятельный путь первый раз переключается в обонятельной луковице, относящейся к коре мозга. Эта структура содержит клетки трех типов: митральные клетки, пучковатые клеткии интернейроны (клетки-зерна, перигломерулярные клетки)(рис. 5-14). Длинные разветвляющиеся дендриты митральных и пучковатых клеток образуют постсинаптические компоненты обонятельных гломерул (клубочков). Обонятельные афферентные волокна (идущие от обонятельной слизистой оболочки к обонятельной луковице) ветвятся около обонятельных клубочков и оканчиваются синапсами на дендритах митральных и пучковатых клеток. При этом происходит значительная конвергенция обонятельных аксонов на дендритах митральных клеток: на дендрите каждой митральной клетки находится до 1000 синапсов афферентных волокон. Клетки-зерна (гранулярные клетки) и перигломерулярные клетки - это тормозные интернейроны. Они образуют реципрокные дендродендритные синапсы с митральными клетками. При активации митральных клеток происходит деполяризация контактирующих с ней интернейронов, вследствие чего в их синапсах на митральных клетках высвобождается тормозной нейромедиатор. Обонятельная луковица получает входы не только через ипсилатеральные обонятельные нервы, но и через контралатеральный обонятельный тракт, идущий в передней комиссуре (спайке).
Аксоны митральных и пучковатых клеток покидают обонятельную луковицу и входят в состав обонятельного тракта (рис. 5-14). Начиная с этого участка, обонятельные связи очень усложняются. Обонятельный тракт идет через переднее обонятельное ядро.Нейроны этого ядра получают синаптические связи от нейронов обонятельной
луковицы и проецируются через переднюю комиссуру к контралатеральной обонятельной луковице. Подойдя к переднему продырявленному веществу на основании мозга, обонятельный тракт разделяется на латеральную и медиальную обонятельные полоски. Аксоны латеральной обонятельной полоски оканчиваются синапсами в первичной обонятельной области, включая пре-грушевидную (препириформную) область коры, а у животных - грушевидную (пириформную) долю. Медиальная обонятельная полоска дает проекции к миндалине и к коре базального переднего мозга.
Следует отметить, что обонятельный путь это единственная сенсорная система без обязательного синаптического переключения в таламусе. Вероятно, отсутствие такого переключения отражает филогенетическую древность и относительную примитивность обонятельной системы. Однако обонятельная информация все же поступает в заднемедиальное ядро таламуса и оттуда направляется в префронтальную и орбитофронтальную кору.
При стандартном неврологическом исследовании проверку обоняния обычно не производят. Однако восприятие запахов можно тестировать, предложив испытуемому понюхать и идентифицировать пахучее вещество. Одномоментно исследуют одну ноздрю, другую нужно закрыть. При этом нельзя применять такие сильные стимулы, как нашатырь, поскольку они активируют и окончания тройничного нерва. Нарушение обоняния (аносмия)наблюдается, когда повреждено основание черепа или же одна или обе обонятельные луковицы сдавлены опухолью (например, при менингиоме обонятельной ямки).Аура неприятного запаха, часто запаха жженой резины, возникает при эпилептических припадках, генерируемых в области ункуса.
Рис. 5-14. Схема сагиттального среза через обонятельную луковицу, показывающая окончания обонятельных хеморецепторных клеток на обонятельных клубочках и на нейронах обонятельной луковицы.
Аксоны митральных и пучковатых клеток выходят в составе обонятельного тракта (направо)
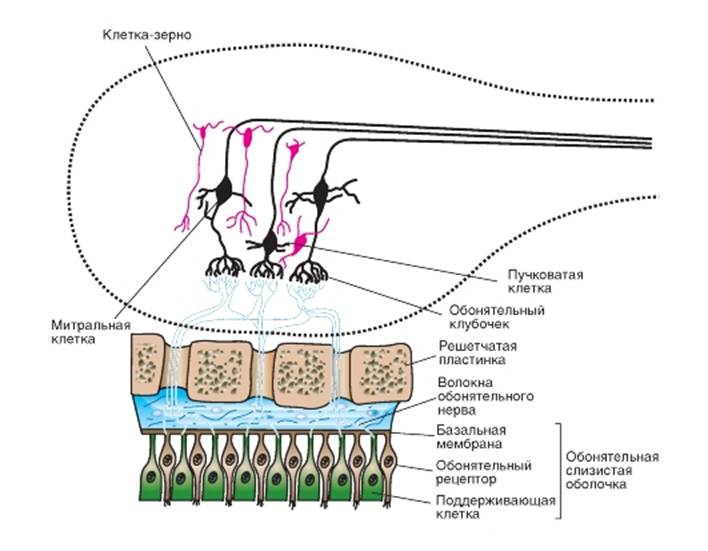
Строение глаза
Стенка глаза состоит из трех концентрических слоев (оболочек) (рис. 5-15 А). Наружный опорный слой, или фиброзная оболочка, включает в себя прозрачную роговицус ее эпителием, конъюнктивуи непрозрачную склеру.В среднем слое, или сосудистой оболочке, находятся радужная оболочка (радужка) и собственно сосудистая оболочка (choroidea). В радужной оболочкеприсутствуют радиальные и кольцевые гладкие мышечные волокна, образующие дилататор и сфинктер зрачка (рис. 5-15 Б). Сосудистая оболочка(хороид) богато снабжена кровеносными сосудами, питающими внешние слои сетчатки, а также содержит пигмент. Внутренний нервный слой стенки глаза, или сетчатка, содержит палочки и колбочки и выстилает всю внутреннюю поверхность глаза, за исключением «слепого пятна» - диска зрительного нерва(рис. 5-15 А). К диску сходятся аксоны ганглиозных клеток сетчатки, образуя зрительный нерв. Наиболее высокая острота зрения в центральной части сетчатки, так называемом желтом пятне(macula lutea). Середина желтого пятна вдавлена в виде центральной ямки(fovea centralis) - зоны фокусирования зрительных изображений. Внутренняя часть сетчатки питается за счет ветвей ее центральных сосудов (артерий и вен), которые входят вместе со зрительным нервом, затем в области диска разветвляются и расходятся по внутренней поверхности сетчатки (рис. 5-15 В), не задевая желтое пятно.
Кроме сетчатки, в глазу есть и другие образования: хрусталик- линза, фокусирующая свет на сетчатке; пигментный слой,ограничивающий рассеяние света; водянистая влагаи стекловидное тело.Водянистая влага - это жидкость, составляющая среду передней и задней камер глаза, а стекловидное тело заполняет внутреннее пространство глаза за хрусталиком. Оба вещества способствуют поддержанию формы глаза. Водянистая влага секретируется ресничным эпителием задней камеры, затем циркулирует через зрачок в переднюю камеру, а оттуда
попадает через шлеммов каналв венозный кровоток (рис. 5-15 Б). От давления водянистой влаги (в норме оно ниже 22 мм рт.ст.) зависит внутриглазное давление, которое не должно превышать 22 мм рт.ст. Стекловидное тело - это гель, состоящий из внеклеточной жидкости с коллагеном и гиалуроновой кислотой; в отличие от водянистой влаги, оно заменяется очень медленно.
Если поглощение водянистой влаги нарушается, внутриглазное давление возрастает и развивается глаукома. При повышении внутриглазного давления затрудняется кровоснабжение сетчатки и глаз может ослепнуть.
Ряд функций глаза зависит от деятельности мышц. Наружные глазные мышцы, прикрепленные вне глаза, направляют движения глазных яблок к зрительной мишени. Эти мышцы иннервируются глазодвигательным(nervus oculomotorius), блоковым(n. trochlearis) иотводящим(n. abducens) нервами.Есть также внутренние глазные мышцы. Благодаря мышце, расширяющей зрачок (дилататор зрачка),и мышце, суживающей зрачок (сфинктер зрачка),радужка действует как диафрагма и регулирует диаметр зрачка аналогично устройству отверстия фотокамеры, контролирующему количество входящего света. Дилататор зрачка активируется симпатической нервной системой, а сфинктер - парасимпатической нервной системой (через систему глазодвигательного нерва).
Форма хрусталика тоже определяется работой мышц. Хрусталик подвешен и удерживается на своем месте позади радужки с помощью волокон цилиарного(ресничного, или циннова) пояска,прикрепленных к капсуле зрачка и к цилиарному телу. Хрусталик окружен волокнами цилиарной мышцы,действующей как сфинктер. Когда эти волокна расслаблены, натяжение волокон пояска растягивает хрусталик, уплощая его. Сокращаясь, цилиарная мышца противодействует натяжению волокон пояска, что позволяет эластичному хрусталику принять более выпуклую форму. Цилиарная мышца активируется парасимпатической нервной системой (через систему глазодвигательного нерва).
Рис. 5-15. Зрение.
А - схема горизонтального сечения правого глаза. Б - строение передней части глаза в области лимба (соединения роговицы и склеры), цилиарного тела и хрусталика. В - задняя поверхность (дно) глаза человека; вид в офтальмоскоп. Ветви центральных артерии и вены выходят из области диска зрительного нерва. Недалеко от диска зрительного нерва с височной его стороны находится центральная ямка (ЦЯ). Обратите внимание на распределение аксонов ганглиозных клеток (тонкие линии), сходящихся в диске зрительного нерва.
На дальнейших рисунах дана детализация строения глаза и механизмов работы его структур (пояснения на рисунках)


Рис. 5-15.2.

Рис. 5-15.3.

Рис. 5-15.4.

Рис. 5-15.5.
Оптическая система глаза
Свет входит в глаз через роговицу и проходит через последовательно расположенные прозрачные жидкости и структуры: роговицу, водянистую влагу, хрусталик и стекловидное тело. Их совокупность называется диоптрическим аппаратом.В нормальных условиях происходит рефракция(преломление) лучей света от зрительной мишени роговицей и хрусталиком, так что лучи фокусируются на сетчатке. Преломляющая сила роговицы (основного рефракционного элемента глаза) равна 43 диоптриям * [«Д», диоптрия, - единица преломляющей (оптической) силы, равная обратной величине фокусного расстояния линзы (хрусталика), заданного в метрах]. Выпуклость хрусталика может изменяться, и его преломляющая сила варьирует между 13 и 26 Д. Благодаря этому хрусталик обеспечивает аккомодацию глазного яблока к объектам, находящимся на близком или на далеком расстоянии. Когда, например, лучи света от удаленного объекта входят в нормальный глаз (с расслабленной цилиарной мышцей), мишень оказывается в фокусе на сетчатке. Если же глаз направлен на ближний объект, лучи света сначала фокусируются позади сетчатки (т.е. изображение на сетчатке расплывается), пока не произойдет аккомодация. Цилиарная мышца сокращается, ослабляя натяжение волокон пояска, кривизна хрусталика увеличивается, и в результате изображение фокусируется на сетчатке.
Роговица и хрусталик вместе составляют выпуклую линзу. Лучи света от объекта проходят через узловую точку линзы и образуют на сетчатке перевернутое изображение, как в фотоаппарате. Сетчатка обрабатывает непрерывную последовательность изображений, а также посылает в мозг сообщения о перемещениях зрительных объектов, угрожающих признаках, периодической смене света и темноты и другие зрительные данные о внешней среде.
Хотя оптическая ось человеческого глаза проходит через узловую точку хрусталика и через точку сетчатки между центральной ямкой и диском зрительного нерва, глазодвигательная система ориентирует глазное яблоко на участок объекта, называемый точкой фиксации.От этой точки луч света идет через узловую точку и фокусируется в центральной ямке. Таким образом луч проходит вдоль зрительной оси. Лучи от остальных участков объекта фокусируются в области сетчатки вокруг центральной ямки (рис. 5-16 А).
Фокусирование лучей на сетчатке зависит не только от хрусталика, но и от радужки. Радужка играет роль диафрагмы фотоаппарата и регулирует не только количество света, поступающего в глаз, но, что еще важнее, глубину зрительного поля и сферическую аберрацию хрусталика. При уменьшении диаметра зрачка глубина зрительного поля возрастает, и лучи света направляются через центральную часть зрачка, где сферическая аберрация минимальна. Изменения диаметра зрачка происходят автоматически, т.е. рефлекторно, при настройке (аккомодации) глаза на рассматривание близких предметов. Следовательно, во время чтения или другой деятельности глаз, связанной с различением мелких объектов, качество изображения улучшается с помощью оптической системы глаза. На качество изображения влияет еще один фактор - рассеяние света. Оно минимизируется путем ограничения пучка света, а также его поглощения пигментом сосудистой оболочки и пигментным слоем сетчатки. В этом отношении глаз снова напоминает фотоаппарат. Там рассеяние света тоже предотвращается посредством ограничения пучка лучей и его поглощения черной краской, покрывающей внутреннюю поверхность камеры.
Фокусирование изображения нарушается, если размер глаза не соответствует преломляющей силе диоптрического аппарата. Примиопии(близорукости) изображения удаленных объектов фокусируются впереди сетчатки, не доходя до нее (рис. 5-16 Б). Дефект корректируется с помощью вогнутых линз. И наоборот, при гиперметропии(дальнозоркости) изображения далеких предметов фокусируются позади сетчатки. Чтобы устранить проблему, нужны выпуклые линзы (рис. 5-16 Б). Правда, изображение можно временно сфокусировать за счет аккомодации, но при этом утомляются цилиарные мышцы и глаза устают. При астигматизмесуществует асимметрия между радиусами кривизны поверхностей роговицы или хрусталика (а иногда сетчатки) в разных плоскостях. Для коррекции применяют линзы со специально подобранными радиусами кривизны.
Упругость хрусталика постепенно снижается с возрастом. В результате падает эффективность его аккомодации при рассматривании близких предметов (пресбиопия).В молодом возрасте преломляющая сила хрусталика может меняться в широком диапазоне, вплоть до 14 Д. К 40 годам этот диапазон уменьшается вдвое, а после 50 лет падает до 2 Д и ниже. Пресбиопия корректируется выпуклыми линзами.
Рис. 5-16. Оптическая система глаза.
А - сходство между оптическими системами глаза и фотоаппарата. Б - аккомодация и ее нарушения: 1 - эмметропия - нормальная аккомодация глаза. Лучи света от удаленного зрительного объекта фокусируются на сетчатке (верхняя схема), а фокусирование лучей от близкого объекта происходит в результате аккомодации (нижняя схема); 2 - миопия; изображение удаленного зрительного объекта фокусируется впереди сетчатки, для коррекции нужны вогнутые линзы; 3 - гиперметропия; изображение фокусируется позади сетчатки (верхняя схема), для коррекции требуются выпуклые линзы (нижняя схема)
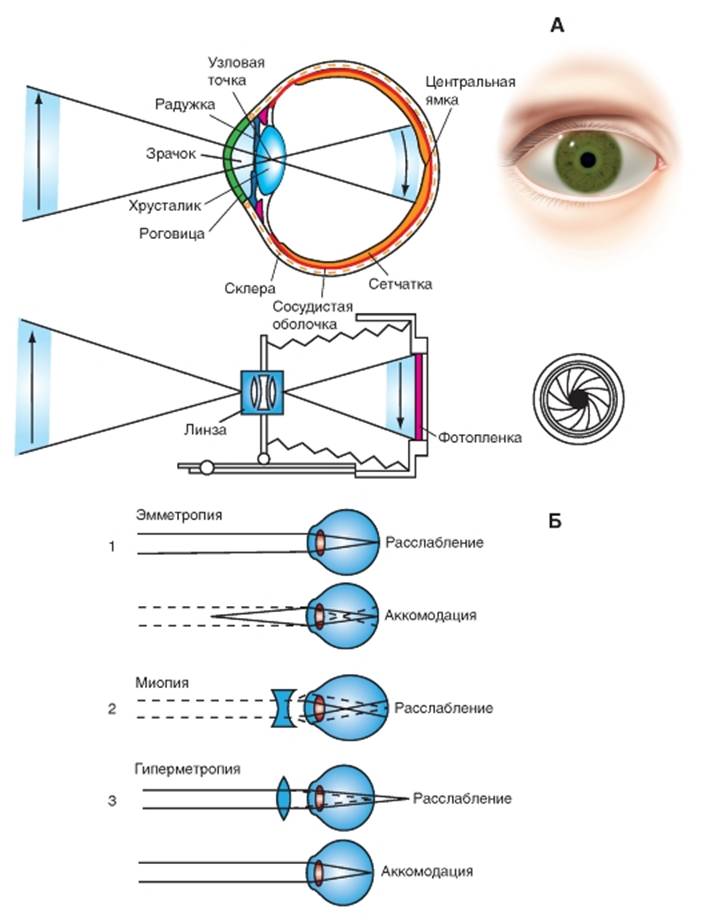
Орган слуха
Периферический слуховой аппарат, ухо, подразделяется на наружное, среднее и внутреннее ухо
(рис. 5-17 А). Наружное ухо
Наружное ухо состоит из ушной раковины, наружного слухового прохода и слухового канала. Церуминозные железы стенок слухового канала секретируют ушную серу- воскообразное защитное вещество. Ушная раковина (по крайней мере, у животных) направляет звук в слуховой канал. По слуховому каналу звук передается к барабанной перепонке. У человека слуховой канал имеет резонансную частоту примерно 3500 Гц и ограничивает частоту звуков, достигающих барабанной перепонки.
Среднее ухо
Наружное ухо отделено от среднего барабанной перепонкой(рис. 5-17 Б). Среднее ухо заполнено воздухом. Цепочка косточек соединяет барабанную перепонку с овальным окном, открывающимся во внутреннее ухо. Недалеко от овального окна расположено круглое окно, тоже соединяющее среднее ухо с внутренним (рис. 5-17 В). Оба отверстия затянуты мембраной. Цепочка слуховых косточек включает молоточек(malleus), наковальню(incus) и стремя(stapes). Основание стремени в виде пластинки плотно входит в овальное окно. За овальным окном находится заполненное жидкостью преддверие(vestibulum) - часть улитки(cochlea) внутреннего уха. Преддверие составляет единое целое с трубчатой структурой - лестницей преддверия(scala vestibuli - вестибулярная лестница). Колебания барабанной перепонки, вызываемые волнами звукового давления, передаются по цепочке косточек и толкают пластинку стремени в овальное окно (рис. 5-17 В). Движения пластинки стремени сопровождаются колебаниями жидкости в лестнице преддверия. Волны давления распространяются по жидкости и передаются через основную (базилярную) мембрануулитки к
барабанной лестнице(scala tympani) (см. ниже), заставляя перепонку круглого окна выгибаться в сторону среднего уха.
Барабанная перепонка и цепочка слуховых косточек осуществляют согласование импеданса. Дело в том, что ухо должно различать звуковые волны, распространяющиеся в воздухе, тогда как механизм нервного преобразования звука зависит от перемещений столба жидкости в улитке. Следовательно, нужен переход от колебаний воздуха к колебаниям жидкости. Акустический импеданс воды гораздо выше, чем таковой воздуха, поэтому без специального устройства для согласования импедансов происходило бы отражение большей части звука, поступающего в ухо. Согласование импедансов в ухе зависит от:
• соотношения площадей поверхности барабанной перепонки и овального окна;
• механического преимущества рычажной конструкции в виде цепочки подвижно сочлененных косточек.
Эффективность механизма согласования импедансов соответствует улучшению слышимости на 10-20 дБ.
Среднее ухо выполняет и другие функции. В нем находятся две мышцы: мышца, напрягающая барабанную перепонку(m. tensor tympani - иннервируется тройничным нервом), и стременная мышца
(m. stapedius - иннервируется лицевым нервом). Первая прикреплена к молоточку, вторая - к стремени. Сокращаясь, они уменьшают перемещения слуховых косточек и снижают чувствительность акустического аппарата. Это способствует защите слуха от повреждающих звуков, но только если организм ожидает их. Внезапный взрыв может повредить акустический аппарат, поскольку рефлекторное сокращение мышц среднего уха запаздывает. Полость среднего уха соединена с глоткой посредством евстахиевой трубы.Благодаря этому проходу уравнивается давление в наружном и среднем ухе. Если при воспалении в среднем ухе скапливается жидкость, просвет евстахиевой трубы может закрыться. Создающаяся при этом разность давлений между наружным и средним ухом вызывает боль из-за натяжения барабанной перепонки, возможен даже разрыв последней. Разность давлений может возникать в самолете и во время ныряния.
Рис. 5-17. Слух.
А - общая схема наружного, среднего и внутреннего уха. Б - схема барабанной перепонки и цепочки слуховых косточек. В - схема поясняет, каким образом при смещении овальной пластинки стремени происходит движение жидкости в улитке и выгибается круглое окно

Внутреннее ухо
В состав внутреннего уха входят костный и перепончатый лабиринты. Они образуют улитку и вестибулярный аппарат.
Улитка - это трубка, закрученная в виде спирали. У человека спираль имеет 21/2 оборота; трубка начинается широким основанием и заканчивается суженной верхушкой. Улитка образована ростральным концом костного и перепончатого лабиринтов. У человека верхушка улитки расположена в латеральной плоскости (рис. 5-18 А).
Костный лабиринт (labyrinthus osseus) улитки включает в себя несколько камер. Пространство около овального окна называется преддверием (рис. 5-18 Б). Преддверие переходит в лестницу преддверия - спиральную трубку, которая продолжается к верхушке улитки. Там лестница преддверия соединяется через отверстие улитки (геликотрему)с барабанной лестницей; это еще одна спиральная трубка, которая спускается назад по улитке и заканчивается у круглого окна (рис. 5-18 Б). Центральный костный стержень, вокруг которого закручены спиральные лестницы, называется стержнем улитки(modiolus cochleae).
Рис. 5-18. Строение улитки.
А - относительное расположение улитки и вестибулярного аппарата среднего и наружного уха человека. Б - соотношение между пространствами улитки

Кортиев орган
Перепончатый лабиринт (labyrinthus membranaceus) улитки иначе называют средней лестницей(scala media) или улитковым протоком(ductus cochlearis). Это перепончатая сплющенная спиральная трубка длиной 35 мм между лестницей преддверия и барабанной лестницей. Одна стенка средней лестницы образована базилярной мембраной, другая - рейснеровой мембраной,третья -сосудистой полоской(stria vascularis) (рис. 5-19 А).
Улитка заполнена жидкостью. В лестнице преддверия и барабанной лестнице находится перилимфа,близкая по составу к ЦСЖ. Средняя лестница содержит эндолимфу,которая значительно отличается от ЦСЖ. В этой жидкости много К+ (около 145 мМ) и мало Na+ (около 2 мМ), так что она сходна с внутриклеточной средой. Поскольку эндолимфа обладает положительным зарядом (около +80 мВ), волосковые клетки внутри улитки имеют высокий трансмембранный градиент потенциала (около 140 мВ). Эндолимфу секретирует сосудистая полоска, а дренирование происходит через эндолимфатический проток в венозные синусы твердой мозговой оболочки.
Нервный аппарат преобразования звука носит название «кортиева органа»(рис. 5-19 Б). Он лежит на дне улиткового хода на базилярной мембране и состоит из нескольких компонентов: трех рядов наружных волосковых клеток, одного ряда внутренних волосковых клеток, желеобразной текториальной (покровной) мембраны и поддерживающих (опорных) клеток нескольких типов. В кортиевом органе человека 15 000 наружных и 3500 внутренних волосковых клеток. Опорную структуру кортиева органа составляют столбчатые клетки и ретикулярная пластинка (сетчатая мембрана). Из верхушек волосковых клеток выступают пучки стереоцилий - ресничек, погруженных в текториальную мембрану.
Кортиев орган иннервируют нервные волокна улитковой части восьмого черепного нерва. Эти волокна (у человека 32 000 слуховых афферентных аксонов) принадлежат сенсорным клеткам спирального ганглия, заключенного в центральном костном стержне. Афферентные волокна входят в кортиев орган и оканчиваются у оснований волосковых клеток (рис. 5-19 Б). Волокна, снабжающие наружные волосковые клетки, входят через кортиев туннель - отверстие под столбчатыми клетками.
Рис. 5-19. Улитка.
А - схема поперечного разреза через улитку в ракурсе, показанном на врезке рис. 5-20 Б. Б - строение кортиева органа

Преобразование (трансдукция) звука
Кортиев орган преобразует звук следующим образом. Достигая барабанной перепонки, звуковые волны вызывают ее колебания, которые передаются жидкости, заполняющей лестницу преддверия и барабанную лестницу (рис. 5-20 А). Гидравлическая энергия приводит к смещению базилярной мембраны, а вместе с ней и кортиева органа (рис. 5-20 Б). Сдвиговое усилие, развиваемое в результате смещения базилярной мембраны относительно текториальной мембраны, заставляет сгибаться стереоцилии волосковых клеток. Когда стереоцилии сгибаются в сторону самой длинной из них, волосковая клетка деполяризуется, когда они сгибаются в противоположную сторону - гиперполяризуется.
Такие изменения мембранного потенциала волосковых клеток обусловлены сдвигами катионной проводимости мембраны их верхушки. Градиент потенциала, определяющий вход ионов в волосковую клетку, складывается из потенциала покоя клетки и положительного заряда эндолимфы. Как отмечалось выше, суммарная трансмембранная разность потенциалов составляет примерно 140 mV. Сдвиг проводимости мембраны верхней части волосковой клетки сопровождается значительным ионным током, создающим рецепторный потенциал этих клеток. Показателем ионного тока является внеклеточно регистрируемый микрофонный потенциал улитки- колебательный процесс, частота которого соответствует характеристикам акустического стимула. Этот потенциал представляет собой сумму рецепторных потенциалов некоторого числа волосковых клеток.
Так же как фоторецепторы сетчатки, волосковые клетки высвобождают при деполяризации возбуждающий нейромедиатор (глутамат или аспартат). Под действием нейромедиатора возникает генераторный потенциал в окончаниях улитковых афферентных волокон, на которых волосковые клетки образуют синапсы. Итак, преобразование звука завершается тем, что колебания базилярной
мембраны приводят к периодическим разрядам импульсов в афферентных волокнах слухового нерва. Электрическую активность многих афферентных волокон можно зарегистрировать внеклеточно в виде составного потенциала действия.
Оказалось, что на звук определенной частоты отвечает только небольшое число улитковых афферентов. Возникновение ответа зависит от расположения афферентных нервных окончаний вдоль кортиева органа, поскольку при одной и той же частоте звука амплитуда смещений базилярной мембраны не одинакова в разных ее участках. Это отчасти обусловлено различиями ширины мембраны и ее напряжения вдоль кортиева органа. Раньше считалось, что разница резонансной частоты в разных участках базилярной мембраны объясняется различиями ширины и напряжения этих участков. Например, у основания улитки ширина базилярной мембраны 100 μm, а у верхушки - 500 μm. Кроме того, у основания улитки напряжение мембраны больше, чем у верхушки. Следовательно, участок мембраны около основания должен вибрировать с более высокой частотой, чем участок у верхушки, подобно коротким струнам музыкальных инструментов. Однако эксперименты показали, что базилярная мембрана колеблется как единое целое, по ней следуют бегущие волны. При высокочастотных тонах амплитуда волнообразных колебаний базилярной мембраны максимальна ближе к основанию улитки, а при низкочастотных - у верхушки. В действительности базилярная мембрана действует как частотный анализатор; стимул распределяется по ней вдоль кортиева органа таким образом, что волосковые клетки разной локализации отвечают на звуки разной частоты. Это заключение составляет основу теории места.Кроме того, расположенные вдоль кортиева органа волосковые клетки, настроены на разную частоту звука вследствие их биофизических свойств и особенностей стереоцилий. Благодаря этим факторам получается так называемая тонотопическая карта базилярной мембраны и кортиева органа.
Рис. 5-20. Кортиев орган

Периферический отдел вестибулярной системы
Вестибулярная система воспринимает угловое и линейное ускорения головы. Сигналы этой системы запускают движения головы и глаз, обеспечивающие стабильное зрительное изображение на сетчатке, а также коррекцию позы тела для поддержания равновесия.
Строение вестибулярного лабиринта
Так же как улитка, вестибулярный аппарат представляет собой перепончатый лабиринт, находящийся в костном лабиринте (рис. 5-21 А). На каждой стороне головы вестибулярный аппарат образован тремя полукружными каналами [горизонтальным, вертикальным передним (верхним)и вертикальным задним]и двумя отолитовыми органами.Все эти структуры погружены в перилимфу и заполнены эндолимфой. В состав отолитового органа входят утрикулус(utriculus - эллиптический мешочек, маточка) и саккулус(sacculus - сферический мешочек). Один конец каждого полукружного канала расширен в виде ампулы.Все полукружные каналы входят в утрикулус. Утрикулус и саккулус сообщаются между собой через соединяющий проток(ductus reuniens). От него берет началоэндолимфатический проток(ductus endolymphaticus), заканчивающийся эндолимфатическим мешком, образующим соединение с улиткой. Через это соединение в вестибулярный аппарат поступает эндолимфа, секретируемая сосудистой полоской улитки.
Каждый из полукружных каналов одной стороны головы расположен в той же плоскости, что и соответствующий ему канал другой стороны. Благодаря этому корреспондирующие участки сенсорного эпителия двух парных каналов воспринимают движения головы в любой плоскости. На рисунке 5-21 Б показана ориентация полукружных каналов по обе стороны головы; обратите внимание, что улитка находится рострально от вестибулярного аппарата и что верхушка улитки лежит латерально. Два горизонтальных канала по обе стороны головы образуют пару, так же как два вертикальных передних и два вертикальных задних канала. У горизонтальных каналов есть интересная особенность: они
находятся в плоскости горизонта при наклоне головы на 30°. Утрикулус ориентирован почти горизонтально, а саккулус - вертикально.
Ампула каждого полукружного канала содержит сенсорный эпителий в виде так называемого ампулярного гребешка(crista ampullaris) с вестибулярными волосковыми клетками (схема разреза через ампулярный гребешок представлена на рис. 5-21 В). Они иннервируются первичными афферентными волокнами вестибулярного нерва, составляющего часть VIII черепного нерва. Каждая волосковая клетка вестибулярного аппарата, подобно аналогичным клеткам улитки, несет на своей верхушке пучок стереоцилий (ресничек). Однако, в отличие от клеток улитки, вестибулярные волосковые клетки еще имеют одиночную киноцилию.Все реснички ампулярных клеток погружены в желеобразную структуру - купулу,которая располагается поперек ампулы, полностью перекрывая ее просвет. При угловом (вращательном) ускорении головы купула отклоняется; соответственно сгибаются реснички волосковых клеток. У купулы такой же удельный вес (плотность), как у эндолимфы, поэтому на нее не влияет линейное ускорение, создаваемое силой тяжести (гравитационное ускорение). На рисунке 5-21 Г, Д представлено положение купулы до поворота головы (Г) и во время поворота (Д).
Сенсорный эпителий отолитовых органов это пятно эллиптического мешочка(macula utriculi) и пятно сферического мешочка(macula sacculi) (рис. 5-21 Е). Каждая макула (пятно) выстлана вестибулярными волосковыми клетками. Их стереоцилии и киноцилия, так же как реснички волосковых клеток ампулы, погружены в желеобразную массу. Отличие желеобразной массы отолитовых органов в том, что она содержит многочисленные отолиты (мельчайшие «каменистые» включения) - кристаллы карбоната кальция (кальцита). Желеобразная масса вместе с ее отолитами называется отолитовой мембраной.За счет присутствия кристаллов кальцита удельный вес (плотность) отолитовой мембраны примерно в два раза выше, чем у эндолимфы, поэтому отолитовая мембрана легко сдвигается под действием линейного ускорения, создаваемого силой тяжести. Угловое ускорение головы к такому эффекту не приводит, поскольку отолитовая мембрана почти не выступает в просвет перепончатого лабиринта.
Рис. 5-21. Вестибулярная система.
А - строение вестибулярного аппарата. Б - вид сверху на основание черепа. Заметна ориентация структур внутреннего уха. Обратите внимание на пары контралатеральных полукружных каналов, находящиеся в одной плоскости (по два горизонтальных, верхних - передних и нижних - задних канала). В - схема разреза через ампулярный гребешок. Стереоцилии и киноцилия каждой волосковой клетки погружены в купулу. Положение купулы до поворота головы (Г) и во время поворота (Д). Е - строение отолитовых органов

Иннервация сенсорного эпителия вестибулярного аппарата
Тела клеток первичных афферентных волокон вестибулярного нерва располагаются в ганглии Scarpaе.Так же как нейроны спирального ганглия, это биполярные клетки; их тела и аксоны миелинизированы. Вестибулярный нерв посылает отдельную ветвь к каждой макуле сенсорного эпителия (рис. 5-22 А). Вестибулярный нерв идет вместе с улитковым и лицевым нервами во внутреннем слуховом проходе (meatus acusticus internus) черепа.
Вестибулярные волосковые клеткиделят на два типа (рис. 5-22 Б). Клетки I типа имеют форму колбы и образуют синаптические соединения с бокаловидными окончаниями первичных аффе-
рентов вестибулярного нерва. Клетки II типа цилиндрические, их синаптические контакты находятся на тех же первичных афферентах. Синапсы вестибулярных эфферентных волокон расположены на окончаниях первичных афферентов клеток I типа. С клетками II типа вестибулярные эфферентные волокна образуют прямые синаптические контакты. Такая организация аналогична рассмотренной выше при описании контактов афферентных и эфферентных волокон улиткового нерва с внутренними и наружными волосковыми клетками кортиева органа. Присутствием эфферентных нервных окончаний на клетках II типа может объясняться нерегулярность разрядов в афферентах этих клеток.
Рис. 5-22.
А - иннервация перепончатого лабиринта. Б - вестибулярные волосковые клетки I и II типов. На врезке справа: вид сверху на стереоцилии и киноцилии. Обратите внимание, где находятся контакты афферентных и эфферентных волокон

Преобразование (трансдукция) вестибулярных сигналов
Так же как у волосковых клеток улитки, мембрана вестибулярных волосковых клеток функционально поляризована. Когда стереоцилии сгибаются в сторону самой длинной реснички (киноцилии), возрастаеткатионнаяпроводимость мембраны верхушки клетки, и вестибулярная волосковая клетка деполяризуется (рис. 5-23 В). И наоборот, при наклоне стереоцилий в противоположную сторону происходит гиперполяризация клетки. Из волосковой клетки тонически (постоянно) высвобождается возбуждающий нейромедиатор (глутамат либо аспартат), так что афферентное волокно, на котором эта клетка образует синапс, генерирует импульсную активность спонтанно, при отсутствии сигналов. При деполяризация клетки увеличивается высвобождение нейромедиатора, и частота разряда в афферентном волокне возрастает. В случае гиперполяризации, наоборот, высвобождается меньшее количество нейромедиатора, и частота разряда снижается вплоть до полного прекращения импульсации.
Полукружные каналы
Как уже говорилось, при поворотах головы волосковые клетки ампулы получают сенсорную информацию, которую они направляют в
головной мозг. Механизм этого явления заключается в том, что угловые ускорения (повороты головы) сопровождаются сгибанием ресничек на волосковых клетках ампулярного гребешка и как следствие сдвигом мембранного потенциала и изменением количества высвобождаемого нейромедиатора. При угловых ускорениях эндолимфа в силу своей инерции смещается относительно стенки перепончатого лабиринта и давит на купулу. Сдвиговое усилие заставляет реснички сгибаться. Все реснички клеток каждого ампулярного гребешка ориентированы в одинаковом направлении. В горизонтальном полукружном канале реснички обращены к утрикулусу, в ампулах двух других полукружных каналов - от утрикулуса.
Изменения разряда афферентов вестибулярного нерва под действием углового ускорения можно обсудить на примере горизонтального полукружного канала. Киноцилии всех волосковых клеток обычно обращены к утрикулусу. Следовательно, при сгибании ресничек к утрикулусу частота афферентного разряда повышается, а при их сгибании от утрикулуса - снижается. При повороте головы налево эндолимфа в горизонтальных полукружных каналах смещается вправо. В результате реснички волосковых клеток левого канала сгибаются в сторону утрикулуса, а в правом канале - от утрикулуса. Соответственно частота разряда в афферентах левого горизонтального канала повышается, а в афферентах правого - уменьшается.
Рис. 5-23. Механические преобразования в волосковых клетках.
А - Волосковая клетка;
Б - Положительная механическая деформация; В - Отрицательная механическая деформация; Г - Механическая чувствительность волосковой клетки;
Д - функциональная поляризация вестибулярных волосковых клеток. При сгибании стереоцилий по направлению к киноцилии волосковая клетка деполяризуется и в афферентном волокне возникает возбуждение. При сгибании стереоцилий в сторону от киноцилии волосковая клетка гиперполяризуется и афферентный разряд ослабевает или прекращается

Мышечные рецепторы растяжения
Несколько важных спинальных рефлексов активируются мышечными рецепторами растяжения - мышечными веретенами и сухожильным аппаратом Гольджи. Это мышечный рефлекс на растяжение (миотатический рефлекс)и обратный миотатический рефлекс,нужные для поддержания позы.
Другой значимый рефлекс - сгибательный, вызывается сигналами от различных сенсорных рецепторов кожи, мышц, суставов и внутренних органов. Афферентные волокна, вызывающие этот рефлекс, часто называют афферентами сгибательного рефлекса.
Строение и функции мышечного веретена
Структура и функции мышечных веретен очень сложны. Они присутствуют в большинстве скелетных мышц, но их особенно много в мышцах, требующих тонкой регуляции движений (например, в мелких мышцах кисти). Что касается крупных мышц, то мышечных веретен больше всего в мышцах, содержащих много медленных фазических волокон (волокон I типа; slow twitch fibers).
Веретено состоит из пучка модифицированных мышечных волокон, иннервируемых и сенсорными, и двигательными аксонами (рис. 5-24 А). Диаметр мышечного веретена равен примерно 100 цм, длина - до 10 мм. Иннервированная часть мышечного веретена заключена в соединительнотканную капсулу. Так называемое лимфатическое пространство капсулы заполнено жидкостью. Мышечное веретено сво бодно располагается между обычными мышечными волокнами. Дистальный его конец прикреплен к эндомизию- соединительнотканной сети внутри мышцы. Мышечные веретена лежат параллельно обычным поперечнополосатым мышечным волокнам.
Мышечное веретено содержит модифицированные мышечные волокна, называемые интрафузальными мышечными волокнами,в отличие от обычных - экстрафузальных мышечных волокон.Интрафузальные волокна гораздо тоньше, чем экстрафузальные, и слишком слабы, чтобы участвовать в сокращении мышцы. Различают два типа интрафузальных мышечных волокон: с ядерной сумкой и с ядерной цепочкой (рис. 5-24 Б). Их названия связаны с организацией клеточных ядер. Волокна с ядерной сумкойкрупнее, чем волокна с
ядерной цепочкой, и их ядра плотно упакованы в средней части волокна наподобие сумки с апельсинами. В волоконах с ядерной цепочкойвсе ядра расположены в один ряд.
Мышечные веретена получают сложную иннервацию. Сенсорная иннервация состоит из одного афферентного аксона группы Iaи нескольких афферентов группы II(рис. 5-24 Б). Афференты группы Ia относят к классу сенсорных аксонов наибольшего диаметра со скоростью проведения от 72 до 120 м/с; аксоны группы II имеют промежуточный диаметр и проводят импульсы со скоростью от 36 до 72 м/с. Афферентный аксон группы Ia образует первичное окончание,спирально обвивающее каждое интрафузальное волокно. Первичные окончания есть на интрафузальных волокнах обоих типов, что важно для деятельности этих рецепторов. Афференты группы II образуют вторичные окончанияна волокнах с ядерной цепочкой.
Двигательную иннервацию мышечных веретен обеспечивают два типа γ-эфферентных аксонов (рис. 5-24 Б). Динамическиеγ-эфферентыоканчиваются на каждом волокне с ядерной сумкой, статическиеγ-эфференты- на волокнах с ядерной цепочкой. γ-Эфферентные аксоны тоньше, чем α-эфференты экстрафузальных мышечных волокон, поэтому они проводят возбуждение с меньшей скоростью.
Мышечное веретено реагирует на растяжение мышцы. На рисунке 5-24 В показано изменение активности афферентного аксона при переходе мышечного веретена от укороченного состояния во время сокращения экстрафузальных волокон к состоянию удлинения при растяжении мышцы. Сокращение экстрафузальных мышечных волокон заставляет мышечное веретено укорачиваться, поскольку оно лежит параллельно экстрафузальным волокнам (см. выше).
Активность афферентов мышечных веретен зависит от механического растяжения афферентных окончаний на интрафузальных волокнах. При сокращении экстрафузальных волокон мышечное волокно укорачивается, расстояние между витками афферентного нервного окончания уменьшается, и частота разряда в афферентном аксоне падает. И наоборот, когда вся мышца подвергается растяжению, мышечное веретено тоже удлиняется (потому что его концы прикреплены к соединительнотканной сети внутри мышцы), и растягивание афферентного окончания повышает частоту его импульсного разряда.
Рис. 5-24. Сенсорные рецепторы, ответственные за вызывание спинальных рефлексов.
А - схема мышечного веретена. Б - интрафузальные волокна с ядерной сумкой и ядерной цепочкой; их сенсорная и двигательная иннервация. В - изменения частоты импульсного разряда афферентного аксона мышечного веретена во время укорочения мышцы (при ее сокращении) (а) и во время удлинения мышцы (при ее растяжении) (б). В1 - во время сокращения мышцы нагрузка на мышечное веретено уменьшается, поскольку оно расположено параллельно обычным мышечным волокнам. В2 - при растяжении мышцы мышечное веретено удлиняется. Р - регистрирующая система
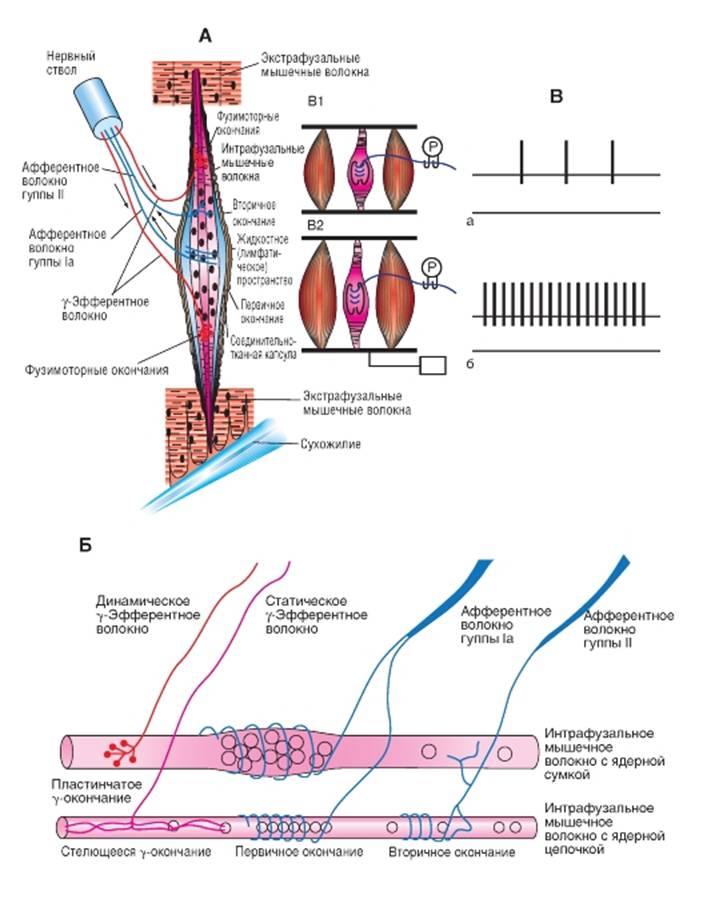
Мышечные рецепторы растяжения
Известен способ влияния афферентов на рефлекторную активность - через их взаимодействие с интрафузальными волокнами с ядерной сумкой и волокнами с ядерной цепочкой. Как упомянуто выше, есть два типа γ-мотонейронов: динамические и статические. Динамические двигательные γ-аксоны оканчиваются на интрафузальных волокнах с ядерной сумкой, а статические - на волокнах с ядерной цепочкой. При активации динамического γ-мотонейрона усиливается динамический ответ афферентов группы Ia (рис. 5-25 А4), а при активации статического γ-мотонейрона возрастают статические ответы афферентов обеих групп - Iа и II (рис. 5-25 А3), и одновременно может снижаться динамический ответ. Разные нисходящие пути оказывают предпочтительное влияние на динамические либо на статические γ-мотонейроны, изменяя таким образом характер рефлекторной активности спинного мозга.
Сухожильный аппарат Гольджи
В скелетных мышцахестьеще одинтипрецепторов растяжения - сухожильный аппарат Гольджи(рис. 5-25 Б). Рецептор диаметром около 100 μм и длиной примерно 1 мм образован окончаниями афферентов группы Ib - толстых аксонов с такой же скоростью проведения импульса, как и у афферентов группы Ia. Эти окончания обертываются вокруг пучков коллагеновых нитей в сухожилии мышцы (или в сухожильных включениях внутри мышцы). Чувствительное окончание сухожильного аппарата организовано по отношению к мышце последовательно, в отличие от мышечных веретен, лежащих параллельно экстрафузальным волокнам.
Благодаря своему последовательному расположению сухожильный аппарат Гольджи активируется или при сокращении, или при растяжении мышцы (рис. 5-25 В). Однако сокращение мышцы - более эффективный стимул, чем растяжение, поскольку стимулом для сухожильного аппарата служит сила, развиваемая сухожилием, в котором находится рецептор. Таким образом, сухожильный аппарат Гольджи - датчик силы, в отличие от мышечного веретена, подающего сигналы о длине мышцы и скорости ее изменения.
Рис. 5-25. Мышечные рецепторы растяжения.
А - влияние статических и динамических γ-мотонейронов на ответы первичного окончания при растяжении мышцы. А1 - временной ход растяжения мышцы. А2 - разряд аксона группы Ia при отсутствии активности γ-мотонейрона. А3 - ответ во время стимуляции статического γ-эфферентного аксона. А4 - ответ во время стимуляции динамического γ-эфферентного аксона. Б - схема расположения сухожильного аппарата Гольджи. В - активация сухожильного аппарата Гольджи во время растяжения мышцы (слева) или сокращения мышцы (справа)

Функционирование мышечных веретен
Частота разряда в афферентах группы Ia и группы II пропорциональна длине мышечного веретена; это заметно как во время линейного растяжения (рис. 5-26 А, слева), так и при расслаблении мышцы после растяжения (рис. 5-26 А, справа). Такую реакцию называютстатическим ответомафферентов мышечного веретена. Однако первичные и вторичные афферентные окончания отвечают на растяжение по-разному. Первичные окончания чувствительны и к степени растяжения, и к его скорости, тогда как вторичные окончания реагируют преимущественно на величину растяжения (рис. 5-26 А). Эти различия определяют характер активности окончаний двух типов. Частота разряда первичного окончания достигает максимума во время растяжения мышцы, а при расслаблении растянутой мышцы разряд прекращается. Реакцию такого типа называют динамическим ответомафферентных аксонов группы Ia. Ответы в центре рисунка (рис. 5-26 А) - это примеры динамических ответов первичного окончания. Постукивание по мышце (либо по ее сухожилию) или синусоидальное растяжение более эффективно вызывают разряд в первичном афферентном окончании, чем во вторичном.
Судя по характеру ответов, первичные афферентные окончания сигнализируют как о мышечной длине, так и о скорости ее изменения, а вторичные окончания передают информацию только о длине мышцы. Эти различия в поведении первичных и вторичных окончаний зависят в основном от разницы механических свойств интрафузальных волокон с ядерной сумкой и с ядерной цепочкой. Как указывалось выше, первичные и вторичные окончания есть на волокнах обоих типов, тогда как вторичные окончания расположены преимущественно на волокнах с ядерной цепочкой. Средняя (экваториальная) часть волокна с ядерной сумкой лишена сократительных белков из-за скопления клеточных ядер, поэтому эта часть волокна легко растягивается. Однако сразу после растяжения средняя часть волокна с ядерной сумкой стремится вернуться к своей исходной длине, хотя концевые части волокна удлиняются. Феномен, который
называется «оползание»,обусловлен вязкоупругими свойствами этого интрафузального волокна. В результате наблюдается вспышка активности первичного окончания с последующим ослаблением активности до нового статического уровня частоты импульсов.
В отличие от волокон с ядерной сумкой, у волокон с ядерной цепочкой длина изменяется в более близком соответствии с изменениями длины экстрафузальных мышечных волокон, потому что средняя часть волокон с ядерной цепочкой содержит сократительные белки. Следовательно, вязкоупругие характеристики волокна с ядерной цепочкой более однородны, оно не подвержено оползанию, и его вторичные афферентные окончания генерируют только статические ответы.
До сих пор мы рассматривали поведение мышечных веретен только при отсутствии активности γ-мотонейронов. Вместе с тем эфферентная иннервация мышечных веретен чрезвычайно значима, поскольку она определяет чувствительность мышечных веретен к растяжению. Например, на рис. 5-26 Б1 представлена активность афферента мышечного веретена во время постоянного растяжения. Как уже говорилось, при сокращении экстрафузальных волокон (рис. 5-26 Б2) мышечные веретена перестают испытывать нагрузку, и разряд их афферентов прекращается. Однако влиянию разгрузки мышечного веретена противодействует эффект стимуляции γ-мотонейронов. Такая стимуляция заставляет мышечное веретено укорачиваться вместе с экстрафузальными волокнами (рис. 5-26 Б3). Точнее, укорачиваются только два конца мышечного веретена; срединная (экваториальная) его часть, где находятся клеточные ядра, не сокращается из-за отсутствия сократительных белков. В результате срединная часть веретена удлиняется, так что афферентные окончания растягиваются и возбуждаются. Этот механизм очень важен для нормальной деятельности мышечных веретен, так как в результате нисходящих двигательных команд от головного мозга происходит, как правило, одновременная активация α- и γ-мотонейронов и, следовательно, сопряженное сокращение экстрафузальных и интрафузальных мышечных волокон.
Рис. 5-26. Мышечные веретена и их работа.
А - ответы первичного и вторичного окончания на разнообразные виды изменений длины мышцы; продемонстрированы различия динамических и статических ответов. Верхние кривые показывают характер изменений мышечной длины. Средний и нижний ряд записей - импульсные разряды первичных и вторичных нервных окончаний. Б - активация γ-эфферентного аксона противодействует эффекту разгрузки мышечного веретена. Б1 - импульсный разряд афферента мышечного веретена при постоянном растяжении веретена. Б2 - афферентный разряд прекратился во время сокращения экстрафузальных мышечных волокон, поскольку с веретена снята нагрузка. Б3 - активация γ-мотонейрона вызывает укорочение мышечного веретена, противодействующее эффекту разгрузки

Миотатический рефлекс, или рефлекс на растяжение
Рефлексу на растяжение принадлежит ключевая роль в поддержании позы. Кроме того, его изменения участвуют в реализации двигательных команд от головного мозга. Патологические нарушения этого рефлекса служат признаками неврологических заболеваний. Рефлекс проявляется в двух формах: фазический рефлекс на растяжение,запускается первичными окончаниями мышечных веретен, а тонический рефлекс на растяжениезависит как от первичных, так и от вторичных окончаний.
Фазический рефлекс на растяжение
Соответствующая рефлекторная дуга показана на рис. 5-27. Афферентный аксон группы Ia от мышечного веретена прямой мышцы бедра входит в спинной мозг и разветвляется. Его ветви поступают в серое вещество спинного мозга. Некоторые из них оканчиваются непосредственно (моносинаптически) на α-мотонейронах, посылающих двигательные аксоны к прямой мышце бедра (и к ее синергистам, таким, как промежуточная широкая мышца бедра), разгибающей ногу в колене. Аксоны группы Ia обеспечивают моносинаптическое возбуждение α-мотонейрона. При достаточном уровне возбуждения мотонейрон генерирует разряд, вызывающий сокращение мышцы.
Другие ветви аксона группы Ia образуют окончания на тормозных интернейронах группы Ia (такой интернейрон показан черным на рис. 5-27). Эти тормозные интернейроны оканчиваются на α-мотонейронах, иннервирующих мышцы, которые соединены с подколенным сухожилием (в том числе полусухожильную мышцу), - антагонистические мышцы-сгибатели колена. При возбуждении тормозных интернейронов Ia подавляется активность мотонейронов мышц-антагонистов. Таким образом, разряд (стимулирующая активность) афферентов группы Ia от мышечных веретен прямой мышцы бедра вызывает быстрое сокращение этой же мышцы и
сопряженное расслабление мышц, соединенных с подколенным сухожилием.
Рефлекторная дуга организована так, что обеспечивается активация определенной группы α-мотонейронов и одновременное торможение антагонистической группы нейронов. Это называется реципрокной иннервацией.Она свойственна многим рефлексам, но не единственно возможная в системах регуляции движений. В некоторых случаях двигательные команды вызывают сопряженное сокращение синергистов и антагонистов. Например, при сжимании кисти в кулак мышцыразгибатели и мышцы-сгибатели кисти сокращаются, фиксируя положение кисти.
Импульсный разряд афферентов группы Ia наблюдается, когда врач наносит неврологическим молоточком легкий удар по сухожилию мышцы, обычно четырехглавой мышцы бедра. Нормальная реакция - кратковременное мышечное сокращение.
Тонический рефлекс на растяжение
Этот вид рефлекса активируется пассивным сгибанием сустава. Рефлекторная дуга такая же, как у фазического рефлекса на растяжение (рис. 5-27), с той разницей, что участвуют афференты обеих групп - Ia и II. Многие аксоны группы II образуют моносинаптические возбуждающие связи с α-мотонейронами. Следовательно, тонические рефлексы на растяжение - в основном моносинаптические, так же как фазические рефлексы на растяжение. Тонические рефлексы на растяжение вносят вклад в мышечный тонус.
γ-Мотонейроны и рефлексы на растяжение
γ-Мотонейроны регулируют чувствительность рефлексов на растяжение. Афференты мышечных веретен не оказывают прямого влияния на γ-мотонейроны, которые активируются полисинаптически только афферентами сгибательного рефлекса на спинальном уровне, а также нисходящими командами из головного мозга.
Рис. 5-27. Миотатический рефлекс.
Дуга рефлекса на растяжение. Интернейрон (показан черным) относится к тормозным интернейронам группы Ia

Обратный миотатический рефлекс
Активация сухожильного аппарата Гольджи сопровождается рефлекторной реакцией, которая на первый взгляд противоположна рефлексу на растяжение (на самом деле эта реакция дополняет рефлекс на растяжение). Реакцию называют обратным миотатическим рефлексом;соответствующая рефлекторная дуга представлена на рис. 5-28. Сенсорные рецепторы этого рефлекса - сухожильный аппарат Гольджи в прямой мышце бедра. Афферентные аксоны входят в спинной мозг, разветвляются и образуют синаптические окончания на интернейронах. Путь от сухожильного аппарата Гольджи не имеет моносинаптической связи с α-мотонейронами, а включает в себя тормозные интернейроны, подавляющие активность α-мотонейронов прямой мышцы бедра, и возбуждающие интернейроны, которые вызывают активность α-мотонейронов мышц-антагонистов. Таким образом, по своей организации обратный миотатический рефлекс противоположен рефлексу на растяжение, откуда и произошло название. Однако в действительности обратный миотатический рефлекс функционально дополняет рефлекс на растяжение. Сухожильный аппарат Гольджи служит датчиком силы, развиваемой сухожилием, с которым он соединен. Когда при поддержании стабильной
позы (например, человек стоит в положении «смирно») прямая мышцы бедра начинает утомляться, прилагаемая к коленному сухожилию сила уменьшается и, следовательно, снижается активность соответствующих сухожильных рецепторов Гольджи. Поскольку обычно эти рецепторы подавляют активность α-мотонейронов прямой мышцы бедра, ослабление импульсных разрядов от них приводит к повышению возбудимости α-мотонейронов, и сила, развиваемая мышцей, возрастает. В итоге происходит координированное изменение рефлекторных реакций с участием как мышечных веретен, так и афферентных аксонов сухожильного аппарата Гольджи, сокращение прямой мышцы усиливается, и поза сохраняется.
При чрезмерной активации рефлексов можно наблюдать рефлекс «складного ножа». Когда сустав пассивно сгибается, сопротивление такому сгибанию сначала увеличивается. Однако по мере дальнейшего сгибания сопротивление внезапно падает, и сустав резко переходит в свое конечное положение. Причина этого - рефлекторное торможение. Раньше рефлекс складного ножа объясняли активацией сухожильных рецепторов Гольджи, поскольку считалось, что у них высокий порог реакции на мышечное растяжение. Однако теперь рефлекс связывают с активацией других высокопороговых мышечных рецепторов, находящихся в мышечной фасции.
Рис. 5-28. Обратный миотатический рефлекс.
Дуга обратного миотатического рефлекса. Участвуют как возбуждающие интернейроны, так и тормозные

Сгибательные рефлексы
Афферентное звено сгибательных рефлексов начинается от нескольких типов рецепторов. При сгибательных рефлексах афферентные разряды приводят к тому, что, во-первых, возбуждающие интернейроны вызывают активацию α-мотонейронов, снабжающих мышцы-сгибатели ипсилатеральной конечности, и, во-вторых, тормозные нейроны не позволяют активироваться α-мотонейронамантагонистических мышц-разгибателей (рис. 5-29). Вследствие этого один или несколько суставов сгибаются. Кроме того, комиссуральные интернейроны вызывают функционально противоположную активность мотонейронов на контралатеральной стороне спинного мозга, так что осуществляется разгибание мышцы - перекрестный разгибательный рефлекс. Такой контралатеральный эффект помогает поддерживать равновесие тела.
Есть несколько типов сгибательных рефлексов, хотя характер соответствующих им мышечных сокращений близок. Важный этап локомоции - фаза сгибания, которую можно рассматривать как сгибательный рефлекс. Он обеспечивается главным образом нейронной сетью спинного
мозга, называемой генератором локомоторного
цикла.Однако под влиянием афферентного входа локомоторный цикл может адаптироваться к сиюминутным изменениям опоры конечностей.
Самый мощный сгибательный рефлекс - это сгибательный рефлекс отдергивания.Он преобладает над другими рефлексами, в том числе локомоторными, видимо, по той причине, что предупреждает дальнейшее повреждение конечности. Этот рефлекс можно наблюдать, когда идущая собака поджимает пораненную лапу. Афферентное звено рефлекса образовано ноцицепторами.
При этом рефлексе сильный болевой стимул заставляет конечность отдернуться. На рисунке 5-29 представлена нейронная сеть конкретного сгибательного рефлекса для коленного сустава. Однако в действительности при сгибательном рефлексе происходит значительная дивергенция сигналов первичных афферентов и интернейронных путей, благодаря которой в рефлекс отдергивания могут вовлекаться все основные суставы конечности (бедренный, коленный, голеностопный). Особенности сгибательного рефлекса отдергивания в каждом конкретном случае зависят от природы и локализации стимула.
Рис. 5-29. Сгибатеый рефлекс
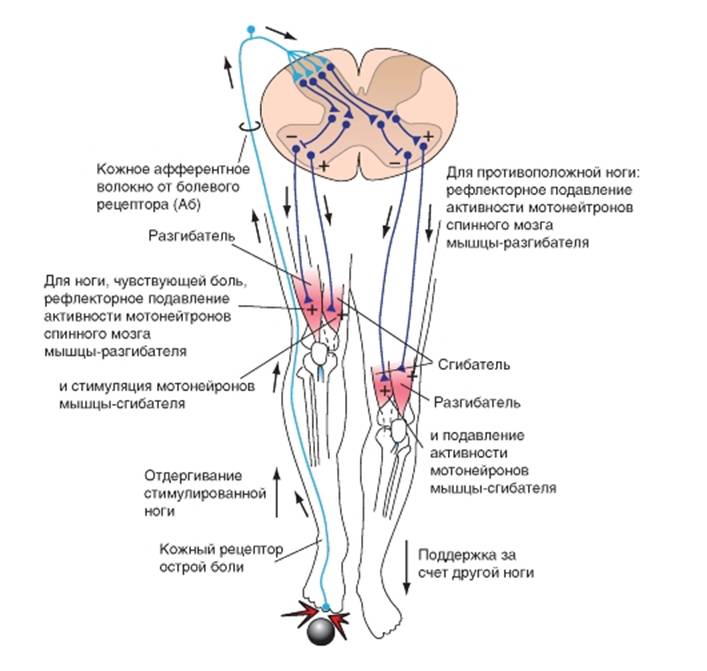
Симпатический отдел вегетативной нервной системы
Тела преганглионарных симпатических нейронов сосредоточены в промежуточном и боковом сером веществе(интермедиолатеральном столбе)грудных и поясничных сегментов спинного мозга (рис. 5-30). Некоторые нейроны обнаружены в сегментах С8. Наряду с локализацией в интермедиолатеральном столбе обнаружена локализация преганглионарных симпатических нейронов также в боковом канатике, промежуточной области и пластине Х (дорсальнее центрального канала).
У большинства преганглионарных симпатических нейронов тонкие миелинизированные аксоны - B-волокна. Однако некоторые аксоны относятся к немиелинизированным С-волокнам. Преганглионарные аксоны покидают спинной мозг в составе переднего корешка и через белые соединительные ветви входят в паравертебральный ганглий на уровне того же сегмента. Белые соединительные ветви имеются только на уровнях T1-L2. Преганглионарные аксоны оканчиваются синапсами в этом ганглии или, пройдя через него, входят в симпатический ствол (симпатическую цепочку) паравертебральных ганглиев либо во внутренностный нерв.
В составе симпатической цепочки преганглионарные аксоны направляются рострально либо каудально к ближайшему или удаленному превертебральному ганглию и там образуют синапсы. Выйдя из ганглия, постганглионарные аксоны идут к спинальному нерву обычно через серую соединительную ветвь, которая есть у каждого из 31 пары спинальных нервов. В составе периферических нервов постганглионарные аксоны поступают к эффекторам кожи (пилоэректорным мышцам, кровеносным сосудам, потовым железам), мышц, суставов. Как правило, постганглионарные аксоны немиелинизированы (С-волокна), хотя есть исключения. Различия между белыми и серыми соединительными ветвями зависят от относительного содержания
в них миелинизированных и немиелинизированных аксонов.
В составе внутренностного нерва преганглионарные аксоны часто идут к превертебральному ганглию, где образуют синапсы, либо они могут проходить через ганглий, оканчиваясь в более удаленном ганглии. Некоторые преганглионарные аксоны, идущие в составе внутренностного нерва, оканчиваются непосредственно на клетках мозгового вещества надпочечников.
Симпатическая цепочка тянется от шейного до копчикового уровня спинного мозга. Она выполняет функцию распределительной системы, позволяя преганглионарным нейронам, расположенным только в грудных и верхних поясничных сегментах, активировать постганглионарные нейроны, снабжающие все сегменты тела. Однако паравертебральных ганглиев меньше, чем спинальных сегментов, так как некоторые ганглии сливаются в процессе онтогенеза. Например, верхний шейный симпатический ганглий состоит из слившихся ганглиев С1-С4, средний шейный симпатический ганглий - из ганглиев С5-С6, а нижний шейный симпатический ганглий - из ганглиев С7-С8. Звездчатый ганглий образован слиянием нижнего шейного симпатического ганглия с ганглием Т1. Верхний шейный ганглий обеспечивает постганглионарную иннервацию головы и шеи, а средний шейный и звездчатый ганглии - сердца, легких и бронхов.
Обычно аксоны преганглионарных симпатических нейронов распределяются к ипсилатеральным ганглиям и, следовательно, регулируют вегетативные функции на той же стороне тела. Важное исключение - двусторонняя симпатическая иннервация кишечника и органов таза. Так же как двигательные нервы скелетных мышц, аксоны преганглионарных симпатических нейронов, относящиеся к определенным органам, иннервируют несколько сегментов. Так, преганглионарные симпатические нейроны, обеспечивающие симпатические функции областей головы и шеи, находятся в сегментах С8-Т5, а относящиеся к надпочечникам - в Т4-Т12.
Рис. 5-30. Вегетативная симпатическая нервная система.
А - основные принципы. Рефлекторную дугу см. на рис. 5-9 Б
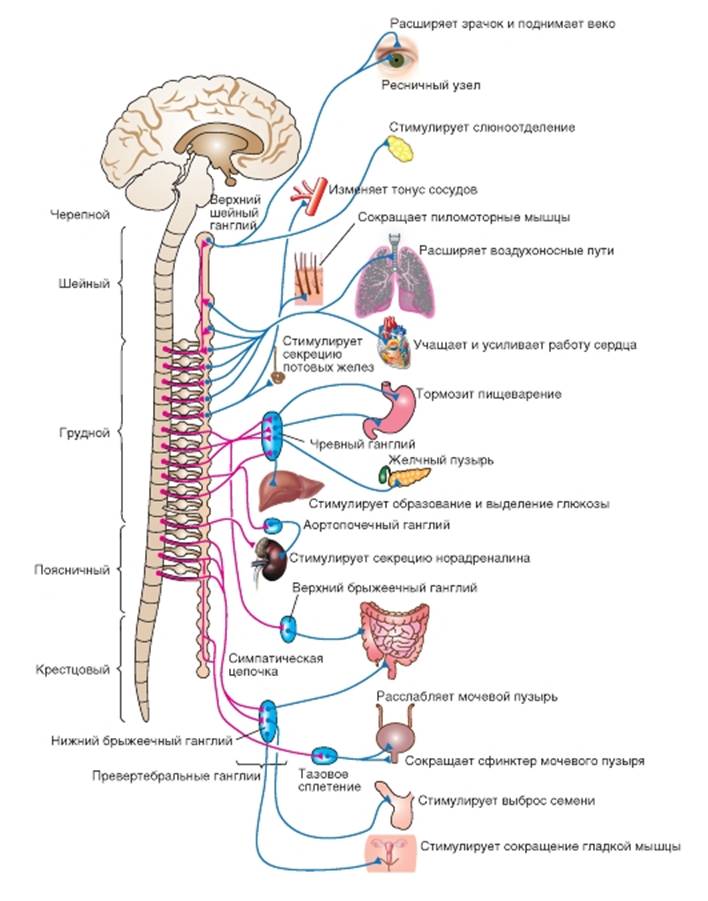
Парасимпатический отдел вегетативная нервной системы
Преганглионарные парасимпатические нейроны лежат в стволе мозга в нескольких ядрах черепных нервов - в глазодвигательном ядре Вестфаля-Эдингера(III черепной нерв), верхнем(VII черепной нерв) и нижнем(IX черепной нерв) слюноотделительных ядрах,а также дорсальном ядре блуждающего нерва(nucleus dorsalis nervi vagi) и двойном ядре(nucleus ambiguus) Х черепного нерва. Кроме того, такие нейроны есть в промежуточной области крестцовых сегментов S3-S4 спинного мозга. Постганглионарные парасимпатические нейроны находятся в ганглиях черепных нервов: в ресничном узле (ganglion ciliare), получающем преганглионарный вход от ядра Вестфаля-Эдингера; в крылонёбном узле (ganglion pterygopalatinum) и поднижнечелюстном узле (ganglion submandibulare)с входами от верхнего слюноотделительного ядра (nucleus salivatorius superior); в ушном узле (ganglion oticum) с входом от нижнего слюноотделительного ядра (nucleus salivatorius inferior). Цилиарный ганглий иннервирует мышцу-сфинктер зрачка и цилиарные мышцы глаза. От крылонёбного ганглия идут аксоны к слезным железам, а также к железам носовой и ротовой части глотки. Нейроны поднижнечелюстного ганглия проецируются к подчелюстной и подъязычной слюнным железам и железам ротовой полости. Ушной ганглий снабжает околоушную слюнную железу и ротовые железы
(рис. 5-31 А).
Другие постганглионарные парасимпатические нейроны расположены поблизости от внутренних органов грудной, брюшной и тазовой полости либо в стенках этих органов. Некоторые клетки энтерального сплетения тоже можно рассматривать
как постганглионарные парасимпатические нейроны. Они получают входы от блуждающего или тазового нервов. Блуждающий нерв иннервирует сердце, легкие, бронхи, печень, поджелудочную железу и весь желудочно-кишечный тракт от пищевода до селезеночного изгиба толстой кишки. Остальная часть толстой кишки, прямая кишка, мочевой пузырь и половые органы снабжаются аксонами крестцовых преганглионарных парасимпатических нейронов; эти аксоны распределяются через посредство тазовых нервов к постганглионарным нейронам тазовых ганглиев.
Преганглионарные парасимпатические нейроны, дающие проекции к внутренним органам грудной полости и части брюшной, расположены в дорсальном двигательном ядре блуждающего нерва и в двойном ядре. Дорсальное двигательное ядро выполняет главным образом секретомоторную функцию(активирует железы), тогда как двойное ядро - висцеромоторную функцию(регулирует деятельность сердечной мышцы). Дорсальное двигательное ядро снабжает висцеральные органы шеи (глотку, гортань), грудной полости (трахею, бронхи, легкие, сердце, пищевод) и брюшной полости (значительную часть желудочно-кишечного тракта, печень, поджелудочную железу). Электрическое раздражение дорсального двигательного ядра вызывает секрецию кислоты в желудке, а также секрецию инсулина и глюкагона в поджелудочной железе. Хотя проекции к сердцу анатомически прослежены, их функции не ясны. В двойном ядре различают две группы нейронов:
- дорсальную группу, активирует поперечнополосатые мышцы мягкого нёба, глотки, гортани и пищевода;
- вентролатеральную группу, иннервирует сердце, замедляя его ритм.
Рис. 5-31. Вегетативная парасимпатическая нервная система.
А - основные принципы

Вегетативная нервная система
Вегетативную нервную системуможно рассматривать как часть двигательной (эфферентной) системы. Только вместо скелетных мышц эффекторами вегетативной нервной системы служат гладкая мускулатура, миокард и железы. Поскольку вегетативная нервная система обеспечивает эфферентное управление висцеральными органами, ее часто в зарубежной литературе называют висцеральной или автономной нервной системой.
Важный аспект деятельности вегетативной нервной системы - содействие в поддержании постоянства внутренней среды организма(гомеостаза).Когда от висцеральных органов поступают сигналы о необходимости отрегулировать внутреннюю среду, ЦНС и ее вегетативный эффекторный участок посылают соответствующие команды. Например, при внезапном повышении системного кровяного давления активируются барорецепторы, в результате чего вегетативная нервная система запускает компенсаторные процессы и восстанавливается нормальное давление.
Вегетативная нервная система участвует и в адекватных координированных реакциях на внешние стимулы. Так, она помогает регулировать величину зрачка в соответствии с освещенностью. Чрезвычайный случай вегетативной регуляции - ответ «борьба или бегство», возникающий при активировании симпатической нервной системы угрожающим стимулом. При этом включаются разнообразные реакции: высвобождение гормонов из надпочечников, повышение сердечного ритма и артериального давления, расширение бронхов, угнетение кишечной моторики и секреции, усиление метаболизма глюкозы, расширение зрачков, пилоэрекция, сужение кожных и висцеральных кровеносных сосудов, расширение сосудов скелетных мышц. Следует учесть, что ответ «борьба или бегство» нельзя считать рядовым, он выходит за рамки обычной деятельности симпатической нервной системы при нормальном существовании организма.
В периферических нервах вместе с вегетативными эфферентными волокнами следуют афферентные волокна от сенсорных рецепторов висцеральных органов. Сигналами от многих из этих рецепторов запускаются рефлексы, но активация некоторых рецепторов вызывает
ощущения - боль, голод, жажду, тошноту, чувство наполнения внутренних органов. К висцеральной чувствительности можно еще отнести химическую чувствительность.
Вегетативную нервную систему обычно подразделяют на симпатическуюи парасимпатическую.
Функциональная единица симпатической и парасимпатической нервной системы- двухнейронный эфферентный путь, состоящий из преганглионарного нейрона с клеточным телом в ЦНС и постганглионарного нейрона с клеточным телом в автономном ганглии. В состав энтеральной нервной системы входят нейроны и нервные волокна миоентерального и подслизистого сплетений в стенке желудочно-кишечного тракта.
Симпатические преганглионарные нейроны находятся в грудном и верхнем поясничном сегментах спинного мозга, поэтому о симпатической нервной системе иногда говорят как о тораколюмбальном отделе автономной нервной системы. Иначе устроена парасимпатическая нервная система: ее преганглионарные нейроны лежат в стволе мозга и в крестцовом отделе спинного мозга, так что иногда ее называют краниосакральным отделом. Симпатические постганглионарные нейроны обычно расположены в паравертебральных или превертебральных ганглиях на расстоянии от органа-мишени. Что касается парасимпатических постганглионарных нейронов, то они находятся в парасимпатических ганглиях вблизи от исполнительного органа или непосредственно в его стенке.
Регулирующее влияние симпатической и парасимпатической нервной системы у многих организмов часто описывается как взаимно антагонистическое, однако это не совсем верно. Точнее будет рассматривать эти два отдела системы автономной регуляции висцеральных функций как действующие координированно: иногда - реципрокно, а иногда - синергично. Кроме того, не все висцеральные структуры получают иннервацию от обеих систем. Так, гладкие мышцы и кожные железы, а также большинство кровеносных сосудов иннервируются только симпатической системой; парасимпатическими нервами снабжаются немногие сосуды. Парасимпатическая система не иннервирует сосуды кожи и скелетных мышц, а снабжает лишь структуры головы, грудной и брюшной полости, а также малого таза.
Рис. 5-32. Вегетативная (автономная) нервная система (табл. 5-2)
Таблица 5-2.Реакции эффекторных органов на сигналы от вегетативных нервов *

Окончание табл. 5-2.

1 Прочерк означает, что функциональная иннервация органа не обнаружена.
2 Значки «+» (от одного до трех) указывают, насколько важна активность адренергических и холинергических нервов в регуляции конкретных органов и функций.
3 In situ преобладает расширение, обусловленное метаболической авторегуляцией.
4 Физиологическая роль холинергической вазодилатации в указанных органах спорна.
5 В диапазоне физиологических концентраций адреналина, циркулирующего в крови, у сосудов скелетной мускулатуры и печени преобладает опосредуемая β-рецепторами реакция расширения, а у сосудов других органов брюшной полости - реакция сужения, опосредуемая α-рецепторами. В сосудах почек и брыжейки есть, кроме того, специфические дофаминовые рецепторы, опосредующие расширение, которое, однако, не играет большой роли во многих физиологических реакциях.
6 Холинергическая симпатическая система вызывает вазодилатацию в скелетной мускулатуре, но этот эффект не участвует в большинстве физиологических реакций.
7 Существует предположение, что адренергическими нервами снабжаются тормозные β-рецепторы в гладких мышцах
и тормозные α-рецепторы на парасимпатических холинергических (возбуждающих) ганглионарных нейронах сплетения Ауэрбаха.
8 В зависимости от фазы менструального цикла, от концентрации в крови эстрогена и прогестерона, а также от других факторов.
9 Потовые железы ладоней и некоторых других областей тела («адренергическое потоотделение»).
10 Типы рецепторов, опосредующих определенные метаболические ответы, существенно варьируют у животных разных видов.
Дата добавления: 2018-08-06; просмотров: 2602; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
