Расчет равновесного потенциала для ионов 7 страница
STX, подобно TTX, относится к блокаторам активации Na+-каналов и известен так же, как паралитический яд моллюска (PSP: paralytic shellfish
poison). Этот токсин, найденный в некоторых моллюсках, членистоногих, иглокожих и некоторых других морских животных, заглатывающих протистов (простейших одноклеточных организмов), главным образом Dinoflagellata - одноклеточный организм в морском планктоне, который содержит яд. Кроме того, STX представляет собой продукт некоторых пресноводных Cyanobacteria. Этим способом фильтрующие корм ракушки, рыбы или моллюски становятся ядовитыми и могут вызвать паралитическое ракушечно-рыбное отравление при потреблении пищи домашними животными и человеком.
TTX и STX, возможно, наиболее специфичные токсины для Na+-каналов. В большинстве случаев связывание быстро обратимо (секунды и минуты) и высокоафинно. Их равновесная константа диссоциации Kd лежит в диапазоне 1-10 нМ для изоформ скелетной мышцы или нервных клеток, а для менее чувствительных сердечных Na+- каналов - в диапазоне нескольких мкМ. Два гуанидиновых токсина и их структурные аналоги оказались ценными инструментами как для исследования формы и структуры внешнего устья, так и для моделирования TTX- и STX-связываю- щего участка. Изучение связывания с STX предполагает, что также β1-субъединица участвует в формировании TTX/STX связывающего участка. На рисунке 1-62 показано ингибирующее действие TTX на Na+-ток.
|
|
|
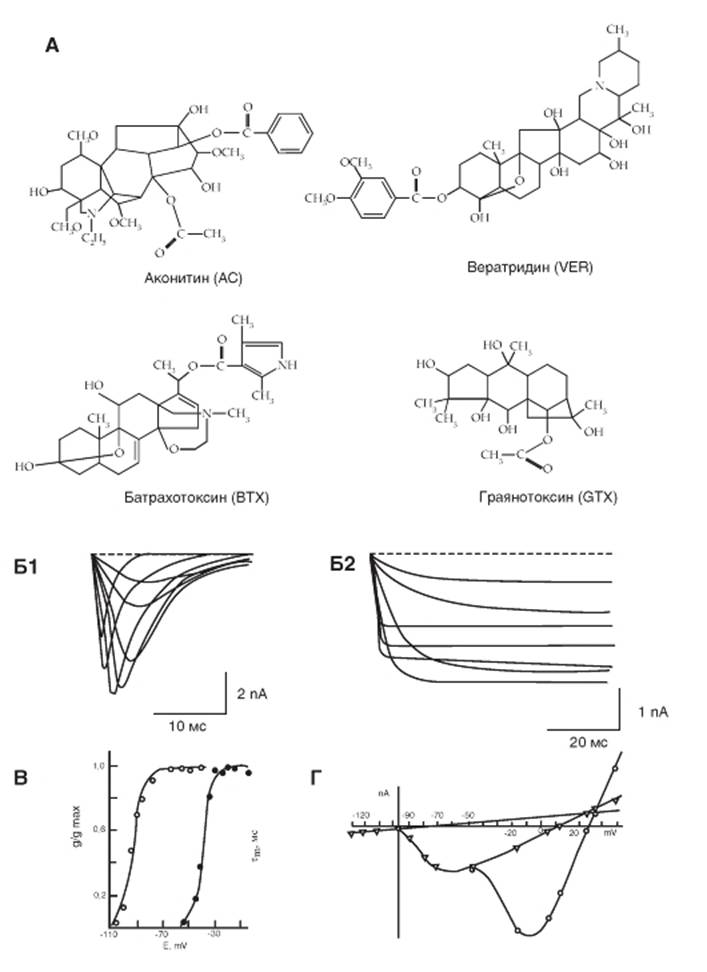
Рис. 1-62. Блокаторы участка связывания 1 тетродотоксин, сакситоксин и μ-конотоксин, блокирующие проводимость ионов.
А - химическая структура блокаторов поры Na+-каналов - тетродотоксина и сакситоксина. Б - типичное блокирующее действие тетродотоксина на Na+ток. Суммарный ток, включающий входящий Na+-ток и выходящий ток, возникающий при разных ступенях деполяризации относительно поддерживаемого потенциала (Б1). Полное ингибирование входящего Na+-тока тетродотоксином в концентрации 300 нМ (Б2)

Центр связывания 2 у Na+-канала
Представители группы липидорастворимых соединений могут получить доступ к определенному центру связывания Na+-канала, находящегося в плазматической мембране. Эта группа соединений включает алкалоиды подобно BTX, AC, VER и GTX. Они связываются с участком связывания 2 у Na+-каналов. Все эти токсины существуют в природе: BTX секретируется кожей колумбийской ядовитой лягушки рода Phyllobates, а другие три токсина имеют растительное происхождение. VER изолирован из алкалоидной смеси чемерицы - растения семейства Liliaceae. AC - алкалоид, вырабатываемый растением Aconitum napellus. GTX найден в рододендронах и других растениях семейства Вересковые (рис. 1-63 А).
Прежде всего, рассмотрим феноменологическую сторону нейротоксического действия BTX, VER, AC и GTX на мембраны клеток в виде первых наиболее простых экспериментов, выполненных с использованием этих соединений.
|
|
|
BTX можно рассматривать как полный агонист, так как при воздействии он вызывает одновременное изменение всех основных свойств Na+-каналов. Кроме двух выше упомянутых эффектов,
BTX ухудшает проводимость одиночных каналов и их селективность для ионов.
На рисунке 1-63 Б1 показано развитие во времени Na+-токов, текущих через Na+-каналы в клетках гибридной линии нейробластома-глиома, перфузируемых стандартным раствором, а затем (рис. 1-63 Б2) продемонстрированы Na+-токи, текущие через Na+-каналы в условиях перфузии клетки раствором, содержащим BTX в концентрации 5х10-6 М. Очевидно отсутствие фазы инактивации тока.
Далее показано (рис. 1-63 В) смещение влево примерно на 50 мВ активационной кривой под действием BTX в концентрации 5х10-6 М. Это смещение было меньше в клетках миокарда новорожденных крысят (приблизительно на 30 мВ).
На рисунке 1-63 Г представлены вольтамперные характеристики перехвата Ранвье, причем в первом случае перехват Ранвье находился в стандартном перфузионном растворе, а во втором случае - в растворе, содержащем BTX. Одна кривая построена по пиковым значениям интактного Na+-тока, а другая представляет собой вольтамперную кривую для модифицированных (треугольники) и интактных (кружочки) каналов.
|
|
|
Рис. 1-63. Блокаторы участка связывания 2 - батрахотоксин, вератридин, граянотоксин и аконитин, - эффект которых определяется постоянной активациейNa+-канала.
А - химическая структура токсинов, повышающих активацию натриевых каналов, - аконитина, вератридина, батрахотоксина и граянотоксина. Б - влияние батрахотоксина на Na+^оки у клеток нейробластомы. Б1 - Na+-токи, текущие через Na+-каналы в клетках нейробластомы, перфузируемых стандартным раствором. Поддерживаемый потенциал Ehp = -100 мВ. Тестируемые ступеньки деполяризации от Ehp до -45, -40, -35, -20, +15 мВ. Б2 - Na+-токи, текущие через Na+-каналы в клетках нейробластомы, перфузируемых стандартным раствором, содержащим батрахотоксин в концентрации 5х10-6 М через 30 мин после начала перфузии. Поддерживаемый потенциал Ehp = -110 мВ. Тестируемые ступеньки деполяризации от Ehp до -90, -85, -75, -65, -40, -35, -25 мВ. (Примечание: при экспериментах использовали гибридную линию нейробластомы-глиомы NG 108-15.) В - влияние батрахотоксина в концентрации 5х10-6М через 30 мин на активационную кривую у клеток нейробластомы. Черные кружечки - контроль, белые кружечки - влияние соединения. Г - вольтамперные характеристики, полученные для перехвата Ранвье, находящегося в стандартном перфузионном растворе (Г1). Вольтамперные характеристики, полученные для перехвата Ранвье, находящегося в стандартном перфузионном растворе, содержащем 2х10-5 М батрахотоксина (Г2). В обоих случаях кривые построены по пиковым (кружочки) и стационарным (треугольники) значениям мембранных токов. Изменение тока утечки демонстрирует прямая линия
|
|
|
Центр связывания 3 у Na+-канала
Участок связывания 3 взаимодействует с полипептидами α-токсина скорпиона и токсинов морских анемон (ATX), выделенных приблизительно 25 лет назад. Сначала они были известны как сердечные стимуляторы и нейротоксины. Механизм их действия - связывание с Na+-каналами возбудимых тканей и селективное ингибирование их инактивации, преимущественно за счет ингибирования переходов канала от открытого состояния в инактивированное состояние.
Фармакологические свойства токсинов морских анемон (или актиний) хорошо изучены. Это полипептиды с молекулярной массой от 3 до 300 кДа, изолированные из щупальца морской анемоны. Токсины, изолированные из представителей родов Anthopleura (anthopleurin:Ap-A или Ap-B) и Anemonia (ATX I, II или V), представлены относительно большими белками, классифицируемыми как токсины типа I морской анемоны. Для проявления их действия на Na+-каналы они должны быть апплицированы с внеклеточной стороны. Как было обсуждено выше, согласно современным представлениям о структуре Na+-каналов домены, которые, как известно, связаны с инактивацией, в основном расположены внутриклеточно. Тот факт, что токсины
морской анемоны модифицируют инактивацию, хотя они действуют с внеклеточной стороны, делает их перспективными для использования в качестве зондов при исследовании Na+-каналов.
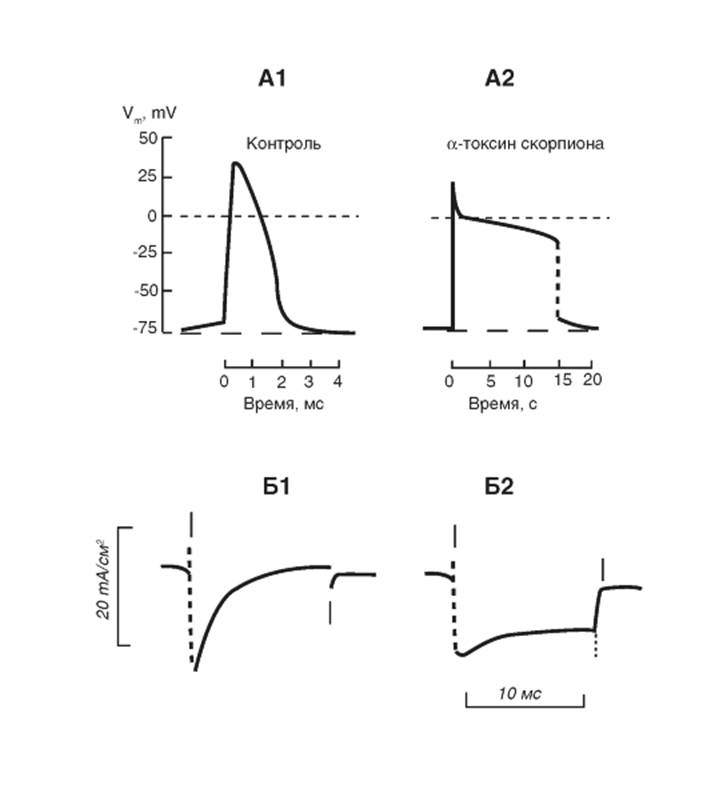
На рисунке 1-64 А продемонстрирован потенциал действия перехвата Ранвье миелинизированного нерва лягушки в стандартном перфузионном растворе (рис. 1-64 А1) и после применения скорпиона (Leiurus quinquestriatus) в концентрации 1 мкг/мл (рис. 1-64 А2).
Далее показан (рис. 1-64 Б) Na+-ток перехвата Ранвье до (Б1) и после (Б2) применения α-токсина скорпиона (Leiurus quinquestriatus).Наблюдается резкое замедление натриевой инактивации.
α-Токсины скорпиона вырабатываются североафриканскими скорпионами, относящимися к родам Androctonus, Buthus и Leiurus. α-Токсин V скорпиона, изолированный из яда Leiurus quinquestriatus, взаимодействует с нейротоксиновым рецепторным участком 3 у Na+-канала. Это связывание сильно зависит от потенциала и замедляет или блокирует инактивацию Na+-канала. α-Токсины скорпиона также аллостерически усиливают постоянную активацию теми нейротоксинами, которые связываются с участком 2, как, например, BTX. Структура нескольких токсинов из яда соответствующего скорпиона была определена методом рентгено-структурного анализа.
Рис. 1-64. Участок 3 связывает α-токсины скорпиона и токсины морских анемон, которые замедляют или блокируют инактивацию. Соединения, связывающиеся на этом участке, также увеличивают постоянную активации Na+-каналов, вызванную токсинами, действующими на рецептор участка 2.
А - влияние яда скорпиона (Leiurus quinquestriatus) на потенциал действия перехвата Ранвье. А1 - потенциал действия перехвата Ранвье миелинизированного нерва лягушки в стандартном перфузионном растворе. А2 - потенциал действия через 5 мин после применения 1 мкг/мл токсина. Потенциал действия был вызван дополяризационным током длительностью 100 мкс. Б - Na+-ток перехвата Ранвье до (Б1) и после (Б2) применения α-токсина скорпиона (Leiurus quinquestriatus)
Центр связывания местных анестетиков у Na+-канала
Местные анестетики (рис. 1-65) типа лидокаина и прокаина вызывают эффект, блокируя Na+-каналы. Показано, что, кроме Na+-каналов, местные анестетики действуют на несколько типов ионных каналов из числа К+-каналов и Ca2+-каналов, а также на рецепторы к нейротрансмиттерам. Все они представлены относительно небольшими липидорастворимыми молекулами, обычно содержащими аминогруппы, которые становятся положительно заряженными в кислой среде. Позднее информация относительно того, как работают местные анестетики, была получена на основании экспериментов с веществом QX-314, аналогом лидокаина, который всегда положительно заряжен и, следовательно, не растворим в липидах. Препарат QX-314В оказывает блокирующее действие на Na+-каналы клеток сердца при аппликации как с наружной, так и с внутренней стороны мембраны, но ингибирование Na+-каналов клеток мозга происходит только когда препарат апплицирован с внутриклеточной стороны. Различие в действии постоянно заряженных местных анестетиков, подобных QX-314, показано для Na+-каналов клеток сердца, мозга и для афферентных нейронов, расположенных в ганглиях задних корешков спинного мозга. Изучение широкого спектра разнообразных клеток in vitro с применением методов patch-clampв конфигурации whole-cell, экспрессии α-субъединицы Na+-каналов в ооциты шпорцевой лягушки (Xenopus laevis) или клетки млекопитающих позволило обнаружить ингибирование Na+-каналов, когда они находятся в открытом состоянии (use(-state)-dependent).Действие местных анестетиков увеличивалось, когда поддерживаемые потенциалы устанавливали в области большей деполяризации, тогда как при поддерживаемых потенциалах, лежащих в области большей гиперполяризации, блокирующее действие уменьшалось.
Были многочисленные попытки охарактеризовать участок связывания местных анестетиков. В результате нескольких исследований было показано наличие дозозависимого эффекта при
связывании VER и BTX и местных анестетиков, что предлагает аллостерическое взаимодействие этих двух участков связывания. Вне участка связывания 2 нет взаимодействия местных анестетиков с местами связывания нейротоксинов на других участках рецептора. Например, местный анестетик PD85,639 не конкурирует за связывание с антиконвульсионными препаратами фенитоином и карбамазепином, связывающихся в Na+-каналах из синаптосом и синаптических мембран. Недавно опубликованные результаты показывают, что существует гидрофобный участок связывания, который отличается от участка связывания 2, но аллостерически с ним связанный. В нескольких исследованиях было показано предпочтительное взаимодействие соединений с Na+-каналом, находящимся в инактивированном состоянии. В противоположность этим результатам недавно были получены данные, что местный анестетик лидокаин не конкурирует с быстрой инактивацией. Результаты этих экспериментов свидетельствуют, что блокирующий эффект местных анестетиков не является результатом процесса медленного восстановления от быстрой инактивации и не вовлекает увеличение быстро инактивирующихся каналов, как это описано в других работах. Эти данные представляет новую модель, фокусирующуюся на процессах активации, как более уместных для механизма действия местных анестетиков.
Многие данные о мутациях поддерживают модель с отдельным участком связывания для QX-314. Подобные результаты получены и на скелетной мышце. Однако необходимо отметить, что направленные мутации аминокислот в других трех сегментах S6 в доменах DI-DIII, которые могут взаимодействовать с другими трансмембранными сегментами, до сих пор не были выполнены. Так как эти четыре домена канала, как полагают, должны располагаться вокруг поры канала, вероятно, что другие сегменты S6 могут также внести вклад в формирование рецептора для местных анестетиков. Аминокислотные остатки в петлях поры, которые формируют селективный фильтр, - также хорошие кандидаты для будущих экспериментов для определения мишени местного обезболивающего действия.
Рис. 1-65. Структура местных анестетиков, для которых обнаружен специфический участок связывания
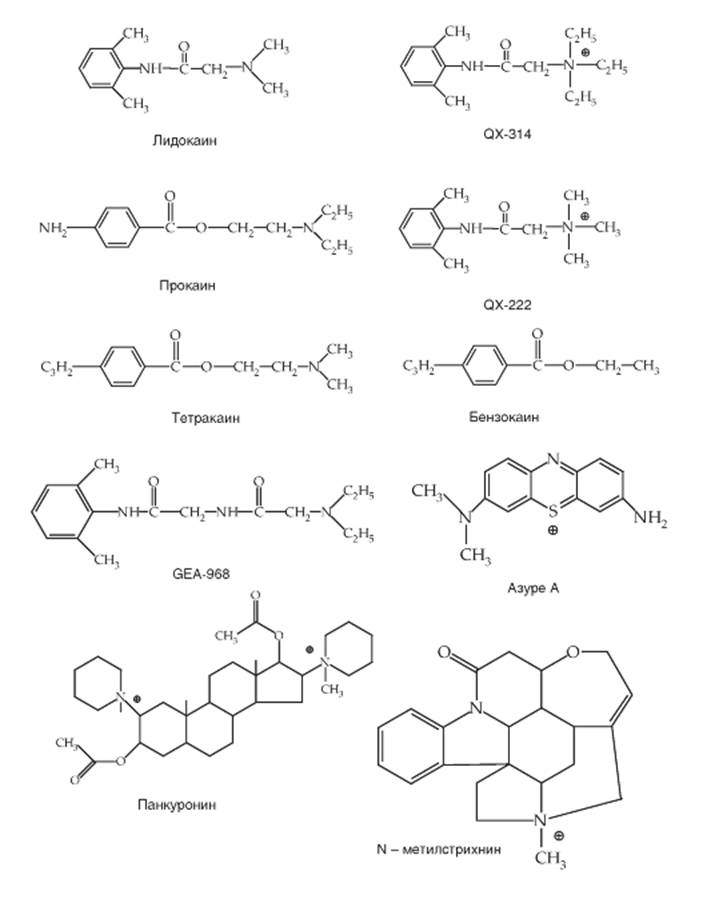
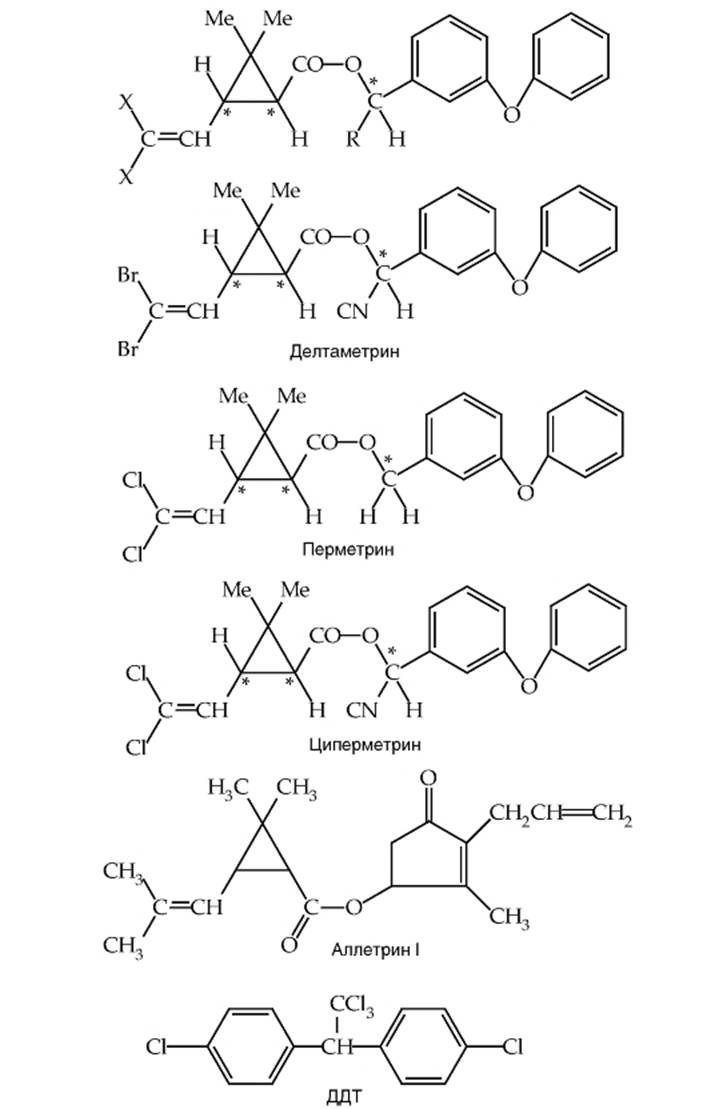
Рис. 1-66. Структура пиретроидов и 4,4-дихлордифенил-трихлорэтана, взаимодействующих с участком связывания 6

Рис. 1-67. Схема связывания токсинов с различными участками потенциал-управляемого Na+-канала
Са2+-ток и его характеристики
На рисунке 1-68 представлен типичный wholecell Ca2+-ток (ICa-L), определяемый наличием CaV1- каналов, зарегистрированный от изолированного вентрикулярного кардиомиоцита мыши. На панели А продемонстрирована оригинальная регистрация тока при ступенчатом смещении потенциала (-30, -10, 10, 30, 50 мВ) от поддерживаемого потенциала (holding potential: Vhl) = -50 мВ), а на панели Б представлена типичная вольтамперная характеристика, полученная на основе оригинальных регистраций от тех же клеток.
Корректное описание инактивации Ca2+-токов представляет определенные сложности, поскольку этот процесс развивается во времени параллельно с развитием выходящих K+-токов. Именно поэтому регистрируемый спад Ca2+-тока может быть не истинным, а определяться наложением на Ca2+-ток одновременно развивающихся выходящих K+-токов. Для предотвращения подобных ошибок необходимо тщательно блокировать K+-токи. Их наличие в наиболее простой форме можно определить по амплитуде Ca2+-тока в конце достаточно длинного по времени стимула. В этом случае она будет слегка превышать «нулевую» линию (Y0 >0). Следует отметить, что превышение «нулевой» линии в конце стимула может также отражать очень медленную (константа времени значительно больше длительности стимула) инактивацию исследуемого Са2+-тока, поэтому, чтобы избежать возможных ошибок, сложный динамический процесс инактивации сводят к стационарной (steady-state) инактивации.
В этом случае измеряют уменьшение максимальной величины тока, вызванного тестирующими деполяризующими ступеньками, в случае, если перед этим мембранный потенциал определенное время (достаточно продолжительное по сравнению с длительностью инактивации) поддерживался на сниженном уровне. Зависимость этого уменьшения от величины поддерживаемого потенциала носит S-образную форму. При этом для характеристики Ca2+-кана-
лов помимо амплитуды кальциевого тока (ICa) обычно рассматриваются величина активации (Va) и величина инактивации (Vh). Если сущность постоянных времени активации и инактивации Ca2+-каналов достаточно понятна, то величины активации (Va)и инактивации(Vh) требуют пояснения.
Принципы исследования активации и инактивации на примере I Ca,T тока показаны на панелях В, Г, Д, Е, Ж. На панели В представлены тестовые сигналы и steady-state активация ICa,T. Мембрана клетки была на поддерживаемом потенциале - 100 мВ в течение 1 си Ca2+-токи определяли при помощи деполяризующих шагов-ступенек. На панели Г показана активационная кривая, полученная на основании уравнения Больцмана в следующей форме:
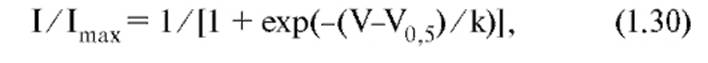
где I представляет собой амплитуду тока, Imax - максимальная амплитуда тока, V- тестовый потенциал, V0,5 - потенциал полуактивации или иначе Va. На панели Д представлены тестовые сигналы и steady-state инактивация ICa,T. Мембрана клетки была на поддерживаемом потенциале в диапазоне от -110 до -45 мВ в течение 1 с и Ca2+-токи определяли при помощи деполяризующих шагов-ступенек до -40 мВ. На панели Е показана инактивационная кривая, полученная на основании уравнения Больцмана в следующей форме:

где I представляет собой амплитуду тока, Imax - максимальная амплитуда тока, V - потенциал, V0,5 - потенциал полуинактивации или иначе Vh. И в случае, представленном на панели Г, и в случае, продемонстрированном на панели Е константа к, представляет собой наклон кривой (фактор крутизны) и отражает steady-state потенциал-чувствительность каналов или «диапазон» потенциалов, в котором каналы функциональны. Чем больше к, тем уже диапазон. В части рисунка Ж кривые на панелях Г и Е объединены вместе.
Рис. 1-68. Типичный whole-cell Са2+-ток (ICa-L), зарегистрированный от изолированного кардиомиоцита желудочков мыши, мембрана которого имеет СаV1-каналы.
А - оригинальная регистрация тока при ступенчатом смещении потенциала от поддерживаемого потенциала (holding potential) Vh= -50 мВ. Величина ступенек деполяризации относительно поддерживаемого потенциала представлена в виде цифр -30, -10, 10, 30, 50 мВ. Б - вольтамперная характеристика, полученная на основе оригинальных регистраций от тех же клеток. В-Ж - принципы регистрации и анализа активации и инактивации тока
Дата добавления: 2018-08-06; просмотров: 383; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
