Расчет равновесного потенциала для ионов 8 страница
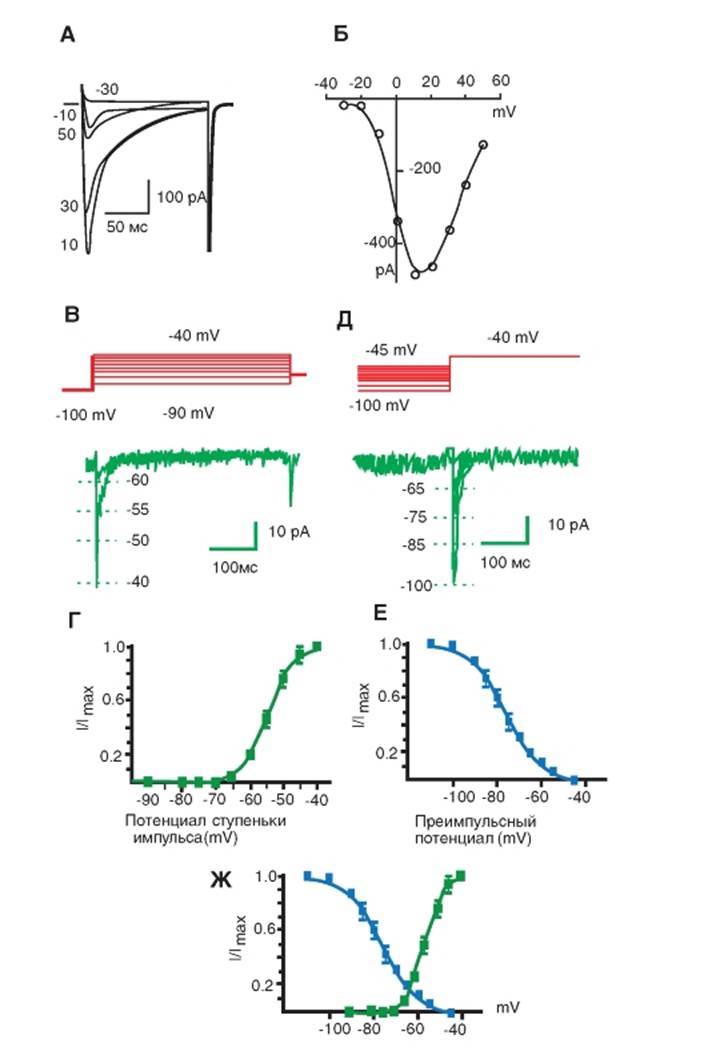
Са2+-каналы L-типа и N-каналы
На рисунке 1-69 А1 показана оригинальная регистрация тока, текущего через одиночный канал подсемейства CaV1 (тока L-типа) на фоне ступеньки деполяризации, равной +10 мВ от поддерживаемого потенциала, равного -40 мВ. Далее показано (рис. 1-69 А2) распределение амплитуд тока при +10 мВ. Обычно предполагают, что амплитуднаягистограммахорошоописываетсякривой Гаусса, если под пипеткой находится один канал и у него есть только одно открытое состояние, как это продемонстрировано на рис. 1-69 А1. Показана гауссовская кривая (см. рис. 1-69 А2), позволяющая оценить среднюю амплитуду тока (событий) и погрешность аппроксимации (стандартное отклонение), т.е. для данного случая это -1,21±0,02 пА при +20 мВ. По зависимости величин зарегистрированного тока от амплитуд ступенек деполяризации (рис. 1-69 А3) можно определить проводимость одиночного канала, т.е. наклон кривой (или иначе фактор крутизны). Амплитуда тока была-1,41±0,03 и -0,97+0,02 пА при 0 и +20 мВ соответственно, а проводимость одиночного канала в приведенном случае равна 22,0+1,1 pS.
Наконец, дополнительную информацию о механизмах функционирования каналов можно получить из анализа гистограмм распределения времен жизни открытого или закрытого состояния канала (рис. 1-69 А4). Интерпретация последних обычно довольно сложная. Распределение времен жизни открытого состояния канала CaV1 при +10 мВ было аппроксимировано одной экспонентой с τ0 = 5,60 мс (см. рис. 1-69 А4). Среднее времен жизни открытого состояния канала, рассчитанное как среднее арифметическое всех данных, было равно 5,95+0,24 мс.
|
|
|
Далее в качестве примера показаны (рис. 1-69 Б1) оригинальнаярегистрациятокаодиночногоканала CaV2 и распределение амплитуды тока при +20 мВ (рис. 1-69 Б2). Амплитуда тока была -1,09+0,02, -0,89+0,02 и -0,73+0,02 пА при +10, +20 и +30 мВ соответственно, а проводимость одиночного канала равна 18,0+1,1 pS (рис. 1-69 Б3). Распределение времен жизни открытого состояния канала CaV2 при +20 мВ было аппроксимировано одной экспонентой с τ0 = 1,04 мс (рис. 1-69 Б4). Среднее времен жизни открытого состояния канала, рассчитанное как среднее арифметическое всех данных, было равно 1,14+0,02 мс.
Рис. 1-69. Биофизические свойства CaV1-канала и CaV2.2-канала.
А - биофизические свойства CaV1-канала с L-типом Ca2+-тока, зарегистрированного в cell-attached patch у кортикальных астроцитов. А1 - регистрация тока одиночного канала подсемейства CaV1 (тока L-типа) на фоне ступени деполяризации, равной +10 мВ от поддерживаемого потенциала (holding potential) Vhp = -40 мВ. Раствор в patch-пипетке содержал 10 μΜ CTx-MVIIC и 5 μΜ Bay K 8644. А2 - распределение амплитуд тока L-типа при +10 мВ. А3 - наклон кривой - проводимость одиночного канала, рассчитанная по величине зарегистрированного тока L-типа. А4 - гистограмма распределения времен жизни открытого состояния канала подсемейства CaV1 при +10 мВ. (Распределение времен жизни в открытом состоянии) (В пипетку добавлен активатор Bay K 8644 для всех CaV1 каналов, продуцирующих L-тока и CTx-MVIIC). Б - биофизические свойства CaV2.2-канала N-типа Ca2+-каналов кортикальных астроцитов, зарегистрированных в cell-attached patch. Б1 - регистрация тока одиночного канала CaV2.2-канала (тока N-типа) на фоне ступени деполяризации, равной +20 мВ от поддерживаемого потенциала (holding potential) Vhp = -80 мВ. Раствор в patch-пипетке содержал 5 μΜ нифедипина и 100 нМ SNX-482. Б2 - распределение амплитуд тока N-типа при +20 мВ. Б3 - наклон кривой - проводимость одиночного канала, рассчитанная по величине зарегистрированного тока N-типа. Б4 - гистограмма распределения времен жизни открытого состояния канала CaV2.2 при +20 мВ. (Распределение времен жизни в открытом состоянии.)
|
|
|
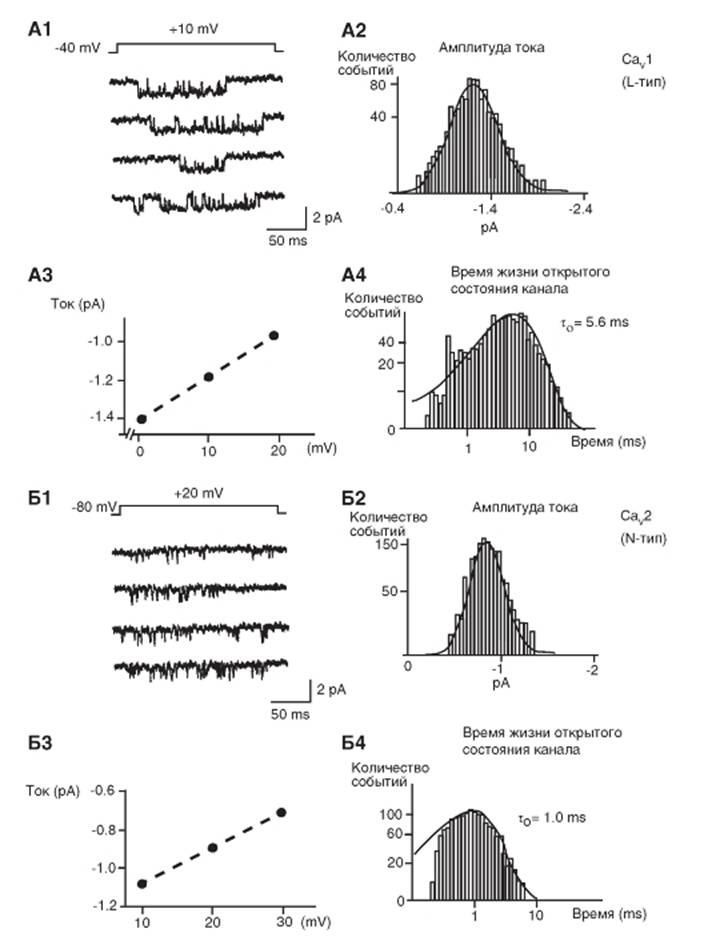
Са2+-каналы R-типа и T-типа
На рисунке 1-70 А1 в качестве примера показана оригинальная регистрация тока одиночного канала CaV2.3 и распределение амплитуды тока при +20 мВ со средней величиной -0,81+0,01 пA (рис. 1-70 А2). Амплитуда тока была -0,92+0,01 и -0,71+0,01 пA при +10 и +30 мВ соответственно, а проводимость одиночного канала равна 10,5+0,3 pS (рис. 1-70 А3). Распределение времен жизни открытого состояния канала CaV2.3 при +10 мВ было аппроксимировано одной экспонен-
|
|
|
той с τ0 = 0,80 мс (рис. 1-70 А4). Среднее времен жизни открытого состояния канала, рассчитанное как среднее арифметическое всех данных, было равно 0,88+0,02 мс.
На рисунке 1-70 Б1 в качестве примера показаны оригинальная регистрация тока одиночного канала CaV3.2, зарегистрированного в cell-attached patch, распределение амплитуд тока (рис. 1-70 Б2), активация (правая кривая) и инактивация (левая кривая) тока (рис. 1-70 Б3), гистограмма распределения времен жизни открытого состояния канала
(рис. 1-70 Б4).
Рис. 1-70. Биофизические свойства Сау2.3-канала и Сау3.2-канала.
А - биофизические свойства CaV2.3-канала с R-типом Ca2+-тока, зарегистрированного в cell-attached patch у кортикальных астроцитов. A1 - регистрация тока одиночного канала CaV2.3 (тока R-типа) на фоне ступени деполяризации, равной +20 мВ от поддерживаемого потенциала (holding potential) Vhp-80 мВ. Раствор в patch-пипетке содержал 5 μΜ нифедипина и 10 μΜ CTx-MVIIC. До регистрации клетки находились в течение 10 мин в растворе Тироде, содержащем 3 μΜ CTx-GVIA и 10 μΜ CTx-MVIIC. А2 - распределение амплитуд тока R-типа при +20 мВ. А3 - наклон кривой - проводимость одиночного канала, рассчитанная по величине зарегистрированного тока R-типа. А4 - гистограмма распределения времен жизни открытого состояния канала CaV2.3 при +10 мВ. (Распределение времени жизни в открытом состоянии.) Б - биофизические свойства канала подсемейства CaV3 на примере канала CaV3.2 с Т-типом Ca^-тока, зарегистрированного в cell-attached patch уHEK 293 клеток. Б1 - регистрация тока одиночного канала CaV3.2 (тока Т-типа) на фоне ступенек деполяризации, величина которых в цифровом виде представлена на картинке, от поддерживаемого потенциала (holding potential) Vhp -90 мВ. Б2 - распределение амплитуд тока Т-типа со средней величиной -0,41+0,01 пА. Б3 - исследования активации (правая кривая) и инактивации (левая кривая) тока через канал CaV3.2. Каждые 2 с от поддерживаемого потенциала величиной -90 мВ подавали деполяризационные ступеньки (для исследования процесса активации канала) или от различных величин поддерживаемого потенциала подавали ступеньку до -10 мВ (для исследования процессов инактивации канала). Б3 - гистограмма распределения времен жизни открытого состояния канала CaV3.2 при -10 мВ. (Распределение времени жизни в открытом состоянии.) Распределение времен жизни открытого состояния канала CaV3.2 при тестовом потенциале -10 мВ было аппроксимировано одной экспонентой с τ0 = 0,48 мс
|
|
|
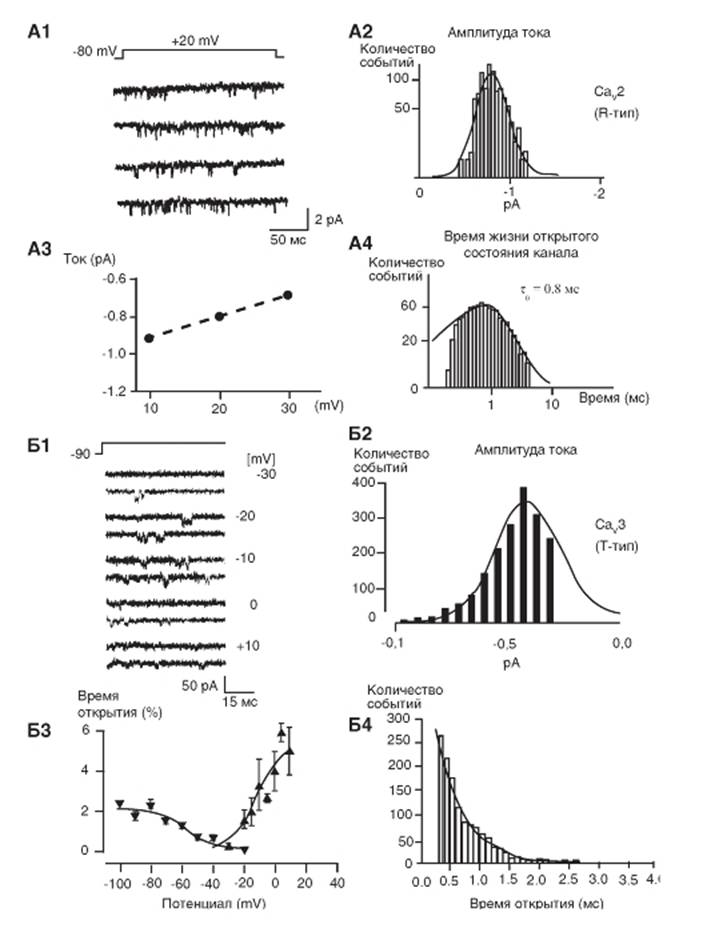
Блокаторы и активаторы Са2+-каналов
Фармакология трех семейств кальциевых каналов хорошо изучена. Каналы СаV1 служат молекулярной мишенью для органических блокаторов Са2+-каналов, широко применяемых в лечении сердечно-сосудистых заболеваний. Как полагают, эти вещества действуют на три отдельных, но аллостерически связанных, рецепторных участка.
Фенилалкиламиныпредставляют собой блокаторы внутриклеточного участка поры. Полагают, что эти вещества входят в пору из цитоплазматических участков канала и осуществляют блокаду. Их рецепторные участки образованы аминокислотными остатками в S6-сегментах в домене III и IV по аналогии с рецепторным участком для анестетиков у Na+-каналов.
Дигидропиридинымогут быть активаторами или ингибиторами Са2+-каналов и полагают, что они действуют аллостерически, сдвигая моду функционирования канала в направлении открытого или закрытого состояния, скорее, чем закупоривая пору. Их рецепторный участок включает аминокислотные остатки в S6-сегментах в домене III и IV и S5-сегменте домена III. Места связывания дигидропиридинов и фенилалкиламов связаны и частично перекрываются.
Бензодиазепины,представляющие собой группу синтетических веществ (один из которых дилтиазем), связываются с рецепторным участком,
который перекрывается с местом связывания фенилалкиламинов.
Семья СаV2 Са2+-каналов относительно нечувствительна к дигидропиридиновым блокаторам Са2+-каналов, но эти Са2+-каналы специфически блокируются пептидными токсинами пауков и морских улиток. СаV2.1-каналы блокируются специфически ω-агатоксин IVA яда из паутины паука. СаV2.2-каналы блокируются специфически ω-конотоксином GVIA и сопоставимы с токсинами улиток. СаV2.3-каналы блокируются специфически пептидным токсином SNX-482, выделенным из яда тарантулов. Эти пептидные токсины могут быть потенциальными блокаторами синаптической передачи, потому что их специфические эффекты реализуются через СаV2 семью Са2+-каналов.
Семья СаV,3 Са2+-каналов нечувствительна к обоим дигидропиридинам, блокирующим СаV1-каналы, и токсину паука или токсину конусной улитки, блокирующим СаV2. Специфические блокаторы СаV3-каналов пока не найдены. Органический блокатор Ca2+-каналов мибефрадил в какой то степени специфичен для СаV3 по сравнению с СаV1 Ca2+-токов (в три-пять раз). Пептид куртоксин ингибирует активационные ворота СаV3.1- и СаV3.2-каналов. Развитие более специфических и высокоафинных блокаторов СаV3 семьи Ca2+-каналов должно быть полезным для более детального анализа физиологической роли этих каналов.
Рис. 1-71. Фармакологические соединения, мишенью которых служат Са2+-каналы
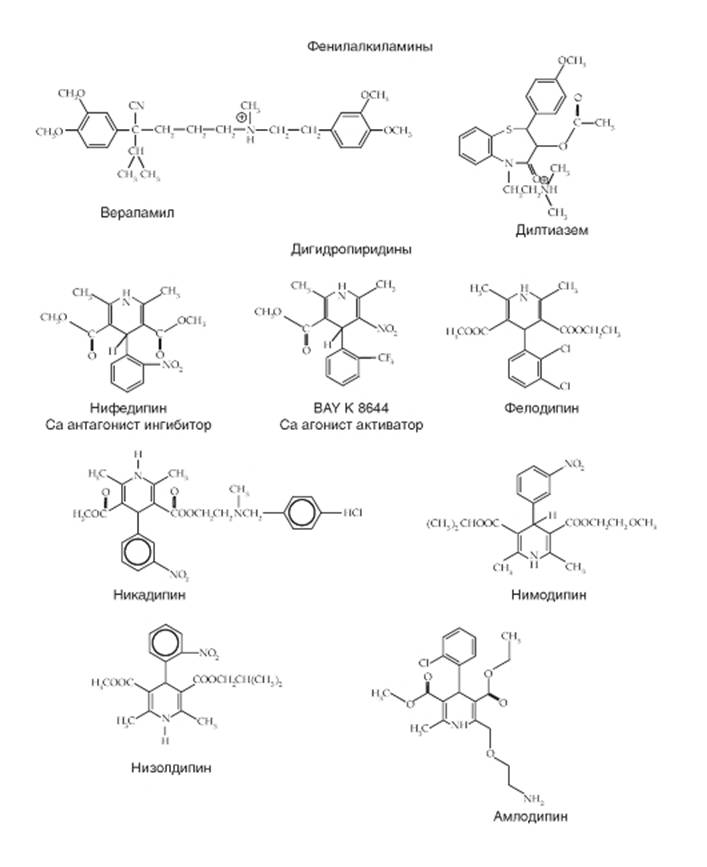
Изменение Са2+-токов под действием Са2+ агонистов и антагонистов
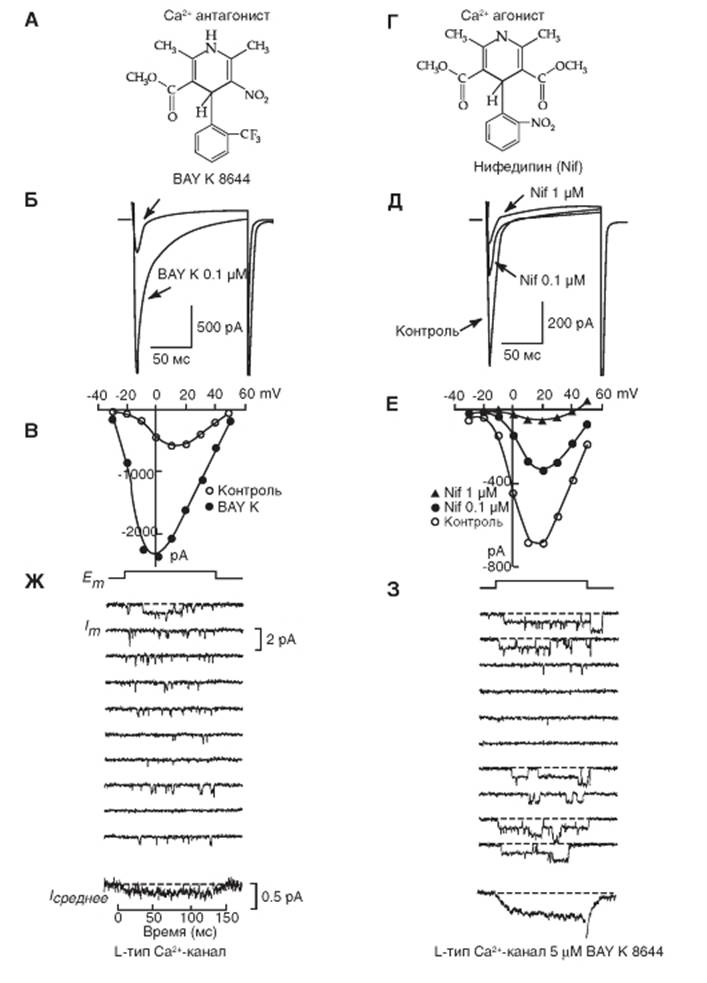
На рисунке 1-72 продемонстрированы примеры действия фармакологических препаратов на типичный whole-cell Ca2+-ток (ICa,L), определяемый наличием CaV1-каналов, зарегистрированный от изолированного вентрикулярного кардиомиоцита мыши. На панели Б представлены контрольная регистрация тока и регистрация после добавления 0,1 μΜ BAY K8644, а на панели В показаны две вольтамперные характеристики клетки: одна получена в стандартном
перфузионном растворе, а другая в том же растворе, но содержащем 0,1 μΜ BAY K8644. На панели Д показаны оригинальные кривые Ca2+-тока при отсутствии и присутствии 0,1 μΜ и 1 μΜ нифедипина, а на панели Е показаны три вольтамперные характеристики клетки: одна получена в стандартном перфузионном растворе, другая в том же растворе, но содержащем 0,1 μΜ нифедипина, а третья - 1 μΜ нифедипина.
Панель Ж демонстрирует регистрацию одиночного Ca2+-канала L-типа в контрольных условиях, а панель З показывает характер изменений того же канала при добавлении 5 μΜ BAY K8644.
Рис. 1-72. Примеры действия фармакологических препаратов на типичный whole-cell Са2+-ток (1Са,L), зарегистрированный от изолированного кардиомиоцита желудочков мыши, мембрана которого имеет СаV1-каналы. На панелях А и Г представлена структура действующих соединений BAY K8644 (А) и нифедипина (Г). На панелях Б и Д показаны оригинальные кривые Са2+-тока при отсутствии и присутствии этих соединений. Показано изменение Са2+-тока после добавления 0,1 μΜ BAY K8644 (Б) или 0,1 и 1 μΜ нифедипина (Д). Деполяризующие импульсы до 0 мВ (Б) или до +20 мВ (Д) были поданы от поддерживаемого потенциала (holding potential) Vhp = -50 мВ. На панелях В и Е показаны соответствующие рисункам Б и Д вольтамперные характеристики вентрикулярных миоцитов мыши при отсутствии и присутствии тестируемых соединений. Наконец, на панели Ж показан пример регистрации L-типа Са2+-канала в контроле, а на панели З при добавлении 5μΜ BAY K8644
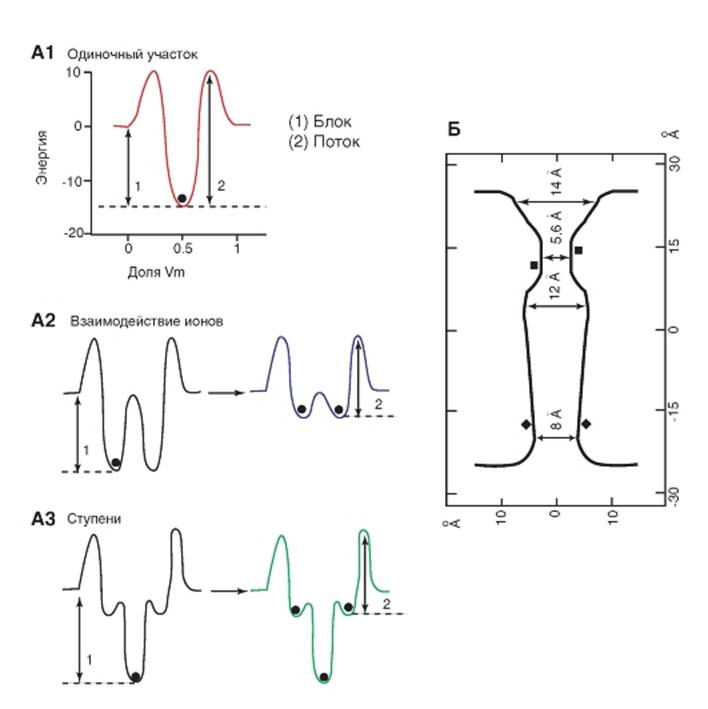
Модель Ca2+-поры
Модели двухмерной топографической карты поры с использованием предполагаемых «холмов» и «ям» химической потенциальной энергии, преодолеваемых ионом при прохождении через канал, объясняли проницаемость канала с позиций теории скоростей реакции. Первоначально с помощью них пытались объяснить проницаемость ионов. «Ямы» - места связывания; «холмы» - энергетические барьеры, препятствующие движению иона между местами связывания или его выходу из поры. На рисунке 1-73 показана модель, созданная на основе «теории скоростей реакции» для объяснения проницаемости Ca2+-канала. Каждая модель начинается с Ca2+-связывающего участка, имеющего константу диссоциации, величина которой измеряется в микромолях. Это соответствует «потенциальной яме» с энергией приблизительно 14 kT (∆G = kT*ln KD, где k - константа Больцмана и T - температура). Стрелка 1 на каждом рисунке обозначает энергетическую разницу, определяющую высокую афинность места связывания. Барьеры на внешней стороне поры должны быть достаточно высоки, чтобы ионы не входили быстрее реальной скорости диффузии. Это требует приблизительно 8 kT. Стрелка 2 показывает значение энергии, определяющей ограничивающую скорость (rate limiting step), т.е. наибольший энергетический барьер, препятствующий выходу иона из каждой модели поры.
Если бы был только один такой участок в поре (рис. 1-73 А1), то ион, проходящий эту пору, должен был бы преодолеть энергетический барьер в 22 kT, что соответствует скорости потока ионов через Са2+-каналы меньше чем 2000 ионов в секунду, т.е. приблизительно в 1000 раз меньше, чем величины регистрируемых пикоамперных токов. Это показывает, что селективность не может быть обеспечена тем, что пора становится «липкой» для специфического иона, потому что в этом случае ион перемещается через пору слишком медленно.
Теория скоростей реакции предлагает два независимых пути для обеспечения высокого потока ионов через «липкую» пору, но оба требуют, чтобы
пора могла удерживать больше одного иона Ca2+ одновременно. На рисунке 1-73 А2 продемонстрирован механизм, используемый двумя идентичными участками высокоафинного связывания. Один ион Ca2+ перебрасывается назад и вперед между ними с небольшим шансом для выхода. Поскольку в такой модели ионы не могут ни перепрыгнуть друг друга, ни войти в занятый участок связывания, один ион Ca2+ преграждает вход ионам другого сорта. Но можно предположить, что, когда два иона Ca2+ находятся в поре, они взаимодействуют, чтобы уменьшить афинность мест связывания для Ca2+. Эти более мелкие «колодцы» (стрелка 2) допускают больший поток ионов. Однако в поре обнаружен так называемый EEEE-локус, и только он может быть высокоафинным участком связывания, что противоречит представлениям о двух идентичных связывающих участках. Наличие EEEE- локуса опровергает детали модели, представленной на данном рисунке, но не ее основной принцип. Предполагается, что существуют еще два боковых низкоафинных участка с каждой стороны. Это привело к созданию модели, представленной далее (рис. 1-73 А3), на которой мелкие «колодцы» тесно примыкают с каждой стороны к одному глубокому «колодцу». В такой модели у ионов нет возможности взаимодействовать, поэтому при мультиионной оккупации поры энергетические колодцы и барьеры не изменяются. Но простое присутствие низко-афинных примыкающих участков означает, что ограничивающий скорость барьер для выхода (стрелка 2) имеет примерно такие же размеры, как в модели, где ионы имеют возможность взаимодействовать. Серия участков с уменьшающейся афинностью ускоряет поток ионов через химические потенциальные энергетические барьеры.
Пора имеет форму песочных часов (рис. 1-73 Б). Диаметр селективного фильтра равен 5,6 А,т.е. почти в 3 раза шире, чем диаметр иона Ca2+, поэтому селективность нельзя объяснить тесным совпадением диаметра иона и диаметра отверстия, что лежит в основе механизма селективности К+-каналов. Важно положение зарядов (квадратики) четырех глутаматов EEEE-локуса.
Рис. 1-73. Модели Са2+-канала, объясняющие его проницаемость и структуру поры.
А - теория скоростей реакции описывает поры, которые тесно связывают ионы Ca2+. Горизонтальная ось: фракция электрического поля через пору. Вертикальная ось: энергия химического потенциала для Ca2+, когда он проходит через пору. Стрелка 1 соответствует энергии, которая определяет Ca2+-блок для ионов другого сорта. Стрелка 2 указывает самый высокий прыжок энергии в каждой модели, который ограничивает скорость выхода иона Ca2+ из поры. Поток очень низок в поре с одним участком, потому что существует высокоэнергетический барьер для выхода (1); мультиионные поры представляют два различных механизма для уменьшения энергетического барьера, лимитирующего скорость потока; (2) взаимодействия иона c ионом (ion interaction) и (3) лестница шагов - «ступени» потенциальной энергии (stairsteps), - созданная низкоафинными участками связывания, и примыкающий селективный участок. Б - поперечный разрез поры. Показаны узкий и короткий селективный фильтр около внешней стороны и широкая область в центре мембраны
К+-токи и каналы
Калиевые каналы представляют собой наиболее обширное семейство ионных каналов (К+-каналов), генерирующих разнообразные калиевые токи (К+- токи). Эти токи можно регистрировать как от целой клетки методом patch-clamp в конфигурации wholecell (тогда жаргонно эти токи называют макроскопическими) или от одиночного канала, также методом patch-clamp, но в других конфигурациях (тогда их нередко называют микроскопическими токами). К+-токи можно зарегистрировать от клеток, у которых есть преимущественно К+-каналы (рис. 1-74 А). Обычно это экспрессированные в билипидные слои каналы. Можно и на любой клетке заблокировать работу всех каналов, кроме К+-каналов (рис. 1-74 Б). На этих двух рисунках представлены оригинальные кривые whole-cell K+-тока, созданного работой потенциалуправляемых К+-каналов при различных значениях смещаемого потенциала относительно поддерживаемого потенциала.
Дата добавления: 2018-08-06; просмотров: 428; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
