Расчет равновесного потенциала для ионов 6 страница
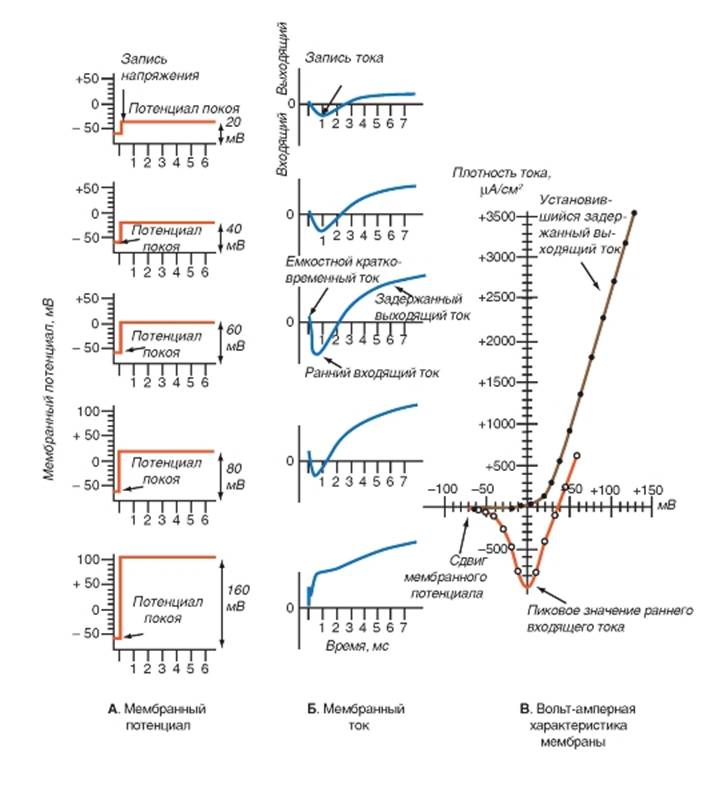
А - смещения мембранного потенциала во времени относительно поддерживаемого потенциала. Б - ток через мембрану, регистрируемый одновременно со смещением потенциала. Показаны только смещения потенциала в положительную область от уровня поддерживаемого потенциала, равного -60 мВ (например, потенциала покоя). В - вольтамперные характеристики, полученные в результате экспериментов с фиксацией потенциала. По оси абсцисс - смещения мембранного потенциала относительно поддерживаемого потенциала (в данном случае потенциала покоя); по оси ординат - изменения входящего Na+-тока (фиолетовая кривая) и выходящего К+-тока (коричневая кривая)
Основные блокаторы Na+- и К+-токов ТТХ и ТЭА
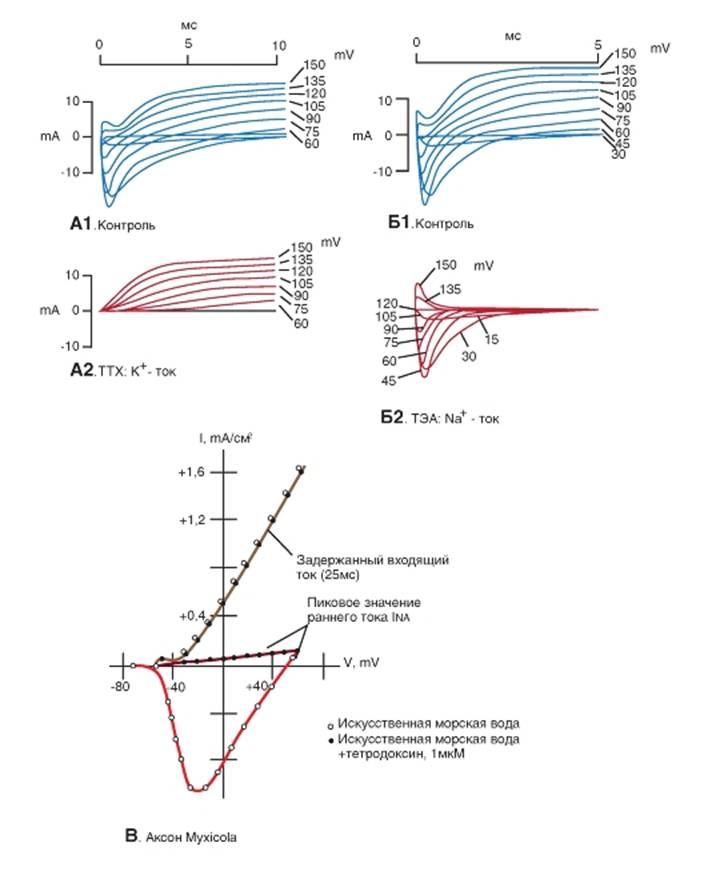
Эксперименты с заменой ионов и полученные результаты требовали независимых исследований с селективным блокированием различных ионных каналов. Эти поиски увенчались успехом, и сходные кривые были получены, когда вместо замены ионов применяли высокоселективные соединения, блокирующие ионные каналы. Например, при введении в перфузионный раствор, окружающий клетку, тетродотоксина (TTX) - яда японской рыбы иглобрюха - он воздействует только на нарастание gNa, происходящее при деполяризации мембраны. Его эффект крайне специфичен. TTX не влияет на калиевую проводимость, более того, он даже не особенно подавляет функцию тех натриевых каналов, которые действуют в покоящейся мембране (а также каналов, активируемых медиаторами) (рис. 1-56 А). TTX блокирует только повышенную проводимость gNa, появляющуюся при деполяризации. Другое вещество - тетраэтиламмоний (ТЭА) - подавляет калиевую проводимость,
|
|
|
возрастающую при деполяризации, но только тогда, когда введено внутрь аксона (рис. 1-56 Б); оно не влияет на gNa. Избирательность действия фармакологических соединений позволила установить и другие детали. Например, когда внутрь аксона вводят проназу - фермент, расщепляющий белки, - она избирательно нарушает инактивацию gNa. После обработки аксона проназой натриевый ток нарастает обычным образом, но потом не спадает: он остается большим в течение всего времени деполяризации. Первый сделанный из этого вывод заключался в том, что включение и выключение gNa - это два независимых процесса. Второй вывод основывался на следующей дополнительной информации, известной биохимикам. Проназа представляет собой комплекс из 11 ферментов. Последовательное введение каждого из них в клетку показало, что к избирательному нарушению инактивации gNa приводит только введение В-щелочной протеазы. Поскольку она селективно отщепляет аргинин от белковой цепочки, было постулировано, что инактивационные ворота Na+-канала представляют собой аргинин.
|
|
|
Рис. 1-56. Избирательное блокирование натриевых и калиевых каналов с помощью тетродотоксина и тетраэтиламмония.
В первой части рисунка представлены наложенные друг на друга 7-9 записей, сделанных в условиях фиксации потенциала (на уровнях от 30 до 150 мВ) на одном перехвате Ранвье седалищного нерва лягушки. На записях цифрами показаны смещения мембранного потенциала от поддерживаемого потенциала (в данном случае потенциала покоя, равного около -75 мВ), кратные 15 мВ. Входящий ток направлен вниз, а выходящий вверх. Поскольку площадь мембраны перехвата, на которой фиксировали напряжение, нельзя определить точно, указана сила тока (в наноамперах), а не плотность тока. В нижней части рисунка представлены вольтамперные характеристики измеряемых токов. А - изменение тока во времени в опыте с обычным солевым раствором (А1) и в присутствии тетродотоксина (А2). Тетродотоксин блокирует ту часть общего мембранного тока, которая переносится ионами Na+, но не К+, т.е. входящий натриевый ток, оставляя без изменений выходящий калиевый ток (Hille, 1976). Б - изменение тока во времени в опыте с нормальным солевым раствором (Б1) и в присутствии тетраэтиламмония (Б2). Влияние тетраэтиламмония на ток показывает, что это соединение блокирует калиевый, но не натриевый ток. (По Hille, 1976, с изменениями) В - вольтамперные характеристики гигантского аксона Myxicola, показывающие INa (белые кружечки) и IK (белые треугольники) в контрольных условиях и демонстрирующие, что тетродотоксин (1 мкМ) блокирует INa (черные кружечки), но не IK (черные треугольники). Точки - ионные токи во время ступенек напряжения от уровня поддерживаемого потенциала до указанного уровня
|
|
|
Nа+-токи
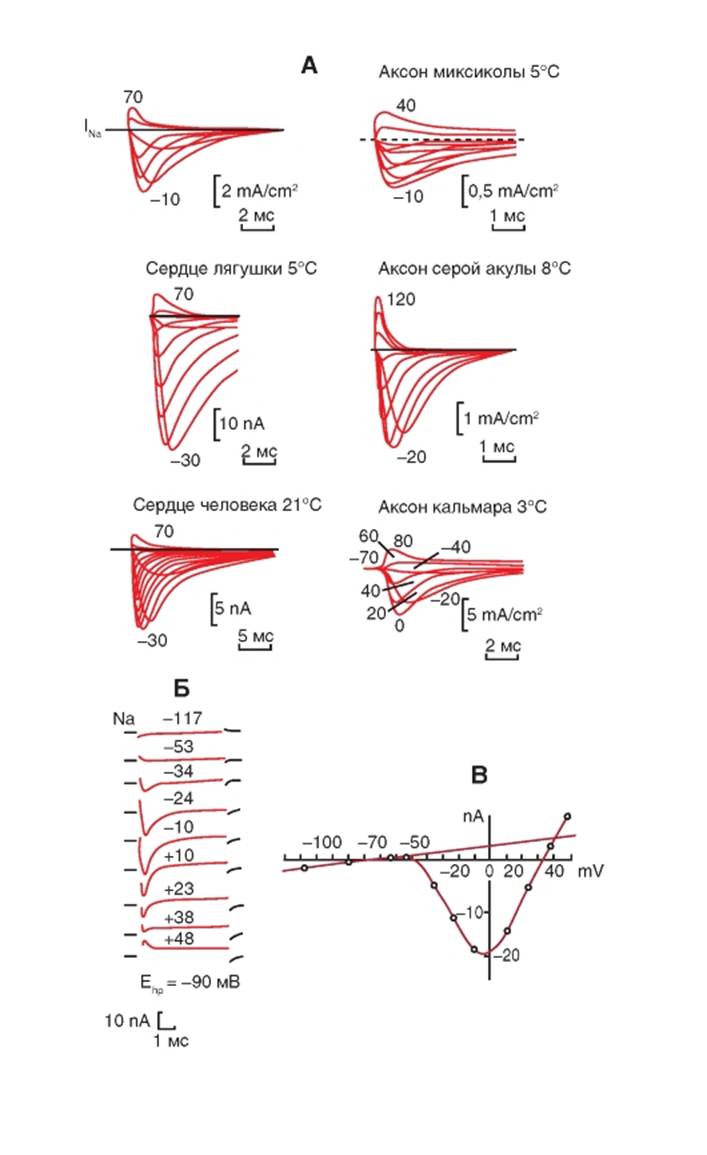
Рассмотрим Na+-токи, зарегистрированные методом voltage-clamp. На рисунке 1-57 А продемонстрированы Na+-токи, зарегистрированные у ряда электровозбудимых клеток при различных величинах смещения мембранного потенциала относительно поддерживаемого потенциала. Величины поддерживаемых потенциалов в этом случае не приводятся, поскольку они различные для клеток разных тканей. Однако приводятся величины смещений мембранного потенциала относительно поддерживаемого потенциала, при которых входящий Na+-ток максимален, и величины, при которых максимален инвертированный Na+-ток (т.е. ток, изменивший свое направление). Разумеется, фаза деполяризации потенциала действия лежит в том диапазоне
|
|
|
потенциалов, при которых Na+-ток имеет входящее направление. Выходящее направление этого тока в естественных условиях не встречается, а присутствует только в условиях значительных смещений мембранного потенциала в эксперименте, что позволяет охарактеризовать проводимость каналов при всех возможных уровнях смещения потенциала.
На рисунке 1-57 Б представлена запись Na+- токов при смещении мембранного потенциала относительно величины поддерживаемого потенциала. Величина поддерживаемого потенциала Ehp равна -90 мВ. На основании результатов экспериментов по пиковым значениям и по стационарным значениям токов, представленных на рисунке 1-57 Б, были построены вольтамперные характеристики (рис. 1-57 В), типичные для Na+-токов.
Рис. 1-57. Na+-токи, зарегистрированные в конфигурации whole-cell у электровозбудимых клеток при различных величинахсмещения мембранного потенциалаотносительно поддерживаемогопотенциала. K+-каналы были ингибированы Cs, тетраэтиламмонием или 4-аминопиридином.
А - Na+-токи, зарегистрированные у разных электровозбудимых клеток. Б - Na+-токи, зарегистрированные при разных ступеньках относительно поддерживаемого потенциала. Величина поддерживаемого потенциала Eh равна -90 мВ. Величины ступенек тестирующих потенциалов указаны на рисунке. В - вольтамперные характеристики, построенные по пиковым значениям (о) и по стационарным значениям (∆)Na+-токов
Активация и инактивация Na+-токов
Корректное описание инактивации входящих токов представляет определенные сложности, поскольку этот процесс развивается во времени параллельно с развитием выходящих K+-токов. Поэтому регистрируемый спад тока может быть не истинным, а определяться наложением на входящий ток одновременно развивающихся выходящих K+-токов. Для предотвращения подобных ошибок необходимо тщательно блокировать K+-токи. Их наличие в наиболее простой форме можно определить по амплитуде входящего тока в конце достаточно длинного по времени стимула. В этом случае она будет слегка превышать «нулевую» линию (Y0 >0). Здесь следует отметить, что превышение «нулевой» линии в конце стимула может также отражать очень медленную (константа времени значительно больше длительности стимула) инактивацию исследуемого входящего тока. Именно поэтому во избежании возможных ошибок сложный динамический процесс инактивации сводят к стационарной (steady-state) инактивации.
В этом случае измеряют уменьшение максимальной величины тока, вызванного тестирующими деполяризующими ступеньками в случае, если перед этим мембранный потенциал определенное (достаточно длинное по сравнению с длительностью инактивации) время поддерживался на сниженном уровне. Зависимость этого уменьшения от величины поддерживаемого потенциала носит S-образную форму. При этом для характеристики каналов помимо амплитуды тока (I) обычно рассматривают величину активации (Va) и величину инактивации (Vh). Если сущность постоянных времени активации и инактивации каналов достаточно понятна, то величины активации (Va) и инактивации (Vh) требуют пояснения.
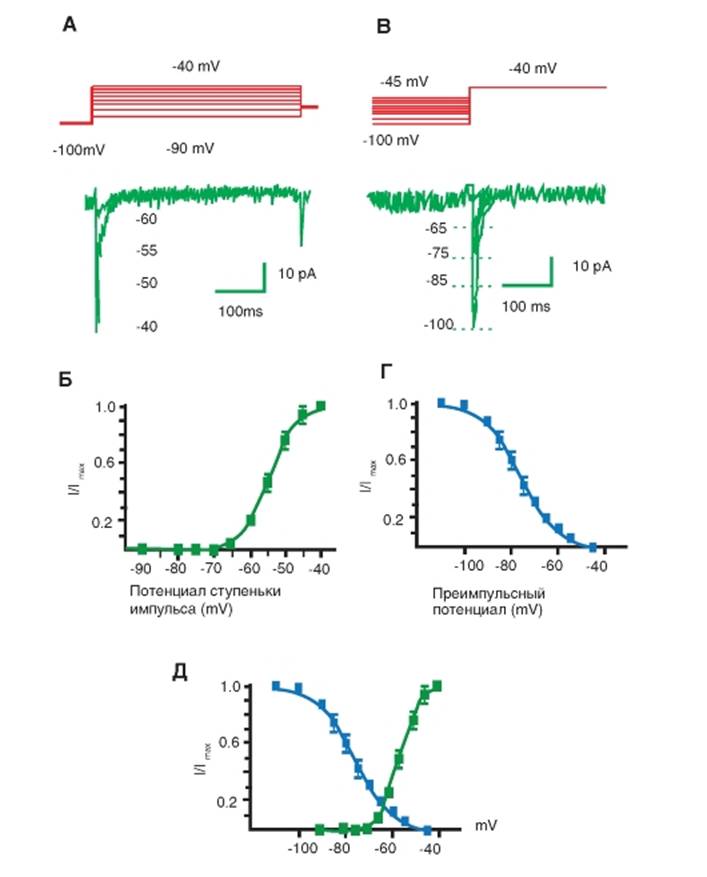
На рисунке 1-58 показаны принципы исследования активации и инактивации тока.
На панели А данного рисунка представлены тестовые сигналы и steady-state активация IT. Мембрана клетки была на поддерживаемом потенциале -100 мВ в течение 1 с, и токи выявляли с помощью деполяризующих шагов-ступенек. На панели Б показана активационная кривая, полученная на основании уравнения Больцмана в следующей форме:

где I представляет собой амплитуду тока, Imax является максимальной амплитудой тока, V - тестовый потенциал, V0,5 - потенциал полуактивации или иначе Va. На панели В рисунка представлены тестовые сигналы и steady-state инактивация тока. Мембрана клетки была на поддерживаемом потенциале в диапазоне от -110 до -45 мВ в течение 1 с, и токи выявляли при помощи деполяризующих шагов-ступенек до -40 мВ. На панели Г показана инактивационная кривая, полученная на основании уравнения Больцмана в следующей форме:
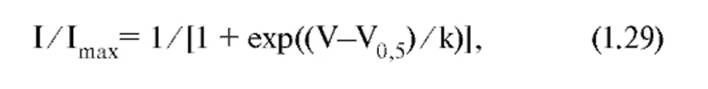
где I представляет собой амплитуду тока, Imax является максимальной амплитудой тока, V - потенциал, V0,5 - потенциал полуинактивации или иначе Vh. И в случае (Б), и в случае (Г) константа k представляет собой наклон кривой (фактор крутизны) и отражает steady-state потенциалчувствительность каналов или «диапазон» потенциалов, в котором каналы функциональны. Чем больше k, тем уже диапазон. В части рисунка (Д) кривые на панелях Б и Г объединены вместе.
Рис. 1-58. Принципы регистрации и анализа активации и инактивации тока
Na+-каналы
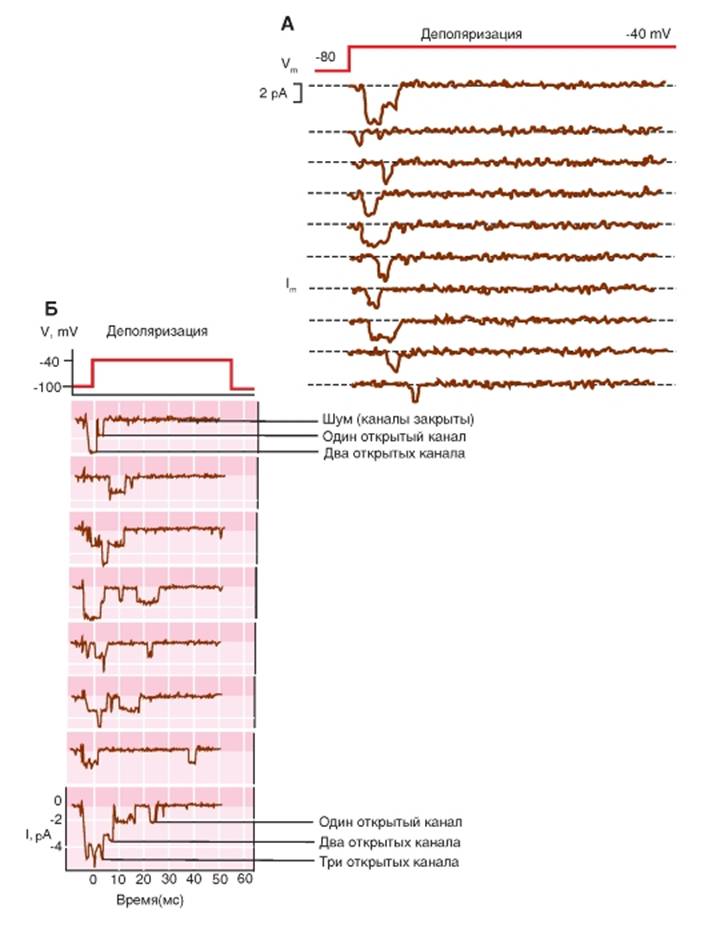
В настоящее время известно 9 типов Na+-каналов. Рисунок 1-59 А демонстрирует одиночные Na+- каналы, зарегистрированные методом patch-clamp в конфигурации cell-attached. Ток через канал возникает при смещениях мембранного потенциала от -80 мВ (поддерживаемый потенциал) до -40 мВ. Открытое состояние Na+-каналов характеризуется смещением нулевой линии вниз, и это свидетельствует о том, что через канал течет входящий Na+-ток. Рисунок 1-59 Б демонстрирует открытое состояние одного, двух или трех Na+-каналов.
На рис. 1-59 А показано 10 регистраций одиночного натриевого канала в ответ на стимуляцию деполяризационной тестовой ступенькой потенциала (цитозольная сторона patch электроотрицательна) в одном и том же эксперименте.
Н рис. 1-59 Б показано 8 регистраций одиночного натриевого канала в ответ на стимуляцию деполяризационной тестовой ступенькой потенциала (цитозольная сторона patch электроотрицательна) в одном и том же эксперименте, выполненном методом patch-clamp(записи одного и того же канала).
Рис. 1-59. Na+-ток через одиночный Na+-канал в мышечной клетке мыши. А - Регистрация методом patch-clamp в конфигурацииcell-attached одиночных ионных каналов при смещениях мембранного потенциала от -80 до -40 мВ. Открытое состояние Na+-каналов представлено в виде смещения нулевой линии вниз, т.е. через канал течет входящий Na+-ток. Б - Регистрация методомpatch-clamp в конфигурации outside-out одиночных ионных каналов при смещениях мембранного потенциала от -100 до -40 мВ
Параметры Na+-тока
Микроскопические механизмы, то есть механизмы на уровне токов, текущих через одиночные каналы, лежащие в основе макроскопических вольт-амперных характеристик, то есть процессов, происходящих на уровне токов, текущих через целую клетку.
На рис. 1-60 А линия обозначает вольт-амперную зависимость идеализированного открытого натриевого канала. Т.к. мы исходим из начальной предпосылки, что канал в нашем случае будет полностью открыт все время (т.е. что проводимость каналов не будет функцией напряжения) тогда ток, текущий через них, будет линейным или «омическим».
На рис. 1-60 Б представлена кривая, которая показывает вероятность того, что натриевый канал будет находиться в открытом состоянии (вероятность открытия натриевого канала). Уравнение, приведенное во вставке в рисунок, означает
приведенную кривую, если мы вставим значения
ZNa = 6.5 и V0.5= - 50 mV.
На рис. 1-60 В параметр m описывает вероятность того, что каждая из трех частей в натриевом канале находятся в необходимом состоянии для того, что бы канал открылся. Параметр h описывает вероятность того, что инактивирующая часть натриевого канала находится в необходимом состоянии для того, что бы канал открылся (т.е. не будет инактивировать его). Таким образом, высокие значения параметра h располагают к тому, чтобы канал был в открытом состоянии. Параметры, отложенные на рисунке - это значения m и h на бесконечном промежутке времени.
На рис. 1-60 Г представлена оценка макроскопического натриевого тока посредством умножения одноканальных токов из секции А рисунка на вероятность их открытия Ро из секции Б и на количество каналов (N). В данном случае мы устанавливаем количества каналов в 100 натриевых.
Рис. 1-60. Параметры Na+-тока, протекающего через целую клетку и через одиночные ионные каналы

Места связывания токсинов у Na+-канала
Большое количество биологических токсинов оказывают свой токсический эффект, модифицируя свойства Na+-каналов. Они включают:
• растворимые в воде гетероциклические гуанидиновые соединения: ТТХ и сакситоксин (saxitoxin, STX);
• липидорастворимые полициклические соединения: вератридин, аконитин и батрахотоксин (batrachotoxin, BTX);
• яды, представляющие собой низкомолекулярные полипептиды, изолированные из скорпиона, морских анемон и многих других.
После появления данных об этих участках B. Hille предложил наглядную схему взаимодействия токсинов с белком канала (рис. 1-61). Эта схема и до настоящего времени позволяет читателям, не обладающим специальной молекулярно-биологической подготовкой, понять, в каком месте канала происходит взаимодействие с теми или иными токсинами.
Все фармакологические соединения, действующие на Na+-каналы, имеют места или участки связывания на α-субъединице. Были идентифицированы, по крайней мере, шесть отличающихся мест связывания для нейротоксинов и один участок связывания для местных анестетиков и сходных с ними веществ, которые представлены в таблице (рис. 1-61).
Место связывания 1 связывает непептидные блокаторы поры Na+-каналов - ТТХ, STX и пептидный блокатор поры μ-конотоксин. Рецепторные участки для этих токсинов сформированы аминокислотными остатками в петле поры и непосредственно на внеклеточной стороне петли поры с внешней стороны.
Место связывания 2 связывает семейство липидорастворимых токсинов, включающих аконитин (aconitine, AC), вератридин (veratridine, VER), BTX и граянотоксин (grayanotoxin, GTX), которые поддерживают активацию натриевых
каналов. Фотоафинная маркировка и исследования мутагенеза демонстрируют трансмембранные сегменты IS6 и IVS6 в рецепторном участке
для BTX.
Место связывания 3 связывает α-токсин скорпиона и токсины морских анемон, которые ингибируют инактивацию Na+-каналов, замедляя переход Na+-каналов, находящихся в активированном состоянии, к состоянию их инактивации. Эти пептидные токсины связываются в комплексном рецепторном участке, включающем петлю между сегментами S3-S4 на внешнем конце S4 сегмента в домене IV.
Место связывания 4 связывает β-токсины скорпиона, которые увеличивают активацию каналов. Рецепторный участок для β-токсина скорпиона включает петлю, соединяющую сегменты S3-S4 на внеклеточном конце сенсора напряжения сегмента S4 в домене II.
Место связывания 5 связывает комплекс полиэфирных токсинов - бреветоксинов (brevetoxin, PbTx) и CTX (ciguatoxin), которые продуцируют морские планктонные формы dinoflaggelates. В экспериментах с фотоафинной меткой было показано, что трансмембранные сегменты IS6 и IVS5 обеспечивают связывание PbTx.
Место связывания 6 связывает пиретроиды, представляющие собой аналоги природных нейротоксинов приретринов, 4,4-дихлордифенил- трихлорэтан и δ-конотоксины, которые замедляют скорость инактивации подобно α-токсину скорпиона. Местоположение нейротоксинового рецепторного участка 6 неизвестено.
Наконец, местные анестетики и вещества, родственные антиэпилептикам, и антиаритмические вещества связывают перекрывающиеся рецепторные участки, расположенные во внутренней полости поры натриевого канала. Аминокислотные остатки в сегментах S6, по крайней мере в трех из четырех доменов, вносят вклад в этот сложный комплекс рецепторного участка к соединению, при этом доминирующую роль играет IVS6-сегмент.
Рис. 1-61. Места связывания токсинов с различными доменами и сегментами потенциалуправляемых натриевых каналов, посредством которых реализуется физиологический эффект
Места связывания токсинов у потенциал-управляемых Na+-каналов

Центр связывания 1 у Na+-канала
Первые два (рис. 1-62 А) естественно встречающихся токсина, вероятно, лучше всего исследованы в качестве модификаторов Na+-каналов. TTX - сильнейший яд (LD50 0,1 мг/кг), найденный в яичниках и печени и в меньшем количестве в кишечнике и коже рыбы фугу и родственных ей рыб из семейства Tetraodontidae. Сама рыба не синтезирует TTX, но вместо этого концентрирует его из заглатываемых бактерий. Рестораны в Японии и Корее подают рыбу фугу как деликатес после удаления ядовитых органов. Однако много фатальных случаев происходит каждый год в пределах от Новой Гвинеи до Японии, Таиланда и Вьетнама. По некоторым оценкам, общее количество смертных случаев составляет 120 в год. Кроме того, есть интересная энтологически-фармакологическая связь между отравлением TTX и колдовским фольклором на Гаити. TTX представляет собой главный активный фармакологический компонент, ответственный за введение человека в состояние каталепсии - оцепенения. TTX был выделен из порошка, используемого в колдовских ритуалах, который был приготовлен методами экстракции из различных животных (рыбы, лягушки) и растений.
Дата добавления: 2018-08-06; просмотров: 368; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
