ОПРЕДЕЛЕНИЕ АКТИВНОСТИ ЭНДОГЛЮКАНАЗ СОЛОДА
Цель работы:Освоить методику определения активности эндоглюканаз солода.
Общие положения
Система целлюлолитических ферментов (целлюлаз) содержит главным образом три типа целлюлолитических ферментов: эндо-1,4-β-глюканазы, экзо-1,4-β-глюканазы и β-глюкозидазы.
Эндо-1,4-β-глюкан-4-глюканогидролазы (КФ 3.2.1.4) неупорядоченным способом гидролизуют β-1,4-связи в β-1,4-глюканах.
Экзо-1,4-β-глюкан-4-глюкогидролазы (КФ 3.2.1.74) отщепляют глюкозу с невосстанавливающих концов ангидроглюкозных цепей β-глюканов.
Данная система целлюлолитических ферментов расщепляет нативную целлюлозу до глюкозы. Механизм ферментативного расщепления целлюлозы различен в зависимости от типа ферментов.
Эндо-1,4-β-глюканазы характеризуются способностью гидролизовать неупорядоченным образом внутренние связи в β-1,4-глюканах и олигосахаридах, состоящих из остатков β-1,4-D-глюкозы, с образованием сначала олигосахаридов с более короткими цепями, а затем - целлобиозы и глюкозы.
Основная роль эндоглюканаз заключается в быстром снижении вязкости растворов водорастворимого производного целлюлозы - Na-кар-боксиметилцеллюлозы (Na-КМЦ) с образованием небольшого количества восстанавливающих веществ.
Оптимум рН целлюлолитических систем находится в области 4-6. Целлюлолитические системы характеризуются относительной термостабильностью, температурный оптимум многих из них при 60° С.
Целлюлоза (клетчатка) является высокомолекулярным полисахаридом и представляет собой линейный β-1,4-глюкан (С6Н10О5)n с видовой специфичностью степени полимеризации. Ее молекула представляет собой длинную неразветвленную цепь остатков глюкозы, соединенных между собой β-гликозидной связью.
Наиболее распространенным видом целлюлозосодержащего сырья являются отходы различных отраслей промышленности и сельского хозяйства: солома пшеницы, ржи, риса; просяная, овсяная и подсолнечная лузга; отходы деревообрабатывающей и лесной промышленности.
Процесс ферментативного гидролиза этих целлюлозосодержащих материалов протекает с довольно низкой скоростью. Для характеристики действия целлюлолитических ферментов используют субстраты, полученные в результате предварительной обработки указанных выше целлюлозосодержащих материалов.
При определении активности эндоглюканазы (Сх-фермента) в качестве субстратов чаще всего используют растворимые производные целлюлозы. Наиболее пригодным из них является натриевая соль карбоксиметилцеллюлозы (Na-КМЦ) и натриевая соль эфира целлюлозы и гликолевой кислоты. Na-КМЦ может быть получена при действии на целлюлозу в щелочной среде монохлоруксусной кислоты или ее натриевой соли. Степень замещения Na-КМЦ является главным фактором, определяющим ее растворимость.
Важнейшая роль в полиферментной системе принадлежит эндоглюканазам. Роль эндоглюканаз заключается в неупорядоченной деструкции целлюлозных цепей, приводящей к образованию промежуточных целлоолигоса-харидов, которые, в свою очередь, атакуются экзоферментами - целло-биогидролазами и экзоглюканазами. Эндоглюканаза создает субстрат для экзоферментов. Эндоглюканазы характеризуются различной субстратной специфичностью по отношению к замещенным производным целлюлозы.
Активность эндоглюканазы определяют:
• по способности осахаривать Na-КМЦ;
• по снижению вязкости растворов Na-КМЦ (вискозиметрические методы);
• по снижению мутности суспензий аморфной целлюлозы (турбиди-метрический метод).
Для определения активности целлюлаз по количеству образовавшихся углеводов применяют колориметрические, спектрофотометрические и титриметрические и вискозиметрические методы анализа.
За единицу эндоглюканазной активности в данном методе принято такое количество фермента, которое катализирует за 1 ч гидролиз целлюлозы с образованием 1 мг глюкозы в принятых условиях.
Вискозиметрический метод, основанный на увеличении текучести раствора Na-КМЦ
Метод основан на определении скорости уменьшения вязкости 0,3 %-ного раствора Na-КМЦ после действия целлюлазы. Для приготовления субстрата используют Na-КМЦ со степенью замещения 65,3% и степенью полимеризации 347 глюкозных единиц.
Эндоглюканазную активность определяют по способности снижать вязкость раствора Na-КМЦ при температуре 28° С с применением вискозиметра Оствальда.
За единицу эндоглюканазной активности в данном методе принято такое количество фермента, которое в принятых условиях опыта приводит к увеличению текучести (величины, обратной относительной вязкости), равному 1 мин- 1.
Текучесть
b =  , (7.9)
, (7.9)
где te u t0 - продолжительность истечения воды и реакционной смеси, с.
Скорость возрастания этой величины в единицу времени является линейной функцией концентрации фермента.
Аппаратура и реактивы: Вискозиметр; водяная баня; термометр; ацетатный буферный раствор с рН 4,7; субстрат – 0,3 %-ный раствор Na-КМЦ в ацетатном буферном растворе; ферментный раствор; дистиллированная вода.
Приготовление ферментного препарата.Взвешивают 5 г измельченного воздушно-сухого солода, или 10 г зеленого солода из расчета на сухое вещество, с точностью до 0,01 г, прибавляют 5 см3 фосфатного буферного раствора и 45 см3 дистиллированной воды. Полученную смесь перемешивают и выдерживают в термостате 30 мин при температуре 30-35 °С, затем раствор фильтруют и фильтрат используют для анализа.
Приготовление субстрата – 0,3 %-ного раствора натриевой соли карбоксиметилцеллюлозы (Na-КМЦ).0,3 г Na-КМЦ взвешивают с точностью до 0,0001 г и количественно переносят каждую навеску в мерные колбы вместимостью 100 см3. Приливают 50 см3 0,1 М ацетатного буферного раствора и колбу с содержимым периодически погружают в кипящую водяную баню при непрерывном помешивании. После полного растворения Na-КМЦ содержимое колб охлаждают до комнатной температуры, доводят объем до метки тем же ацетатным буферным раствором и перемешивают.
Порядок проведения работы
Перед определением активности фермента устанавливают продолжительность истечения 6 см3 дистиллированной воды. Затем в вискозиметр Оствальда вносят 5 см3 0,3 %-ного раствора Na-КМЦ в ацетатном буферном растворе с рН 4,7, перемешивают продуванием, добавляют 1 см3 испытуемого ферментного раствора и сразу же включают секундомер. Реакционную смесь перемешивают продуванием и через 2 мин с момента включения секундомера измеряют время истечения. Определение повторяют, добиваясь сходимых результатов.
Активность эндоглюканазы (ед./г) рассчитывают по формуле:
ЦАх = 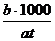 ,
,
где b - текучесть; 1000 - коэффициент перевода миллиграммов в граммы; а - количество ферментного препарата в реакционной смеси, мг; t - длительность действия фермента на субстрат, мин.
Пример.Определить эндоглюканазную активность ферментного препарата целлокандина Г3х. Готовят ферментный раствор, содержащий 0,1 г препарата в 100 см3 дистиллированной воды. а = 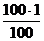 = 1 мг препарата.
= 1 мг препарата.
В результате замеров получено, что продолжительность истечения воды составила 10 с, реакционной смеси - 22,5 с.
b = 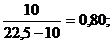 ЦАх =
ЦАх = 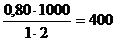 ед./г.
ед./г.
Запись в лабораторном журнале производится по следующей форме:
| Наименование показателя | 1 повторность | 2 повторность | Среднее значение |
| Продолжительность истечения воды, с | |||
| Продолжительность истечения реакционной смеси, с | |||
| Активность эндоглюканазы, ед/см3 |
Вопросы для самоконтроля знаний
1. Механизм ферментативного расщепления целлюлозы цитолитическими ферментами.
2. В чем заключается основная роль эндоглюканаз?
3. Оптимум рН целлюлолитических систем.
4. Температурный оптимум целлюлолитических систем.
5. Что используется в качестве субстрата для определения эндоглюканазной активности ферментов?
6. На чем основаны методы определения целлюлолитической активности?
Лабораторная работа № 11
Определение СОДЕРЖАНИЯ аминного азота в солоде
(медный способ)
Цель работы:Определить степень растворения солода по количеству образовавшегося аминного азота.
Общие положения
Все (высокомолекулярные) протеины за исключением небольшого количества выпадают в осадок самое позднее при кипячении сусла. Поэтому в пиво попадают только продукты расщепления, которые, однако, безусловно, необходимы для размножения дрожжей и быстрого сбраживания.
Ферментативное расщепление белковых веществ должно рассматриваться дифференцированно, так как:
- при 45-50°С в большей степени образуются низкомолекулярные продукты расщепления, особенно пептиды и аминокислоты;
- при 60-70 °С в большей степени образуются высокомолекулярные продукты расщепления, которые считаются обеспечивающими пеностойкость.
Таблица 3 Влияние продуктов расщепления белка на качество пива
| Продукты расщепления белка | Положительное влияние | Отрицательное влияние |
| Высокомолекулярные продукты расщепления | Пенообразователи | Создают помутнения |
| Низкомолекулярные продукты расщепления | Bкуc (полнота вкуса) | Питание дрожжей |
Аминокислоты имеют большое значение для питания дрожжей. Дрожжи потребляют как минимум 10-14 мг α-аминного азота на 100 мл сусла.
Так как аминокислота пролин как поставщик α-аминокислоты для дрожжей не используется, то в сусле должно содержаться α-аминного азота не менее 20 мг/100 мл. Если значения не удастся обеспечить, то это приводит:
- к снижению скорости размножения дрожжей;
- к торможению процессов брожения и созревания;
- к сохранению в пиве нежелательных веществ, придающих ему букет молодого пива.
Из хорошо растворенного солода всегда получают сусло, содержащее достаточное количество α-аминокислот.
Метод определения аминного азота основан на способности большинства аминокислот и пептидов образовывать растворимые комплексные соединения с медью. Избыток меди оттитровывают, а ее количество, эквивалентное аминному азоту, переводят в соль уксусной кислоты и определяют количественно йодометрическим титрованием.
Аппаратура и реактивы: водяная баня; мерная колба вместимостью 100 см3; бюретка; фильтровальная бумага; раствор хлорида меди; раствор трехзамещенного фосфата натрия; боратный буферный раствор; суспензия фосфата меди; раствор тимолфталеина; 0,01 н. раствор тиосульфата натрия (Na2S2O3 ); 1 н раствор NaOH; 80%-ная (ледяная) уксусная кислота; йодид калия; 1 %-ный раствор крахмала.
Приготовление раствора хлорида меди. 27,3 г хлорида меди растворяют в 1 дм3 воды.
Приготовление раствора трехзамещенного фосфата натрия. 64,5 г двухосновного фосфата натрия растворяют в 500 мл дистиллированной воды, лишенной СО2, добавляют 7,2 г NaOH и после растворения доливают водой до 1 л.
Приготовление боратного буферного раствора. 57,21 г буры растворяют в 1,5 дм3 воды, добавляют 100 см3 1 н раствора НС1 и доводят водой до 2 дм3).
Приготовление суспензии фосфата меди. Один объем хлорида меди смешивают с двумя объемами раствора боратного буферного раствора. Суспензию можно использовать в течение 2-3 сут.
Приготовление раствора тимолфталеина. 0,25 г тимолфталеина растворяют в 100 см3 50 %-ного этилового спирта.
Приготовление 0,01 н. раствора Na2S2O3 . Готовится ежедневно путем разбавления 0,1 н. раствора Na2S2O3 с последующей проверкой титра по KJO3.
Приготовление сусла. См. лабораторную работу №3.
Приготовление 1%-ного раствора крахмала. Навеску 1 г растворимого крахмала (в пересчете на сухое вещество) тщательно перемешивают с 99 см3 холодной воды и при непрерывном взбалтывании растворяют на кипящей водяной бане. Раствор кипятят в течение 5 мин, затем охлаждают при непрерывном размешивании, чтобы на поверхности не образовалась пленка.
Порядок выполнения работы
В ходе определения 10 см3 сусла помещают в мерную колбу вместимостью 100 см3, прибавляют 3-4 капли тимолфталеина и 1 н раствор гидроксида натрия до получения бледно-голубого окрашивания. Осторожно при перемешивании несколькими порциями приливают 30 см3 суспензии фосфата меди, а затем колбу доводят до метки дистиллированной водой. Смесь тщательно перемешивают и фильтруют через бумажный фильтр, перефильтровывая первые порции фильтрата.
10 см3 совершенно прозрачного фильтрата подкисляют 0,5 см3 80%-ной (ледяной) уксусной кислоты, прибавляют к нему 1 г йодида калия и после размешивания выделившийся свободный йод оттитровывают 0,01 н раствором тиосульфата натрия, добавляя под конец титрования 1-2 капли 1 %-ного раствора крахмала. Титрование заканчивается при достижении обесцвечивания раствора.
Количество пошедшего на титрование тиосульфата натрия, умноженное на 0,28, дает содержание аминного азота в 10 см3 фильтрата, что соответствует 2 см3 сусла с учетом разбавления (исходя из того, что 1 см3 0,01н раствора тиосульфата соответствует 0,28 г азота).
Количество аминного азота Nа (в мг) в 100 см3 сусла вычисляется по формуле
Nа = а · 0,28 · 5 · 10 ,
где а – количество 0,01н раствора тиосульфата натрия, пошедшее на титрование выделившегося йода, см3; 5 и 10 – коэффициенты пересчета с 2 см3 на 100 см3.
В 100 г экстракта аминного азота:
N1 =  ,
,
где ρ – относительная плотность сусла;
m – массовая доля сухих веществ в сусле,%.
Если солод перерастворен, то в 100 г экстракта будет содержаться более 230 мг аминного азота; если солод очень хорошо растворен – 230…200 мг; если хорошо растворен – 200…180 мг; если плохо растворен – менее 180 мг.
В пересчете на 100 г СВ солода содержание аминного азота варьирует от 120 до 160 мг.
Запись в лабораторном журнале производится по следующей форме:
| Наименование показателя | 1 повторность | 2 повторность | Среднее значение |
| Влажность солода (W), % | |||
| Количество 0,01н раствора тиосульфата натрия, пошедшее на титрование выделившегося йода (а), см3 | |||
| Содержание аминного азота в 100 см3 сусла (Nа), мг | |||
| В 100 г экстракта аминного азота (N1), мг |
Пример. На титрование лабораторного сусла относительной плотностью 1,0357 (содержание сухих веществ 8,951%) пошло 1,28 см3 тиосульфата. Содержание аминного азота в 100 см3 сусла будет
Nа = 1,28 · 0,28 · 5 · 10 = 17,92 мг.
В 100 г экстракта аминного азота N1 = 17,92 · 100 / (1,0357 · 8,951) = 193,3 мг.
Вопросы для самоконтроля знаний
1. Назовите продукты расщепления белковых веществ.
2. Какое влияние они оказывают на вкус и качество пива?
3. Какое значение имеют аминокислоты при приготовлении пива?
4. Как можно регулировать образование тех или иных продуктов расщепления белковых веществ?
Лабораторная работа №12
Дата добавления: 2018-04-05; просмотров: 1739; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
