Передача энергии между системой и окружающей средой : Теплота и работа идеального газа
Системой называют отдельное тело или группу тел, фактически или мысленно отделенных от окружающей среды.Систему называют термодинамической, если между телами ее составляющими может происходить обмен теплотой, веществом, и если система полностью описывается термодинамическими параметрами (кипящий чайник).
Открытая термодинамическая система – это такая система, которая может обмениваться с окружающей средой энергией и веществом, (например, кипящий чайник).
Обмен энергией между системой и окружающей средой может осуществляться в различных формах. Форм энергии много: тепловая, механическая, ядерная, химическая, световая и др., но существует всего 2 типа энергии: кинетическая (энергия движущегося тела) и потенциальная ( энергия, приобретенная в результате изменения телом и его частями положения в пространстве).
В термодинамических процессах изменяется только кинетическая энергия движущихся молекул (тепловой энергии недостаточно, чтобы изменить строение атома, а тем более ядра). Следовательно, фактически под внутренней энергией в термодинамике подразумевают энергию теплового хаотического движения молекул.
Внутренняя энергия U одного моля идеального газа равна:
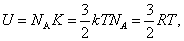 или или
|
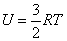
|
Таким образом, внутренняя энергия зависит только от температуры. Внутренняя энергия U является функцией состояния системы, независимо от предыстории.
|
|
|
Обмен механической энергией характеризуется совершенной работой А, а обмен внутренней энергией – количеством переданного тепла Q.
Итак, работа и теплота не есть особые формы энергии. Нельзя говорить о запасе теплоты или работы. Это мера переданной другой системе механической или внутренней энергии. Вот о запасе этих энергий можно говорить. Кроме того, механическая энергия может переходить в тепловую энергию и обратно.
Опыт показывает, что во всех случаях, превращение механической энергии в тепловую и обратно совершается всегда в строго эквивалентных количествах. В этом и состоит суть первого начала термодинамики, следующего из закона сохранения энергии.
Количество теплоты, сообщаемой телу, идёт на увеличение внутренней энергии и на совершение телом работы:
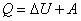 , ,
| (4.1.1) |
– это и есть первое начало термодинамики, или закон сохранения энергии в термодинамике.
Правило знаков: 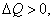 если тепло передаётся от окружающей среды данной системе,
если тепло передаётся от окружающей среды данной системе, 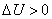 и
и 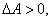 если система производит работу над окружающими телами, при этом
если система производит работу над окружающими телами, при этом 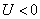 . Учитывая правило знаков, первое начало термодинамики можно записать в виде:
. Учитывая правило знаков, первое начало термодинамики можно записать в виде:
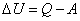 , ,
|
– изменение внутренней энергии тела равно разности сообщаемой телу теплоты и произведённой телом работы.
|
|
|
Выражение (4.1.1) для малого изменения состояния системы будет иметь вид:
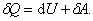
| (4.1.2) |
В этом выражении U – функция состояния системы; dU – её полный дифференциал, а δQ и δА таковыми не являются. В каждом состоянии система обладает определенным и только таким значением внутренней энергии, поэтому можно записать:
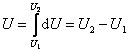 , ,
|
Важно отметить, что теплота Q и работа А зависят от того, каким образом совершен переход из состояния 1 в состояние 2 (изохорически, адиабатически и т.д.), а внутренняя энергия U не зависит. При этом нельзя сказать, что система обладает определенным для данного состояния значением теплоты и работы.
Особое значение в термодинамике имеют круговые или циклические процессы, при которых система, пройдя ряд состояний, возвращается в исходное. На рисунке 4.1 изображен циклический процесс 1–а–2–б–1, при этом была совершена работа А.
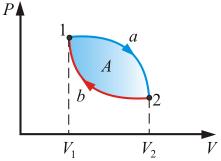
Рис. 4.1
Так как U – функция состояния, то
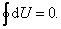
| (4.1.3) |
Это справедливо для любой функции состояния.
Если 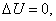 то согласно первому началу термодинамики
то согласно первому началу термодинамики 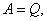 , т.е. нельзя построить периодически действующий двигатель, который совершал бы бóльшую работу, чем количество сообщенной ему извне энергии. Иными словами, вечный двигатель первого рода невозможен. Это одна из формулировок первого начала термодинамики.
, т.е. нельзя построить периодически действующий двигатель, который совершал бы бóльшую работу, чем количество сообщенной ему извне энергии. Иными словами, вечный двигатель первого рода невозможен. Это одна из формулировок первого начала термодинамики.
|
|
|
2…Парциальные и интегральные мольные величины и методы их определения . Уравнение Гиббса-Дюгема.
Дата добавления: 2018-04-04; просмотров: 954; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
