Напишите уравнение Аррениуса для энергии активации. Объясните ее физический смысл
Аррениус высказал мысль, что реакционноспособными являются не все, а только активные молекулы N*. Согласно теории Аррениуса соударения будут эффективными только тогда, когда встречающиеся молекулы обладают некоторым избытком энергии по сравнению со средней энергией молекул в системе при данной температуре. Молекулы, несущие в себе эту избыточную энергию называются активными, а сам избыток энергии – энергией активации.
Аррениус (1889) предложил эмпирическое уравнение, связывающее константу скорости с температурой
 (16.4)
(16.4)
 (16.5)
(16.5)
где  .
.
 – энергия активации, кал/моль;
– энергия активации, кал/моль;
R – универсальная газовая постоянная, кал/моль·К

Рис. 16.2 График зависимости lgk=f ( 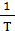 )
)
 (16.6)
(16.6)
Следовательно, тангенс угла наклона зависимость lgk=f ( 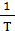 ) определяет величину энергии активации химической реакции.
) определяет величину энергии активации химической реакции.
Таким образом, анализируя экспериментальную зависимость lgk от 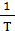 можно определить
можно определить  . Однако для сложных реакций не получается линейной зависимости и уравнение Аррениуса не выполняется. В этих случаях эффективная энергия активации изменяется с температурой и ее находят, используя уравнение
. Однако для сложных реакций не получается линейной зависимости и уравнение Аррениуса не выполняется. В этих случаях эффективная энергия активации изменяется с температурой и ее находят, используя уравнение

по наклону касательной к кривой зависимости lgk=f ( 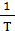 ) в нужной точке.
) в нужной точке.
По физическому смыслу  – можно определить как некоторую избыточную энергию по сравнению со средней энергией молекул при данной температуре, которой они должны обладать, чтобы их столкновение привело к химической реакции (
– можно определить как некоторую избыточную энергию по сравнению со средней энергией молекул при данной температуре, которой они должны обладать, чтобы их столкновение привело к химической реакции (  ≈ 10−100 ккал/моль (50−250 кДж/моль)). Таким образом,
≈ 10−100 ккал/моль (50−250 кДж/моль)). Таким образом,  – это энергетический и активационный барьер реакции, определяемый природой реагирующих веществ и катализатора.
– это энергетический и активационный барьер реакции, определяемый природой реагирующих веществ и катализатора.
|
|
|
Задача.
БИЛЕТ 13
Термодинамические потенциалы. Энергия Гиббса и энергия Гельмгольца, уравнения полных дифференциалов, физический смысл и значение для физико-химических расчетов.
Энергия Гельмгольца и Гиббса.
Свободная энергия Гиббса — это величина, показывающая изменение энергии в ходе химической реакции и дающая ответ на принципиальную возможность химической реакции; это термодинамический потенциал следующего вида:

Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Дифференциал энергии Гиббса для системы с постоянным числом частиц, выраженный в собственных переменных — через давление p и температуру T:

Для системы с переменным числом частиц этот дифференциал записывается так:

Здесь μ — химический потенциал, который можно определить как энергию, которую необходимо затратить, чтобы добавить в систему ещё одну частицу.
Свобо́дная эне́ргияГельмго́льца (или просто свобо́дная эне́ргия) — термодинамический потенциал, убыль которого в квазистатическом изотермическом процессе равна работе, совершённой системой над внешними телами.
|
|
|
Свободная энергия Гельмгольца для системы с постоянным числом частиц определяется так:
 , где U — внутренняя энергия, T — абсолютная температура, S — энтропия.
, где U — внутренняя энергия, T — абсолютная температура, S — энтропия.
Отсюда дифференциал свободной энергии равен:

Видно, что это выражение является полным дифференциалом относительно независимых переменных T и V. Поэтому часто свободную энергию Гельмгольца для равновесного состояния выражают как функцию  .
.
Для системы с переменным числом частиц дифференциал свободной энергии Гельмгольца записывается так:
 ,
,
где μ — химический потенциал, а N — число частиц в системе. При этом свободная энергия Гельмгольца для равновесного состояния записывается как функция 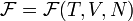 .
.
14. Энергия Гельмгольца и максимальная работа. 

Дата добавления: 2018-04-04; просмотров: 888; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
