Второй и третий постулаты формальной кинетики. Связь кинетических и термодинамических характеристик химических реакций
76. Второй и третий постулаты формальной кинетики. Связь кинетических и термодинамических характеристик химических реакций. (см. лекции)
См. в 75, 2


(в единице объема)
Задача.
БИЛЕТ 10
Третье начало термодинамики. Абсолютная и стандартная энтропия вещества. Расчет энтропии индивидуального вещества.
Абсолютные значения внутренней энергии и энтальпии невозможно вычислить даже для простых систем. Абсолютные значения энтропии рассчитываются как для простых, так и для сложных веществ, поскольку у них имеется начальная точка в шкале отсчета, устанавливаемая третьим законом термодинамики.
Третье начало термодинамики формулируется следующим образом:
при температуре абсолютного нуля (Т = 0К) энтропия идеального кристалла любого простого или сложного вещества равна нулю
Абсолютная и стандартная энтропия вещества. Расчет энтропии индивидуального вещества
Энтропию ST называют абсолютной энтропией. Она численно равна изменению энтропии при равновесном переходе 1 моля кристаллического вещества от абсолютного нуля до данной температуры.
Абсолютную энтропию тела в стандартном состоянии при данном Т называют стандартной энтропией и обозначают через SoT;
Стандартная энтропия вещества – абсолютное значение энтропии вещества при стандартных условиях в любом данном агрегатном состоянии.
Постулат Планка. Расчет абсолютного значения энтропии газообразного вещества.
|
|
|
Возможность вычислить абсолютное значение энтропии положение, которое было сформулировано Планком (1912). Согласно этому положению, называемому постулатом Планка энтропия индивидуального кристаллического вещества при абсолютном нуле равна нулю:
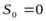 (4.39)
(4.39)
Постулат Планка справедлив только для индивидуальных веществ, кристаллы которых идеально построены, такие тела называются идеальными твердыми телами. Реальные кристаллы не являются таковыми. Поэтому реальные кристаллы при 0 К обладают энтропией больше нуля.
В соответствии с постулатом Планка уравнение для идеального твердого тела примет вид:
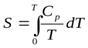 (4.40)
(4.40)
Можно показать, что при очень низких температурах не только энтропия и теплоемкость твердого тела стремятся к нулю (как это установлено экспериментально), но и многие другие свойства твердых тел (объем тела, давление насыщенного пара и др.) изменяются с температурой так, что их производные по температуре стремятся к нулю. Этим объясняется принцип недостижимости абсолютного нуля, согласно которому никакие процессы не могут снизить температуру тела до абсолютного нуля.
Постулат Планка используется при термодинамических расчетах химических процессов для вычисления абсолютных значений энтропий химических соединений. Энтропия твердого вещества вычисляется по уравнению (4.40). Для вычисления необходимо знать экспериментальные значения теплоемкостей, определенные для возможно низких температур до 10 К или 80 К. Значения теплоемкостей до 0 К находят путем экстраполяции по уравнениям Дебая или Тарасова либо с помощью эмпирических приемов.
|
|
|
Уравнение для вычисления энтропии газа при некоторой температуре  будет иметь вид:
будет иметь вид:
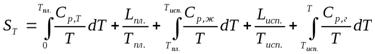 , (4.41)
, (4.41)
где 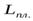 и
и 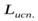 . – удельные теплоты агрегатных превращений.
. – удельные теплоты агрегатных превращений.
Очевидно, что энтропию вещества, находящегося в жидком состоянии при температуре 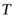 , также можно вычислить по уравнению (4.41), исключив два последних члена в правой части:
, также можно вычислить по уравнению (4.41), исключив два последних члена в правой части:
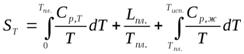 (4.42)
(4.42)
Абсолютное значение энтропии какого-либо вещества при любой температуре можно рассчитать, если известна абсолютная энтропия при какой-то одной температуре, например, при 298К и температурные коэффициенты теплоемкости:
 ,
, 
Дата добавления: 2018-04-04; просмотров: 488; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
