Избыточная внутренняя энергия и энтальпия
Внутренней энергией (U) называется находящаяся в веществе или системе в скрытом виде энергия, которая включает: внутриядерную энергию, энергию движения электронов в атомах, энергию химических связей между атомами, энергию внутримолекулярных колебаний атомов и атомных групп, энергию поступательного и вращательного движения молекул, т.е. все виды энергии, кроме кинетической и потенциальной энергии системы в целом.
| Процесс | Характеристика процесса | Изменения внутренней энергии | Теплота | Работа |
| Изохорный | 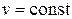 , , 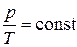
| 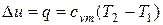
| 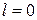
| |
| Изобарный |  , , 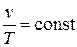
| 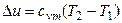
| 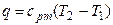
| 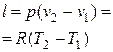
|
| Изотермический | 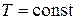 , , 
| 
| 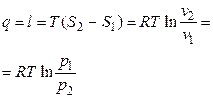
| |
| Адиабатный | 
| 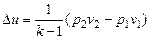 
| 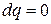
|  
|
| Политропный | 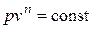
| 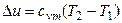
| 
| 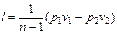 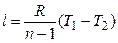
|
Энтальпией(H) называется сумма внутренней энергии и произведения давления на объем:
H = U + p·V
Абсолютная величина энтальпии, как и внутренней энергии, не может быть определена. В практических расчетах пользуются изменением этой величины:
ΔH = ΔU + p·ΔV
Внутренняя энергия и энтальпия связаны с тепловым эффектом реакции (Q). Эта взаимосвязь вытекает из первого закона термодинамики, который является законом сохранения энергии в применении к тепловым явлениям. Первый закон имеет несколько различныхформулировок, наиболее близкое отношение к химии имеет следующая: количество теплоты, полученное системой, равно сумме увеличения ее внутренней энергии и произведенной ею работы:
Q = ΔU + A = ΔU + p·ΔV
В изохорных реакциях объем не изменяется, следовательно ΔV = 0 и Qv= ΔU, т.е. тепловой эффект изохорного процесса равен изменению внутренней энергии и, наоборот, изменение внутренней энергии численно равно тепловому эффекту изохорного процесса.
В изобарных реакциях p = const, aΔV не равно 0, следовательно:
Qp= ΔU + p·ΔV = (U2 – U1) + p·(V2 – V1)
Проведем перестановки:
Qp = (U2 + p·V2) – (U1 + p·V1) = H2 – H1 = ΔH
Таким образом тепловой эффект изобарного процесса равен изменению энтальпии:
Qp = ΔH
Большинство химических реакций является изобарными, поэтому тепловой эффект химических реакций обычно отождествляется с её энтальпией. Для экзотермических процессов энтальпия имеет отрицательный, а для эндотермических – положительный, т.е. энтальпии реакции знак присваивается с позиций «внутреннего наблюдателя».
Уравнение Клайперона-Клаузиуса, применение его к фазовым переходам.
Уравнение Клайперона-Клаузиуса.
Уравнение Клапейрона — Клаузиуса — термодинамическое уравнение, относящееся к равновеснымпроцессам перехода вещества из одной фазы в другую (испарение, плавление, сублимация, полиморфное превращение и др.). Согласно уравнению, теплота фазового перехода (например, теплота испарения, теплота плавления) при равновесном процессе определяется выражением
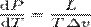
где L — удельная теплота фазового перехода, Δv — изменение удельного объёма тела при фазовом переходе.
Дата добавления: 2018-04-04; просмотров: 654; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
