Классификация обратимых электродов
Электроды первого рода - любой металл, погруженный в раствор соли этого же металла. Образует окислительно-восстановительную систему, в которой потенциал электрода определяется относительно концентрации катионов в растворе. К электродам первого рода относятся ртутные, серебряные, платиновые, водородные и другие.
Электроды второго рода - система, в которой металл, покрытый слоем его труднорастворимого соединения (соли, оксида или гидроксида), находится в равновесии с раствором, содержащим избыток другой хорошо растворимой соли с таким же анионом. Потенциал такого электрода определяется концентрацией соответствующего аниона. К электродам второго рода относятся хлорид-серябряный, каломельный и сурьмяный электроды, часто применяемые в качестве электродов сравнения.
Окислительно-восстановительные электроды - инертное вещество с электронной проводимостью (например, платина), погруженное в раствор, содержащий вещества с различной степенью окисления Red и Ox. В качестве электродов этого типа чаще всего применяют платиновую или серебряную проволоку, помещенную в стеклянный корпус. Инертный электрод выполняет только функцию переноса электронов от восстановленной формы к окисленной.
Ионообменные электроды. Ионообменный электрод состоит из двух фаз: ионита и раствора, а потенциал на границе раздела фаз возникает за счет ионнообменного процесса, в результате которого на поверхности ионита и раствора приобретают электрические заряды противоположного знака.К этой группе относится стеклянный электрод.
|
|
|
3.Скорость химической реакции как критерий реакционной способности химической системы. Средняя и истинная скорость химической реакции.
Скорость химической реакции как критерий реакционной способности химической системы. Средняя и истинная скорость химической реакции.
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ:
V = ± ((С2 - С1) / (t2 - t1)) = ± (ΔС / Δt)
где С1 и С2 - молярные концентрации веществ в моменты времени t1 и t2 соответственно (знак (+) - если скорость определяется по продукту реакции, знак (-) - по исходному веществу).
Реакции происходят при столкновении молекул реагирующих веществ. Ее скорость определяется количеством столкновений и вероятностью того, что они приведут к превращению. Число столкновений определяется концентрациями реагирующих веществ, а вероятность реакции - энергией сталкивающихся молекул.
Факторы, влияющие на скорость химических реакций.
1. Природа реагирующих веществ. Большую роль играет характер химических связей и строение молекул реагентов. Реакции протекают в направлении разрушения менее прочных связей и образования веществ с более прочными связями. Так, для разрыва связей в молекулах H2 и N2 требуются высокие энергии; такие молекулы мало реакционноспособны. Для разрыва связей в сильнополярных молекулах (HCl, H2O) требуется меньше энергии, и скорость реакции значительно выше. Реакции между ионами в растворах электролитов протекают практически мгновенно.
Примеры
Фтор с водородом реагирует со взрывом при комнатной температуре, бром с водородом взаимодействует медленно и при нагревании.
Оксид кальция вступает в реакцию с водой энергично, с выделением тепла; оксид меди - не реагирует.
2. Концентрация. С увеличением концентрации (числа частиц в единице объема) чаще происходят столкновения молекул реагирующих веществ - скорость реакции возрастает.
Закон действующих масс (К. Гульдберг, П.Вааге, 1867г.)
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
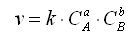
|
|
|
Константа скорости реакции k зависит от природы реагирующих веществ, температуры и катализатора, но не зависит от значения концентраций реагентов.
Физический смысл константы скорости заключается в том, что она равна скорости реакции при единичных концентрациях реагирующих веществ.
Для гетерогенных реакций концентрация твердой фазы в выражение скорости реакции не входит.
3. Температура. При повышении температуры на каждые 10°C скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа). При увеличении температуры от t1 до t2 изменение скорости реакции можно рассчитать по формуле:
|
|
|
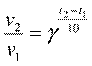
(где V2 и V1 - скорости реакции при температурах t2 и t1 соответственно; γ- температурный коэффициент данной реакции).
Правило Вант-Гоффа применимо только в узком интервале температур. Более точным является уравнение Аррениуса:
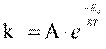
где A - постоянная, зависящая от природы реагирующих веществ;
R - универсальная газовая постоянная [8,314 Дж/(моль۰К) = 0,082 л атм/(моль К)];
Ea - энергия активации, т.е. энергия, которой должны обладать сталкивающиеся молекулы, чтобы столкновение привело к химическому превращению. Чем больше энергия активации Ea, тем сильнее возрастает скорость реакции при увеличении температуры.
4. Поверхность соприкосновения реагирующих веществ. Для гетерогенных систем (когда вещества находятся в разных агрегатных состояниях), чем больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, а для растворимых веществ - путем их растворения.
5. Катализаторы. Вещества, которые участвуют в реакциях и увеличивают ее скорость, оставаясь к концу реакции неизменными, называются катализаторами. Механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений. При гомогенном катализе реагенты и катализатор составляют одну фазу (находятся в одном агрегатном состоянии), при гетерогенном катализе - разные фазы (находятся в различных агрегатных состояниях). Резко замедлить протекание нежелательных химических процессов в ряде случаев можно добавляя в реакционную среду ингибиторы (явление "отрицательного катализа").
|
|
|
Средняя и истинная скорости
Скоростью химической реакции называют количество элементарных актов реакции, совершающихся в единицу времени.
Различают среднюю и истинную скорость реакции. Средней скоростью реакции называют отношение изменения концентрации вещества (уменьшения концентрации исходного вещества или увеличение концентрации продукта реакции) к промежутку времени, в течение которого это изменение произошло:
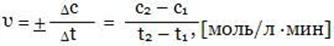
Скорость реакции всегда считается величиной положительной, но отношение Δc/Δt может быть отрицательным, если υ изучается по изменению концентрации исходных веществ.
Чем ближе сдвигаются между собой t1 и t2, тем меньше становится Δt и Δc. Тогда отношение Δc/Δt все больше приближается к значению истинной скорости. Предельная величина Δc/Δt, когда Δt стремится к нулю как к своему пределу (Δt → 0), называется истинной скоростью химической реакции:
υ = lim (± Δc/Δt) = ± dc/dt,
где dc/dt - производная от концентрации по времени. Истинную скорость еще называют мгновенной скоростью реакции, т.е. скорость в данный момент времени.
Задача.
БИЛЕТ 9
Дата добавления: 2018-04-04; просмотров: 675; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
