Уравнение изобары и изохоры реакции. Применение
Уравнение изобары и изохоры химической реакции. Правило Ле-Шателье.
Уравнение изобары:
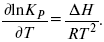
Уравнение изохоры:

По ним судят о направлении протекания реакции:

1) реакция экзотермическая. С увеличением температуры константа скорости уменьшается, равновесие смещается в сторону образовании исходных веществ.
Реакция эндотермическая. С увеличением температуры константа скорости тоже увеличивается, равновесие сдвигается в сторону образования продуктов реакции
3)∆Н=0, дробь =0
2.Идеальные и предельно разбавленные растворы. Законы Рауля и Генри.
Понятие идеального раствора.
Идеальным раствором называют раствор, для которого выполняется первый закон Рауля.
Идеальными при любых концентрациях являются растворы, компоненты которых близки по физическим и химическим свойствам (оптические изомеры, гомологи и т. п.), и образование которых не сопровождается объёмными и тепловыми эффектами. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором.
Первый закон Рауля:
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.

Для бинарного раствора, состоящего из компонентов А и В (компонент А считаем растворителем) удобнее использовать другую формулировку:
Относительное понижение парциального давления пара растворителя над раствором не зависит от природы растворённого вещества и равно его мольной доле в растворе.

Предельно разбавленный раствор получают путем последовательного разбавления исследуемого раствора чистым растворителем.
закону Генри: для предельно разбавленных растворов парциальное давление насыщенного пара растворенного вещества пропорционально его молярной доле:
 , (13)
, (13)
где xi– молярная доля i-го растворенного вещества; ki– константа с размерностью давления, называемая коэффициентом (константой) Генри.
Кондуктометрия.
Кондуктометрия.
Кондуктометрическое титрование.
Метод титрования, при котором точку эквивалентности фиксируют по резкому изменению электропроводности исследуемого раствора, называют кондуктометрическим.
Электропроводность раствора зависит от природы электролита, его концентрации в растворе, природы растворителя и концентрации. Поскольку удельная электропроводность разбавленных растворов пропорциональна концентрации электролита, можно, измеряя электропроводность, определить концентрацию.
Практическое применение этого метода ограничено тем, что электропроводность раствора определяется суммарной концентрацией всех ионов, находящихся в растворе.
Кондуктометрическое титрование имеет большое значение при анализе окрашенных и мутных растворов. Условием применимости этого метода является существенное изменение электропроводности в момент достижения точки эквивалентности. При титровании анализируемого вещества стандартным раствором титранта в случае образования нерастворимого или малодиссоциированного соединения электропроводность раствора снижается вследствие уменьшения количества ионов в растворе. Наименьшее количество ионов, а значит и наименьшая электропроводность раствора будут в точке эквивалентности. После достижения этой точки электропроводность снова начнет возрастать вследствие избытка титранта-электролита.График титрования электропроводность - объем титранта обычно имеет вид ломаной линии, где точки перегиба (излома) соответствуют точкам эквивалентности. Форма кривой титрования зависит от природы реагирующих и образующихся веществ.


Задача
БИЛЕТ 7
Дата добавления: 2018-04-04; просмотров: 993; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
