Средняя ионная активность, коэффициент активности, концентрация
Средняя ионная активность, коэффициент активности, концентрация.
??Общая концентрация ионов в растворе - молярная концентрация растворенного электролита с учетом его степени диссоциации на ионы и числа ионов, на которые диссоциирует молекула электроплита в растворе.
Для сильных электролитов α = 1, поэтому общая концентрация ионов определяется молярной концентрацией электролита и числом ионов, на которые распадается молекула сильного электролита в растворе.
Так, в случае диссоциации сильного электролита - хлорида натрия  в водном растворе
в водном растворе
NaCl → Na+ + Cl-
при исходной концентрации электролита с(NaCl) = 0,1 моль/л концентрации ионов оказываются равными той же величине: с(Na+) = 0,1 моль/л и с(Cl-) = 0,1 моль/л.
Для сильного электролита более сложного состава, например, сульфата алюминия Al2(SO4)3, концентрации катиона и аниона также рассчитываются легко, учитывая стехиометрию процесса диссоциации:
Al2(SO4)3 → 2 Al3+ + 3 SO42-
Если исходная концентрация сульфата алюминия сисх = 0,1 моль/л, то с(А13+) = 2 · 0,1 = 0,2 моль/л и с(SO42-) = 3 · 0,1 = =0,3 моль/л.
Активность а связана с общей концентрацией с формальным соотношением
a=fc,
где f˗ коэффициент активности.
При с → 0 величина а → с, так что f →1, т. е. для предельно разбаленных растворов активность по числовой величине совпадает с концентрацией, а коэффициент активности равен единице.
Льюисом и Рэндаллом были введены некоторые математические поправки в соотношения, предложенные Аррениусом.
|
|
|
Г. Льюис и М. Рендалл предложили метод использования активностей вместо концентраций, что позволило формально учесть все многообразие взаимодействий в растворах без учета их физической природы.
В растворах электролитов одновременно присутствуют и катионы, и анионы растворенного вещества. Вводить в раствор ионы только одного сорта физически невозможно. Даже если бы такой процесс и был выполним, то он вызвал бы значительный рост энергии раствора за счет введенного электрического заряда.
Связь активностей отдельных ионов с активностью электролита в целом устанавливается, исходя из условия электронейтральности. Для этого вводятся понятия средней ионной активности и среднего ионного коэффициента активности.
Если молекула электролита диссоциирует на n+ катионов и n- анионов, то средняя ионная активность электролита a± равна:
 ,
,
где 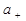 и
и  - активность катионов и анионов соответственно, n- общее число ионов (n=n++ n- ).
- активность катионов и анионов соответственно, n- общее число ионов (n=n++ n- ).
Аналогично записывается средний ионный коэффициент активности электролита  :, характеризующий отклонения реального раствора от идеального
:, характеризующий отклонения реального раствора от идеального
 .
.
Активность можно представить как произведение концентрации на коэффициент активности. Существуют три шкалы выражения активностей и концентраций: моляльность  (моляльная, или практическая шкала), молярностьс (молярная шкала) и мольная доля х(рациональная шкала).
(моляльная, или практическая шкала), молярностьс (молярная шкала) и мольная доля х(рациональная шкала).
|
|
|
В термодинамике растворов электролитов обычно используется моляльная шкала концентраций.
Тогда
 ,
,
где  коэффициент, зависящий от валентного типа электролита.
коэффициент, зависящий от валентного типа электролита.
В молярной шкале  Между средними ионными коэффициентами активностей в моляльной
Между средними ионными коэффициентами активностей в моляльной  и молярной
и молярной  шкалах существует связь:
шкалах существует связь:
 ,
,
где  - плотность чистого растворителя
- плотность чистого растворителя
Задача.
Билет 3
Дата добавления: 2018-04-04; просмотров: 813; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
