Понятие фазового равновесия, условия фазового равновесия. Основные понятия: фаза, компонент, вариантность системы. Правила фаз Гиббса. Применение
Равновесия в гетерогенных системах, связанных с переходом из одной фазы в другую без изменения химического состава, называются фазовыми. К их числу можно отнести равновесия в процессе плавления, испарения, конденсации и т. п. Фазовые равновесия, так же как химические равновесия, характеризуются минимальным значением энергии Гиббса системы, отсутствием изменения этой энергии (∆G= 0) и равенством скоростей прямого и обратного процессов.
Условие фазового равновесия, т.е. значение параметров, характеризующих смесь p, T, C при которых не происходит перенос массы из жидкой фазы в газ и наоборот при адиабатных условиях.
Фазой называется термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества.
Компонент– химически индивидуальные вещества, наименьшего числа которых достаточно для образования всех фаз, т. е. гомогенных частей данной системы.
Правило фаз Гиббса
При изменении внешних параметров равновесие в системе нарушается, при этом изменяются концентрации компонентов или исчезают старые и возникают новые фазы. Изменение в системе происходит до установления нового состояния равновесия.
Этот процесс описывается основным законом состояния равновесия, который носит название правила фаз Гиббса:
В равновесной термодинамической системе, на которую оказывает влияние только давление и температура, число степеней свободы равно числу независимых компонентов минус число фаз плюс два:
С=К-Ф+2
Из этого правила следует, что при числе степеней свободы С=0 система имеет наибольшее число равновесных фаз.
Если на систему, находящуюся в равновесии, кроме давления и температуры оказывают влияние еще и другие внешние факторы, например, магнитное или гравитационное поле, электрические воздействия, то в уравнении число внешних факторов будет больше 2.
Тогда правило фаз запишется так:
С=К-Ф+n
при С=0 Ф=К+n , т.е число фаз не может быть больше, чем К+n: Ф<= К+n
Если равновесие установилось в конденсированной системе, то оно практически не смещается при небольшом изменении давления. В таком случае правило фаз Гиббса для конденсированных систем можно записать:
С=К-Ф+1
Пример. Имеем в равновесии жидкую воду, пар и лед. Рассчитаем число степеней свободы такой системы при условии влияния на систему только двух внешних параметров – давления и температуры:
С= 1-3+2= 0
Это значит, что система нонвариантна, т.е. любое изменение одного из параметров выведет систему из состояния равновесия. Значит, чтобы в системе одновременно сосуществовали все три фазы, необходимо систему держать при определенном значении давления и температуры.
Правило фаз используют при рассмотрении диаграмм состояний и применят для анализа систем, в которых проходят химические превращения.
Связь константы диссациации слабого электролита с эквивалентной электропроводностью. Уравнение Оствальда. Применение.
Скорость и подвижность ионов. Числа переноса. Закон Кольрауша. Закон разведения Оствальда.
Закон разведения Оствальда
Константа диссоциации слабого электролита связана со степенью диссоциации. Обозначим: С – исходная концентрация электролита, α – степень диссоциации. Тогда концентрация ионов в состоянии равновесия для бинарного электролита Сα. Концентрация недиссоциированных молекул будет
(С – С∙α) = С (1–α).
Константу диссоциации для уксусной кислоты можно представить следующим образом:
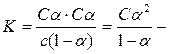 закон разведения Оствальда.
закон разведения Оствальда.
В слабых электролитах величина α << 1. Поэтому значением α можно пренебречь и величину (1-α) принять равной 1. Тогда K=Cα2, 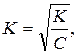 (Перед = не К, а альфа)т.е. степень диссоциации слабых электролитов обратно пропорциональна квадратному корню из концентрации.
(Перед = не К, а альфа)т.е. степень диссоциации слабых электролитов обратно пропорциональна квадратному корню из концентрации.
Таким образом, закон разбавления Оствальда формулируется следующим образом: степень диссоциации электролита при разбавлении раствора увеличивается.
Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации.
Дата добавления: 2018-04-04; просмотров: 765; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
