Напишите объединённое уравнение первого и второго начал термодинамики, объясните его значение

4.Задача.
БИЛЕТ 5
Зависимость теплового эффекта реакции от температуры. Уравнение Кирхгофа в интегральной и дифференциальной форме . Применение.
Зависимость теплового эффекта химической реакции от температуры, уравнения Кирхгофа.
Используя закон Гесса, можно вычислить тепловой эффект реакции при той температуре (обычно это 298К), при которой измерены стандартные теплоты образования или сгорания всех участников реакции.
Но чаще бывает необходимо знать тепловой эффект реакции при различных температурах.
Рассмотрим реакцию:
ν AА+ν BВ= ν CС+ν DD
Обозначим через Н энтальпию участника реакции, отнесенную к 1 молю. Общее изменение энтальпии ΔΗ(Т) реакции выразится равнением:
ΔΗ = (ν C Н С +ν D НD) - (ν A Н А+ν B НВ); va, vb, vc, vd - стехиометрические коэф. х.р.
Если реакция протекает при постоянном давлении, то изменение энтальпии будет равно тепловому эффекту реакции. И если мы продифференцируем это уравнение по температуре, то получим:
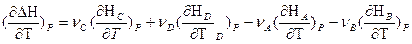
Так как 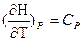
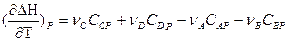
или 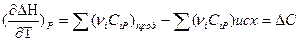
Уравнения для изобарного и изохорного процесса
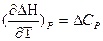 и
и 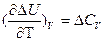
называют уравнениями Кирхгофа ( в дифференциальной форме). Они позволяют качественнооценить зависимость теплового эффекта от температуры (применение).
Влияние температуры на тепловой эффект обусловливается знаком величины ΔСp (или ΔСV )
При ΔСp> 0 величина 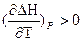 , то есть с увеличением температуры тепловой эффект возрастает,
, то есть с увеличением температуры тепловой эффект возрастает,
|
|
|
при ΔСp< 0 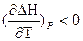 то есть с увеличением температуры тепловой эффект уменьшается.
то есть с увеличением температуры тепловой эффект уменьшается.
при ΔСp = 0 - тепловой эффект реакции не зависит от температуры
То есть, как из этого следует, ΔСp определяет знак перед ΔН.
Для получения расчетной формулы уравнения Кирхгофа интегрируют в пределах интервала температур 298-Т:
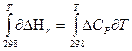
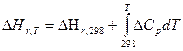
Уравнения эти называются уравнениями Кирхгофа в интегральной форме. По этому уравнению можно рассчитать тепловой эффект только для узкого интервала температур.
При расчете теплового эффекта в большем интервале температур уравнение Кирхгофа интегрируют в пределах 0 –Т К и при этом учитывается зависимость теплоемкости от температуры в виде степенного ряда:
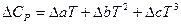
где 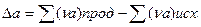
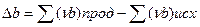
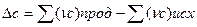
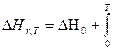
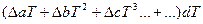
Коэффициенты a,b.c находят экспериментально спектроскопическими или калориметрическими методами. Для многих веществ они приведены в справочных таблицах, ΔН0 -постоянная интегрирования.
Правило фаз Гиббса, его применение для однокомпонентной системы на примере воды.
Правило фаз Гиббса
При изменении внешних параметров равновесие в системе нарушается, при этом изменяются концентрации компонентов или исчезают старые и возникают новые фазы. Изменение в системе происходит до установления нового состояния равновесия.
|
|
|
Этот процесс описывается основным законом состояния равновесия, который носит название правила фаз Гиббса:
В равновесной термодинамической системе, на которую оказывает влияние только давление и температура, число степеней свободы равно числу независимых компонентов минус число фаз плюс два:
С=К-Ф+2
Из этого правила следует, что при числе степеней свободы С=0 система имеет наибольшее число равновесных фаз.
Если на систему, находящуюся в равновесии, кроме давления и температуры оказывают влияние еще и другие внешние факторы, например, магнитное или гравитационное поле, электрические воздействия, то в уравнении число внешних факторов будет больше 2.
Тогда правило фаз запишется так:
С=К-Ф+n
при С=0 Ф=К+n , т.е число фаз не может быть больше, чем К+n: Ф<= К+n
Если равновесие установилось в конденсированной системе, то оно практически не смещается при небольшом изменении давления. В таком случае правило фаз Гиббса для конденсированных систем можно записать:
С=К-Ф+1
Пример. Имеем в равновесии жидкую воду, пар и лед. Рассчитаем число степеней свободы такой системы при условии влияния на систему только двух внешних параметров – давления и температуры:
|
|
|
С= 1-3+2= 0
Это значит, что система нонвариантна, т.е. любое изменение одного из параметров выведет систему из состояния равновесия. Значит, чтобы в системе одновременно сосуществовали все три фазы, необходимо систему держать при определенном значении давления и температуры.
Фазой называется часть системы, ограниченная физическими поверхностями раздела при переходе через которые свойства системы изменяются скачкообразно.
Числом независимых компонентов(k) называется число веществ в системе, достаточное для образования всех фаз данной системы.
Число степеней свободы (С) системы– это число независимых термодинамических параметров, которые можно произвольно менять в некоторых пределах без изменения числа и природы фаз в системе.
Дата добавления: 2018-04-04; просмотров: 732; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
