Принципиальное отличие электродов сравнение от индикаторных, уравнение Нернста для них. (?)
Индикаторным называют электрод, потенциал которого определяет активность анализируемого иона в соответствии с уравнением Нернста.
Электродом сравнения называют электрод, потенциал которого постоянен и не зависит от концентрации ионов в растворе. Солевой мостик служит для предотвращения смешивания анализируемого раствора и раствора электрода сравнения.
В качестве солевого мостика используют насыщенные растворы солей KCl, КNО3 и других с близкими значениями подвижностей катиона и аниона. Это позволяет снизить диффузионный потенциал Едифжидкостного соединения практически до нуля.
Электродвижущую силу Еэлектрохимической цепи, приведенной выше, определяют по уравнению:
Е= Еср - Еин + Едиф,
где Едиф - диффузионный (жидкостный) потенциал, В; Еср- потенциал электрода сравнения, В; Еив - потенциал индикаторного электрода, В.
Подставим в это уравнение значение Еинвыраженное через уравнение Нернста, с учетом соотношения
аан = fан Сан,
где fан и Сан - коэффициент активности и аналитическая концентрация анализируемого иона соответственно.
Получаем уравнение, лежащее в основе всех потенциометрических методов анализа:
Е = Е0 – ( S/n ) lg Сан – ( S/n ) lg faн + Едиф,
где Е0 = Еср– Е0ин - стандартная ЭДС цепи, В; E0ин- стандартный потенциал индикаторного электрода.
Обратимые и необратимые электрохимические элементы. Уравнение Нернста для электродного потенциала и электрохимической цепи.
|
|
|
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Вывод уравнения Нернста
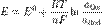 , где
, где
E — электродный потенциал, E0 — стандартный электродный потенциал, измеряется в вольтах;
n — число моль электронов, участвующих в процессе;
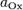 и
и 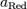 — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным, то при  получим
получим
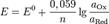
Уравнение Нернста.Значение электродного потенциала, возникающего на границе металл - раствор, зависит от природы металла, активности его ионов в растворе и от температуры. Влияние всех перечисленных факторов на величину электродного потенциала металла выражается уравнением Нернста:
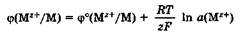
где φ° - стандартный электродный потенциал; R - универсальная газовая постоянная, 8,31 Дж/(моль • К); Т - температура, К; z - заряд потен-циалопределяющих ионов металла; F - число Фарадея, 96 500 Кл/моль; а(Мz+) - активность потенциалопределяющих ионов металла в растворе, моль/л.
|
|
|
Дата добавления: 2018-04-04; просмотров: 1044; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
