Различные способы выражения константы равновесия. Влияние давления на константу равновесия. Правило Брауна
Способы выражения константы равновесия
Константа равновесия может быть выражена различными способами. Если концентрации веществ, участвующих в реакции, выражены в молярных единицах молярности , т.е. в моль/л, то она обычно обозначается Кс и для равновесия обратимой реакции
аА + bB«dD + rR
записывается в виде:
 (2.4)
(2.4)
Для гомогенной газовой реакции константу равновесия удобнее выразить через парциальные давления веществ:
 (2.5)
(2.5)
Иногда константу равновесия удобно выразить не через парциальные давления и концентрации, а через количества веществ:
 (2.6)
(2.6)
или через соответствующие мольные доли:
 (2.7)
(2.7)
В общем случае константы равновесия Кс, Кр, Кn и КN различны по значениям. Установим связь между ними.
В газовых системах, для характеристики которых применимо уравнение состояния идеальных газов Менделеева – Клайперона, значение парциального давления любого компонента можно вычислить следующим образом:
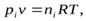
откуда

 (2.8)
(2.8)
где C – концентрация i-го компонента, выраженная в моль/л. Подставим значение р из уравнения (2.8) в уравнение (2.5) и получим соотношение, которым определяется связь Кс и Кр:
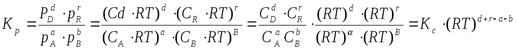
или  , (2.9)
, (2.9)
где  – изменение числа моль в результате реакции.
– изменение числа моль в результате реакции.
Для идеальных газов парциальные давления связаны с общим давлением Робщ и мольной долей Ni данного компонента в смеси согласно законам Дальтона следующим равенством:
pi = NiPобщ (2.10),
где рi – парциальное давление компонента; Ni – мольная доля этого компонента в смеси; Робщ – общее давление.
|
|
|
Подставим значение рi в уравнение (2.5), получим:

или Кр = К∙ (Робщ)^∆n(2.11).
Воспользовавшись соотношением Pi = Ni∙ Робщ = 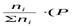 общ)∆n,
общ)∆n,
где ni – число моль компонента inåв смеси, а i – число моль всех компонентов в смеси, получаем:
 или
или  Kn!
Kn!
Таким образом, если Dn≠ 0, т.е. если реакция сопровождается изменением числа моль, то имеет место соотношение:
 (2.12).
(2.12).
Если же ∆n=0 (реакция не сопровождается изменением числа моль), то Кр = Кс = Кn = KN, т.е. значения всех видов констант равновесия совпадают.
Кр и Кс для реакции идеальных газов не зависят от давления. КN и Кn от давления зависят в случае ∆n≠0.
Принцип ЛеШателье Брауна: если систему, находящуюся в равновесии подвергнуть какому–либо внешнему воздействию, то система будет компенсировать это внешнее воздействие.
Принцип Ле-Шателье-Брауна
Под влиянием внешних воздействий или при изменении условий существования системы состояние равновесия изменяется и может наступить новое состояние равновесия, при этом сдвиг его влево или вправо устанавливается принципом Ле-Шателье_-Брауна:
Если на систему, находящуюся в равновесии, оказать воздействие извне, то возникает такое смещение равновесия. которое ослабляет это воздействие.
|
|
|
Поясним на примере.
N2 + 3H2 = 2 NH3
Если давление увеличится, то равновесие сдвинется слева направо, так как эта реакция протекает с уменьшением объема.
А уменьшение объема вызовет снижение давления ( произойдет уменьшение количества молекул в реагирующей смеси), т. е. идет ослабление внешнего воздействия.
Дата добавления: 2018-04-04; просмотров: 2958; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
