Понятие о летучести и термодинамической активности
В 1901 г. Льюис для реальных газов ввел понятие летучести (или фугитивности) f.
Летучесть – это та величина, которую в случае реальных газов необходимо подставлять вместо давления в соответствующие соотношения, описывающие свойства идеальных газов, чтобы они же были применимыми и для описания свойств реальных газов.
 (77)
(77)
В формуле (77) fi ¹p i.
При р®0 реальный газ по свойствам приближается к идеальному газу, поэтому:
 (78)
(78)
При p ® 0, f = р, т.е. газ ведет себя как идеальный.
Мерой отклонения свойств реального газа от идеального служит коэффициент активности g (коэффициент летучести или фугитивности) 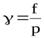 .
.
При p® 0, р ®f и g ®1
Введем понятие активности:  (79)
(79)
ai – активность i-го компонента в смеси идеальных газов,
ai – безразмерная величина, поскольку принимается, что рi0 = 1 атм, тогда
ai = pi (80)
т.е. для идеального газа его активность численно равна его давлению, выраженному в атмосферах.
Для реального газа:  ,
,
fi0 = 1 атм, ai = fi – безразмерная величина.
С учетом сказанного выше выражение для химического потенциала любого газа (в смеси) можно записать в следующее выражение:
μi= μ0i +  ai
ai
Тогда, для идеальных растворов
 ; (81)
; (81)
xi– мольная доля i компонента в растворе.
?? Применительно к реальным растворам вместо фугитивности применяют активность.
 , (82)
, (82)
где  и
и  при
при  , а
, а  (коэффициент активности) характеризует отклонение свойств реального раствора от идеального.
(коэффициент активности) характеризует отклонение свойств реального раствора от идеального.
3…Энергия активации. Зависимость константы скорости химической реакции от температуры.
80 Энергия активации. Зависимость константы скорости химической реакции от температуры. (см. лекции)
Энергия активации
Для того чтобы произошла реакция, необходимо преодолеть отталкивание электронных оболочек молекул и разорвать или ослабить связи между атомами. На это надо затратить определенную энергию.
Избыточная энергия (по сравнению со средней энергией при данной температуре), которой должны обладать молекулы, для протекания реакции, называется энергией активации.
Молекулы, обладающие такой энергией, называются активными молекулами.
В ходе реакции вещества переходят в неустойчивое промежуточное состояние, характеризующееся большим запасом энергии. Именно для его образования необходима энергия активации (рис. 1, 2).
Переходным состоянием системы (или активированным комплексом) называется состояние системы реагирующих веществ, соответствующее максимальной энергии на пути реакции.
Энергия активации – это количество дополнительной энергии, необходимой для перехода системы из исходного состояния в состояние активированного комплекса.

Рис. 1. Энергетическая диаграмма экзотермической реакции

Рис. 2. Энергетическая диаграмма эндотермической реакции
Число частиц, входящих в активированный комплекс, определяет молекулярность данной стадии реакции.
В переходном состоянии старые химические связи ослаблены, но окончательно не разорваны, а новые связи начали образовываться, но еще не сформировались. Неустойчивый активированный комплекс (т.к. обладает избытком энергии) существует очень короткое время. Он распадается с образованием исходных веществ или продуктов реакции.
Переходное состояние возникает в ходе как прямой, так и обратной реакции (рис. 3). Энергетически оно отличается от исходных веществ на величину энергии активации прямой реакции, а от конечных – на энергию активации обратной реакции. Разность энергий активации прямой и обратной реакций равна изменению внутренней энергии (тепловому эффекту) реакции:
DНр = Еа - Еа

Рис.3. Соотношение между энергиями активации прямой
и обратной реакций и теплового эффекта
Задача.
Билет №15
1…Объединенное уравнение первого и второго начал термодинамики. Значение для физико химических расчетов.
В

2…Гальванический элемент. ЭДС гальванического элемента.
Дата добавления: 2018-04-04; просмотров: 1145; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
