Сопоставление теории активного комплекса и активных соударений
Сопоставление теории активного комплекса и активных соударений.
Скорость реакции, согласно теории переходного состояния, зависит от двух факторов:
1) энергетического фактора – Н, энтальпии активации (чем больше энтальпия активации, тем меньше скорость реакции);
2) энтропийного фактора – S, энтропии активации (чем больше энтропия активации, тем больше скорость реакции).
Учёт энтропийного фактора позволил установить связь константы скорости со строением молекул реагирующих веществ. При этом теория ПС оперирует, в частности, величинами расстояний между атомами в молекулах, взаимной ориентацией молекул, ᴛ.ᴇ. параметрами геометрического характера.
Теория активных соударений позволяет при знании энергии активации рассчитать общее число эффективных соударений и отсюда скорость реакции, не объясняя механизма реакции. В отличие от теории активных соударений теория ПК сопоставляет различные возможные комплексы, выявляет большую или меньшую их достижимость и определяет в результате энергетически наиболее выгодный путь реакции.
Для вычисления скоростей взаимодействия двух атомов две теории дают одинаковые результаты. В случае нелинейных многоатомных молекул теория ПК дает значение скоростей, отличных от значений, которые дает теория соударений. В случае если известна конфигурация реагирующих молекул и активного комплекса, теория ПК позволяет рассчитать предэкспоненциальный множитель. К сожалению, в большинстве случаев строение активированного комплекса и его свойства неизвестны и это затрудняет расчёты.
Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, две теории дополняют друг друга. Теория ПК применяется для вычисления абсолютных скоростей электродных процессов, процессов диффузии и т. д. Теория активных соударений хорошо описывает, как правило, реакции в газовой среде.
Задача.
Билет № 18
1… Коллигативные свойства растворов. Применение их для определения молекулярной массы Осмос. Осмотическое давление. Изотонический коэффициент.
Коллигативные свойства растворов — это свойства растворов, обусловленные только самопроизвольным движением молекул, то есть они определяются не химическим составом, а числом кинетических единиц — молекул в единице объёма или массы[1]. К таким коллигативным свойствам относятся:
- Понижение упругости растворителя над раствором,
- Повышение температуры кипения растворов (в сравнении с чистыми растворителями),
- Понижение температуры замерзания растворов (в сравнении с чистыми растворителями),
- Возникновение осмотического давления,
- Диффузия.
Осмотическое давление. Определение молекулярной массы растворенного вещества в системах органических веществ.
Осмос- процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону большей концентрации растворенного вещества из объема с меньшей концентрацией растворенного вещества.
Осмос продолжается не бесконечно, через какое-то время он останавливается. Если мембрана разделяет два раствора с различной, но не намного отличающейся концентрацией, осмос будет идти до практически полного выравнивания концентрации каждого из компонентов по обе стороны мембраны. Если же мембрана разделяет раствор и чистый растворитель или два раствора с сильно отличающимися концентрациями, осмос остановится из-за того, что ему будет препятствовать гидростатическое давление поднимающегося столба жидкости. При остановке осмоса в системе наступает динамическое равновесие, характеризующееся равенством скоростей диффузии растворителя через мембрану в обоих направлениях. Вообще осмос можно приостановить любым давлением, направленным противоположно ему. Очевидно, что давление, необходимое для остановки осмоса, равно по величине тому давлению, которое оказывают при диффузии через мембрану молекулы растворителя. Это избыточное гидростатическое давление, возникающее в результате осмоса, называется осмотическим давлением. Осмотическое давление обозначается буквой p; размерность его в системе СИ - Па, но на практике часто используется и внесистемная единица атм.
Если два раствора обладают одинаковым осмотическим давлением, их называют изотоническими. Когда осмотические давления растворов различны, тот раствор, у которого осмотическое давление больше, называется гипертоническим, тот у которого оно меньше - гипотоническим.
В 1887 г. Я.Вант-Гофф вывел уравнение, связывающее осмотическое давление раствора неэлектролита с его концентрацией:
π = CRT (7.4)
где С - молярная концентрация растворённого ввещества, π - осмотическое давление.
В случае, если растворенное вещество диссоциирует в растворе, это уравнение приобретает вид:
π = iсRT, (44)
где i– изотонический коэффициент.
Изотонический коэффициент показывает во сколько раз реальное число частиц растворенного вещества больше чем теоретически ожидаемое (если предполагать, что вещество в растворе присутствует только в виде молекул).
Для идеальных растворов электролитов i>1.
Коэффициент Вант-Гоффа показывает также во сколько раз наблюдаемое опытное значение росм.,Dtкип.,Dtзам.,  больше теоретически вычисленного, т.е.:
больше теоретически вычисленного, т.е.:
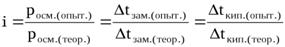
Осмометрия
Так как молярная концентрация С представляет собой число молей вещества n, содержащееся в литре раствора, а n в свою очередь равно массовому количеству вещества m, делённому на его молярную массу:
C =n/V = m/MV
то осмометрические измерения можно использовать для определения молярной массы растворённого вещества. Подставляя это значение С в (7.4) и решая его относительно М, получаем уравнение.
M=mRT/π V
лежащее в основе осмометрического метода определения молярной массы растворённого вещества.
Для низкомолекулярных неорганических и органических соединений осмометрический метод обычно не дает преимуществ по сравнению с другими методами, например, с криометрическим. Однако в случае высокомолекулярных веществ, как правило, образующих растворы с очень малыми молярными концентрациями, осмометрия оказывается достаточно чувствительной и полезной.
2…Скорость химической реакции , константа скорости, ее физический смысл. Молекулярность и порядок химической реакции.
(см. лекции)
3…Приведите уравнение реакции, отвечающее определению стандартной теплоты образованию кристаллогидрата сульфата меди.

Измерив экспериментально в калориметре 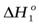 и
и  можно рассчитать теплоту гидратообразования сульфата меди
можно рассчитать теплоту гидратообразования сульфата меди 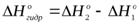
Билет№19
Дата добавления: 2018-04-04; просмотров: 997; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
