Понятие фазового равновесия . условия фазового равновесия. Основные понятия: фаза , компонент, вариантность системы. Правило фаз Гиббса. Применение
Правило фаз Гиббса
При изменении внешних параметров равновесие в системе нарушается, при этом изменяются концентрации компонентов или исчезают старые и возникают новые фазы. Изменение в системе происходит до установления нового состояния равновесия.
Этот процесс описывается основным законом состояния равновесия, который носит название правила фаз Гиббса:
В равновесной термодинамической системе, на которую оказывает влияние только давление и температура, число степеней свободы равно числу независимых компонентов минус число фаз плюс два:
С=К-Ф+2
Из этого правила следует, что при числе степеней свободы С=0 система имеет наибольшее число равновесных фаз.
Если на систему, находящуюся в равновесии, кроме давления и температуры оказывают влияние еще и другие внешние факторы, например, магнитное или гравитационное поле, электрические воздействия, то в уравнении число внешних факторов будет больше 2.
Тогда правило фаз запишется так:
С=К-Ф+n
при С=0 Ф=К+n ,т.е число фаз не может быть больше, чем К+n: Ф<= К+n
Если равновесие установилось в конденсированной системе, то оно практически не смещается при небольшом изменении давления. В таком случае правило фаз Гиббса для конденсированных систем можно записать:
С=К-Ф+1
Пример. Имеем в равновесии жидкую воду, пар и лед. Рассчитаем число степеней свободы такой системы при условии влияния на систему только двух внешних параметров – давления и температуры:
С= 1-3+2= 0
Это значит, что система нонвариантна, т.е. любое изменение одного из параметров выведет систему из состояния равновесия. Значит, чтобы в системе одновременно сосуществовали все три фазы, необходимо систему держать при определенном значении давления и температуры.
Фазой называется часть системы, ограниченная физическими поверхностями раздела при переходе через которые свойства системы изменяются скачкообразно.
Числом независимых компонентов(k) называется число веществ в системе, достаточное для образования всех фаз данной системы.
Число степеней свободы (С) системы– это число независимых термодинамических параметров, которые можно произвольно менять в некоторых пределах без изменения числа и природы фаз в системе.
Условие фазового равновесия, т.е. значение параметров, характеризующих смесь p, T, C при которых не происходит перенос массы из жидкой фазы в газ и наоборот при адиабатных условиях
2…Закон распределения третьего компонента . Коэффициент распределения. Экстракция
Закон распределения Нернста. Экстракция и ее использование в технологии углеродных материалов.
Если взять две несмешивающиеся жидкости и добавить третий компонент, то он будет растворяться в разной степени в том и другом растворителе.
«При установлении равновесия отношение концентраций полученных растворов постоянно при данной температуре» - закон распределения Нернста (1.13).
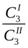 = К, (1.13)
= К, (1.13)
где 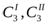 - концентрации третьего компонента вI и II фазах; К - коэффициент распределения.
- концентрации третьего компонента вI и II фазах; К - коэффициент распределения.
Если растворенное вещество диссоциирует или ассоциирует в одном из растворителей, то уравнение Нернста имеет вид:
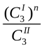 = К, (1.14)
= К, (1.14)
Для нахождения Клогарифмируем уравнение (1.14) и получаем уравнение прямой:
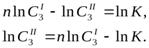
Построив прямую в координатах 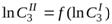 , найдем «n» как тангенс угла наклона прямой (по любым двум точкам, лежащим на прямой) tga =
, найдем «n» как тангенс угла наклона прямой (по любым двум точкам, лежащим на прямой) tga = 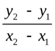 .
.
InK можно найти из уравнения, подставив в него значения любой точки, находящейся на прямой.
Закон распределения Нернста лежит в основе процесса экстракции. Экстракция это извлечение компонента из одной фазы в другую. Экстракция бывает твердофазная - извлечение веществ из твердой фазы в жидкую (например, заваривание чая, кофе, приготовление настоек, экстрактов трав и так далее) и жидкофазная - извлечение растворенного вещества из жидкого раствора экстрагентом. Раствор извлеченного вещества в экстрагенте называется экстрактом, а исходный раствор после извлечения из него вещества называется рафинатом.
Для расчета эффективности жидкофазной экстракции используют уравнение
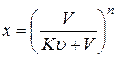 (3.31)
(3.31)
Где х- доля неизвлеченного вещества в рафинате;
V - объем исходного раствора;
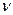 - объем экстрагента;
- объем экстрагента;
К - коэффициент распределения
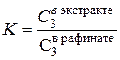
n - число экстракций.
Как видно из уравнения, чем больше экстракций, тем меньше остается вещества в рафинате, то есть неизвлеченным, тем больше вещества извлекается экстрагентом. Эффективность экстракции в большой степени определяется величиной коэффициента распределения: чем больше коэффициент в пользу экстрагента, тем эффективнее экстракция.
В нефтепереработке широко применяют процессы экстракции в системе ж-ж при очистке масел, дизельного топлива, извлечении ароматических углеводородов.
В промышленных условиях для экстракции используются такие растворители как фенол, фурфурол, N-метилпироллидон, бензол, диэтиленгликоль, пропан и др.
Углекислотная экстракция.Перспективными для экстрагирования являются предлагаемые в последнее время сжиженные газы: углерода диоксид, пропан, бутан, жидкий аммиак, хладоны и др. Сжиженный углерода диоксид хорошо извлекает эфирные, жирные масла и другие гидрофобные вещества. Гидрофильные вещества хорошо экстрагируются сжиженными газами с высокой диэлектрической проницаемостью (аммиак, метил хлористый, метиленоксид и др.)
Экстрагирование сжиженными газами проводится под давлением, при снятии которого экстрагент улетучивается, а экстрактивные вещества остаются в чистом виде.
Технология углекислотной экстракции – это технология обработки сырья в условиях углекислого газа (CO2), позволяющая извлекать в высокой концентрации различные действующие вещества в чистом виде. Технология углекислотной экстракции – самый эффективный и экологически чистый (без химических соединений и примесей) способ выделения различных БАВ с высокой степенью избирательности, содержащихся в лекарственном растительном сырье.
3…Теория активного комплекса
Теория активного комплекса.
Основным представлением ТАК является положение о том, что всякая химическая реакция протекает через образование некоторого переходного состояния, которое затем распадается на продукты данной реакции.
Основные положения теории:
1. В ходе процесса молекулы постепенно приближаются друг к другу, в результате чего меняются межъядерные расстояния.
2. В ходе реакции образуется активированный комплекс, когда один из атомов становится как бы обобществленным, и межъядерное расстояние становится одинаковым.
3. Активированный комплекс превращается в продукты реакции.
Например, реакцию разложения йодоводорода можно представить следующим образом:
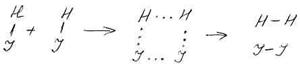
Сначала две молекулы HJ расположены достаточно далеко друг от друга. При этом существует взаимодействие лишь между атомами в молекуле. После сближения на достаточно короткое расстояние начинают возникать связи между атомами, входящими в состав разных молекул, и связи H–J становятся более слабыми. В дальнейшем они ещё более ослабевают и полностью разрываются, а новые связи H–H и J–J, наоборот, упрочняются. В результате происходит перегруппировка атомов и вместо исходных молекул НJ образуются молекулы Н2 и J2. В процессе сближения и перегруппировки атомов молекулы образуют некоторый малоустойчивый активированный комплекс из двух молекул водорода и двух молекул йода; комплекс существует очень недолго и в дальнейшем распадается на молекулы продуктов. На его образование необходима затрата энергии, равная энергии активации.
Представление об активированном комплексе и об энергии активации подтверждается с помощью энергетических диаграмм, построение которых используется в ТАК.
Активированный комплекс всегда имеет избыток энергии по сравнению с энергией реагирующих частиц.
А–В+D 
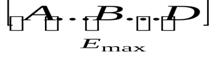 →A+B–D
→A+B–D
переходное состояние
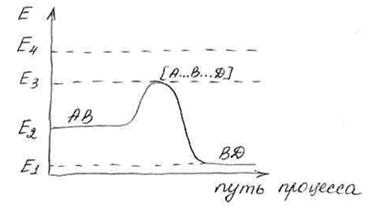
Е1– энергия связи BD без А.
Е2– энергия связи АB без D.
Е3– энергия связи переходного состояния.
Е4– энергия свободных атомов.
Е3– Е2 = Е активации прямой реакции.
Е2– Е1 = ∆Н тепловой эффект реакции.
Е4– Е2 – энергия разрыва связи АВ.
Е4– Е1 – энергия разрыва связи ВD.
Так как энергия разрыва связей Е4 >> Е активации, то реакция протекает с образованием активированного комплекса без предварительного разрыва связей.
Дата добавления: 2018-04-04; просмотров: 1299; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
