Механизм возникновения электродных потенциалов. Двойной электрический слой
На границе раздела фаз протекает электродный процесс–реакция между компонентами фаз, в результате которой происходит переход электрических зарядов из одной фазы в другую. Каждая фаза при этом приобретает электрический заряд, и на границе их раздела образуется двойной электрический слой(ДЭС), которому соответствует скачок потенциала.
Механизм возникновения электродных потенциалов. Двойной электрический слой.
На границе раздела фаз протекает электродный процесс–реакция между компонентами фаз, в результате которой происходит переход электрических зарядов из одной фазы в другую. Каждая фаза при этом приобретает электрический заряд, и на границе их раздела образуется двойной электрический слой(ДЭС), которому соответствует скачок потенциала.










Обратимые и необратимые электрохимические элементы. Уравнение Нернста для электродного потенциала и электрохимической цепи.
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Вывод уравнения Нернста
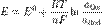 , где
, где
E — электродный потенциал, E0 — стандартный электродный потенциал, измеряется в вольтах;
n — число моль электронов, участвующих в процессе;
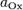 и
и 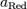 — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
|
|
|
Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным, то при  получим
получим
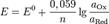
Уравнение Нернста.Значение электродного потенциала, возникающего на границе металл - раствор, зависит от природы металла, активности его ионов в растворе и от температуры. Влияние всех перечисленных факторов на величину электродного потенциала металла выражается уравнением Нернста:
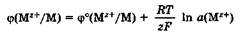
где φ° - стандартный электродный потенциал; R - универсальная газовая постоянная, 8,31 Дж/(моль • К); Т - температура, К; z - заряд потен-циалопределяющих ионов металла; F - число Фарадея, 96 500 Кл/моль; а(Мz+) - активность потенциалопределяющих ионов металла в растворе, моль/л.
3.Мультиплетная теория гетерогенного катализа Баландина
Мультиплетная теория гетерогенного катализа Баландина.
Предполагает, что в образовании поверхностного соединения (мультиплетного комплекса) участвуют группы активных атомов поверхности мультиплеты (дуплеты, триплеты, квадруплеты, секстеты и т.д.), обладающие определенными геометрическими и энергетическими свойствами. Рассматривается принцип геометрического и энергетического подобия.
В ней впервые рассматривается строение активного центра гетерогенного катализа.
|
|
|
Основные положения:
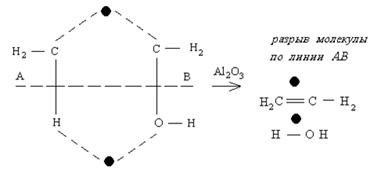
1. Активные центры kt-а представляют собой совокупность определенного числа адсорбционных центров, расположенных на поверхности в геометрическом соответствии со строением молекул реагирующего вещества (принцип геометрического или структурного соответствия)
2. При адсорбции на активном центре образуются мультиплетные комплексы, в результате чего происходит перераспределение связей и удаляются продукты реакции.
Необходимо соответствие между длиной химической связи в реагирующей молекуле и расстояние между атомами в мультиплете.
Реакция: 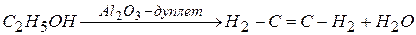
 Этилен
Этилен
На медном kt другие расстояния между центрами и другие свойства, молекула этанола сорбируется иначе.
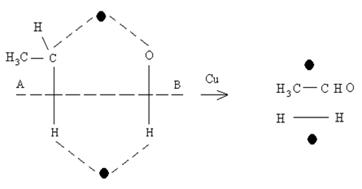
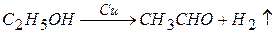
Мультиплетная теория справедлива в основном для реакций с участием сложных молекул, неприменима к O-B реакциям с участием простых молекул
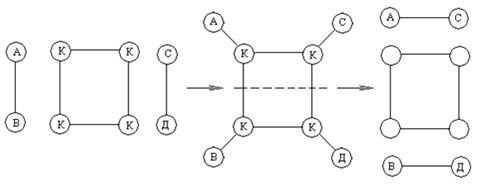
Схема реакции  с участием квадруплета:
с участием квадруплета:
Задача.
Билет №23
1…Уравнение Гиббса-Гельмгольца.
Дата добавления: 2018-04-04; просмотров: 1061; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
