Зависимость энергии Гиббса от давления и температуры, уравнение Гельмгольца-Гиббса
Зависимость энергии Гиббса от температуры и давленияΔH – TΔS = U + pV– TΔS = G(7.21)
Уравнение Гиббса - Гельмгольца.
Сочетанием уравнений  и
и  = -S и
= -S и
Гиббса  и
и 
можно получить уравнения Гиббса-Гельмгольца:
 и
и 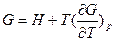
характеризующие запас свободной энергии для данного состояния системы в изотермических условиях.
На основе этих уравнений получают уравнения Гиббса-Гельмгольца для изменения термодинамических потенциалов:
 и
и 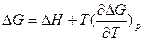 эти уравнения не используют в явном виде энтропию. Или:
эти уравнения не используют в явном виде энтропию. Или:
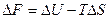 и
и 
Эти уравнения наиболее применимы для расчета изменений функций Гельмгольца и Гиббса при протекании химических реакций. Они связывают максимально полезную работу, при переходе системы из состояния 1 в состояние 2 с тепловым эффектом перехода системы из состояния 1 в состояние 2.
Легко показать, что

т.е. энергия Гиббса отличается от изменения энергии Гельмгольца на величину 
т.е. на изменение числа молей газообразных продуктов в ходе реакции.
2…Хингидронный электрод
71.Хингидронный электрод 


3…Теория гетерогенного катализа активного комплекса Кобозева.
Теория гетерогенного катализа активного комплекса Кобозева.
Теория активных ансамблей (Кобозев)
Предполагает, что активными центрами служат атомы, беспорядочно расположенные на поверхности твердого тела (аморфная, докристаллическая фаза). Применима, когда на поверхности носителя малое количество kt-металла (Рt на силикагеле). Поверхность твердого тела имеет блочное строение с геометрическими и энергетическими барьерами.
|
|
|
Атомы kt под действием теплового движения могут мигрировать из одного блока в другой. Несколько атомов Me внутри области миграции называются ансамблем, содержащим разное число атомов.
Каталитическим действием обладают ансамбли с определенным числом атомов металла na – активные ансамбли. Большинство блоков содержат среднее число атомов.
 - общее число областей миграции
- общее число областей миграции
 - среднее число атомов, приходящиеся на одну область
- среднее число атомов, приходящиеся на одну область
 - число n-атомных ансамблей
- число n-атомных ансамблей
 - общее число адсорбированных атомов
- общее число адсорбированных атомов

 - вероятность образования n-атомных ансамблей
- вероятность образования n-атомных ансамблей
 , когда
, когда 
Число n-атомных ансамблей рассчитывается по формуле
 (1.101)
(1.101)
Пример: 1) 
 2)
2) 
(kt-Рt на силикагеле)
Для этих реакций na=1, это объясняется тем, что лимитирующей стадией является образование промежуточного соединения перекисного характера из атома металла с молекулой O2.
Билет 24
1…Химический потенциал
Химический потенциал.
Выражения I закона термодинамики справедливы при условии неизменности количеств составляющих систему веществ. Количество взаимодействующих веществ и продуктов реакции определяется числом моль  . В результате физико-химических процессов, связанных с изменением количеств участвующих в процессе веществ (химических реакции, фазовых переходов), изменяются всœе характеристические функции.
. В результате физико-химических процессов, связанных с изменением количеств участвующих в процессе веществ (химических реакции, фазовых переходов), изменяются всœе характеристические функции.
|
|
|
Для  компонентной системы, с учетом изменения числа моль компонентов, участвующих в физико-химическом процессе, уравнение (83) для изменения энергии Гиббса примет вид:
компонентной системы, с учетом изменения числа моль компонентов, участвующих в физико-химическом процессе, уравнение (83) для изменения энергии Гиббса примет вид:
 . (86)
. (86)
В (86) знак ʼʼнеравенстваʼʼ относится к самопроизвольному процессу, а знак ʼʼравенстваʼʼ – к равновесному. Частная производная от энергии Гиббса (или любой другой из характеристических функций (  ,
,  ,
,  )) по изменению числа моль одного из компонентов при неизменности чисел моль остальных компонентов и соответствующих параметров состояния - ϶ᴛᴏ химический потенциал
)) по изменению числа моль одного из компонентов при неизменности чисел моль остальных компонентов и соответствующих параметров состояния - ϶ᴛᴏ химический потенциал  го компонента
го компонента  .
.
 . (87)
. (87)
С учетом (87) получим:
 . (88)
. (88)
Химический потенциал можно выразить через частные производные и других термодинамических потенциалов
 (89)
(89)
и аналогично уравнению (86) выразить энергию Гельмгольца  ,
,  ,
, 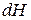 .
.
Химический потенциал размерная величина –  .
.
Химический потенциал имеет физический смысл парциальной мольной работы при изменении числа моль данного компонента на единицу при постоянных внешних параметрах и числах моль всœех других компонентов, составляющих раствор.
|
|
|
Для изобарно-изотермических условий, когда  и
и 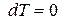 , из (88) при равновесии имеем:
, из (88) при равновесии имеем:
 . (90)
. (90)
Для однокомпонентной системы из (87), получим:
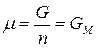 , (91)
, (91)
где  – мольная энергия Гиббса компонента (индивидуального вещества) или мольный термодинамический потенциал.
– мольная энергия Гиббса компонента (индивидуального вещества) или мольный термодинамический потенциал.
Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, химический потенциал индивидуального компонента тождественен мольной энергии Гиббса.
2…Криоскопия и эбулиоскопия
Криоскопия.
Криоскопия– метод определения молекулярных масс по понижению температуры замерзания раствора. При охлаждении растворов наблюдается их замерзание. Температура замерзания – температура, при которой образуются первые кристаллы твердой фазы. Если эти кристаллы состоят только из молекул растворителя, то температура замерзания раствора (Т) всегда ниже температуры замерзания чистого растворителя (Тпл). Разность температур замерзания растворителя и раствора называют понижением температуры замерзания раствора.
Количественная зависимость понижения температуры замерзания от концентрации раствора выражается следующим уравнением:
 , (33)
, (33)
|
|
|
где М1 — молярная масса растворителя, DплН1 — энтальпия плавления растворителя, m2 — моляльность раствора; K – криоскопическая постоянная, зависящая от свойств только растворителя, равная понижению температуры замерзания раствора с моляльностью растворенного в нем вещества, равной единице.

|
На рис. 3 представлена температурная зависимость давления насыщенного пара над чистым жидким и твердым растворителем (кривые ОА и ОD) и его парциального давления в паре над растворами разных составов (кривые ВО¢ и СО¢¢) для случая, когда растворенное вещество нелетуче. Кривые ОА¢, O¢B¢,O¢¢C показывают ход с температурой давления паров над переохлажденным и чистым растворителем (ОА¢) и растворами соответствующих составов (О¢B¢, O¢¢C).
Рис. 3. Зависимость давления насыщенного пара растворителя от температуры.
Кристаллы растворителя будут находиться в равновесии с раствором, если давления пара растворителя над твердой и жидкой фазами будут равны, т.е. когда кривая ОD пересечет кривые ВВ¢, CC¢ при соответствующих температурах Tкр¢ и Tкр¢¢. Температуры, отвечающие этому условию, будут ниже температуры замерзания чистого растворителя (Tкр – тройная точка растворителя).
Понижение точки замерзания и повышение точки кипения растворов, их осмотическое давление не зависят от природы растворенных веществ. Такие свойства называют коллигативными. Эти свойства зависят от природы растворителя и концентрации растворенного вещества. Как правило, коллигативные свойства проявляются, когда в равновесии находятся две фазы, одна из которых содержит растворитель и растворенное вещество, а вторая – только растворитель.
Эбулиоскопия.
Эбулиоскопия— метод определения молекулярных масс по повышению точки кипения раствора. Температурой кипения раствора называют температуру, при которой давление пара над ним становится равным внешнему давлению.
Если растворенное вещество нелетуче, то пар над раствором состоит из молекул растворителя. Такой раствор начинает кипеть при более высокой температуре (Т) по сравнению с температурой кипения чистого растворителя (Т0). Разность между температурами кипения раствора и чистого растворителя при данном постоянном давлении называется повышением температуры кипения раствора. Эта величина зависит от природы растворителя и концентрации растворенного вещества.
Жидкость кипит, когда давление насыщенного пара над ней равно внешнему давлению. При кипении жидкий раствор и пар находятся в равновесии. Можно показать, что в случае, если растворенное вещество нелетуче, повышение температуры кипения раствора подчиняется уравнению
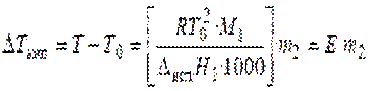 , (32)
, (32)
где М1 — молярная масса растворителя, DиспН1 — энтальпия испарения растворителя, m2 — моляльность раствора (количество моль растворенного вещества в расчете на 1 кг растворителя); Е – эбулиоскопическая постоянная, равная повышению температуры кипения одномоляльного раствора по сравнению с температурой кипения чистого растворителя. Величина Е определяется свойствами только растворителя, но не растворенного вещества.
3…Гетерогенные химические реакции. Влияние температуры на протекание гетерогенной химической реакции.
89. Гетерогенные химические реакции. Влияние температуры на протекание гетерогенной химической реакции. 
Увеличение скорости химической реакции с ростом температуры, на первый взгляд, можно объяснить возрастанием скорости теплового движения молекул исходных веществ. Это должно приводить к увеличению числа соударений между ними, несмотря на то, что общее количество молекул осталось неизменным.
Однако, как показали расчёты, число соударений между частицами, находящимися в газовых и жидких средах за единицу времени, всегда достаточно велико. Так, в 1 см3 газа (при н.у.) за одну секунду происходит ~ 1 · 1028 столкновений между молекулами. Если бы каждое из них приводило к образованию конечных продуктов, то подавляющее большинство химических реакций протекали бы практически мгновенно, т.е. со взрывом.
На практике этого не наблюдается, т.к. не все соударения между молекулами исходных веществ являются «успешными». Установлено, что для многих реакций число таких «успешных» соударений ~ в 1015–1020 раз меньше, чем общее число соударений.
Протекание реакции становится возможным только в том случае, если столкнувшиеся молекулы обладают достаточным запасом внутренней энергии. Если её значение равно какой-то определённой величине или больше её, то реакция осуществится (в противном случае – нет). Такие молекулы называются активными, а соударения между ними – эффективными.
Обычно доля активных молекул реагентов, по сравнению с их общим числом, для большинства реакций невелика.
При повышении температуры увеличивается запас внутренней энергии молекул. Всё большее их число становятся активными. Как следствие этого, возрастает доля эффективных соударений между молекулами за единицу времени, а значит и скорость химической реакции.
При повышении температуры концентрации исходных веществ в реакционной смеси практически не изменяются. Значит, увеличение скорости реакции в соответствии с главным кинетическим уравнением должно быть связано с возрастанием её константы скорости.
Голландский учёный Вант-Гофф опытным путём определил, что для химических реакций (имеющих нормальный тип зависимости скорости от температуры) при повышении температуры на каждые 10 градусов величина константы скорости возрастает в 2-4 раза. Причём для каждой химической реакции это число является постоянным и может принимать из указанного интервала как целочисленные (2, 3, 4) значения, так и дробные. Оно определяется экспериментально, называется температурным коэффициентом скорости химической реакции или коэффициентом Вант-Гоффа и обозначается греческой буквой γ:

Более точную зависимость константы скорости от температуры дает уравнение Аррениуса:
 или lnk=B-А/Т по графику lg от 1/Т находят В и А:
или lnk=B-А/Т по графику lg от 1/Т находят В и А:
lnk=lnz - Ea/RT
|
Энергия активации – избыток энергии по сравнению со средней энергией реагирующих веществ, который необходим для того, чтобы соударения были результативными
БИЛЕТ 25
1.Теплоёмкость. Средняя и истинная теплоемкость. Зависимость теплоты реакции от температуры.
Дата добавления: 2018-04-04; просмотров: 3107; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
