Изменение энтропии в различных процессах, при нагревании, фазовых переходах, расширении и смешении идеальных газов
Изменение энтропии в различных процессах, при нагревании, фазовых переходах, расширении и смешении идеальных газов.
Для реальных (необратимых) процессов II закон термодинамики записывается в идее неравенства, что затрудняет расчет Dизменения энтропии S при их протекании. Но энтропия – функция состояния системы, и ее изменение не зависит от пути проведения процесса. DПоэтому для расчета S при протекании различных процессов воспользуемся уравнением II закона для обратимых процессов:
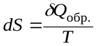 . (1)
. (1)
Изменение энтропии при фазовых превращениях
Фазовое превращение (фазовый переход) – процесс, связанный с изменением агрегатного состояния вещества.
Характерной особенностью этих процессов является то, что они протекают при постоянной температуре – температуре фазового перехода Тф.п.. (Т=const, изотермический процесс)
Тогда, согласно II закону термодинамики
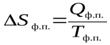 ,
,
где Qф.п. – тепловой эффект фазового перехода.
При р = const (изобарный процесс) теплота равна изменению энтальпии:
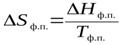
Изменение энтропии при нагревании (охлаждении).
Применим уравнение (1) к изобарному процессу (р = const).
Для 1 моль вещества
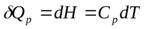 ;
;
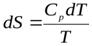 ,
,
где Ср – молярная изобарная теплоемкость K).×вещества, Дж/(моль (см. ниже)
Вычислим изменение энтропии для различных процессов:
1. В общем случае обратимого процесса при постоянном объеме, когда изменение внутренней энергии равно 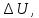 :
: 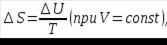
2. При нагревании любого вещества от 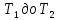 при постоянном объеме (V=const, изохорный процесс). В случае, как следует из математической формулироквки первого начала термодинамики, теплота процесса приобретает свойства функции состояния и не зависит от пути процесса. Подставляя значение
при постоянном объеме (V=const, изохорный процесс). В случае, как следует из математической формулироквки первого начала термодинамики, теплота процесса приобретает свойства функции состояния и не зависит от пути процесса. Подставляя значение 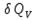 из уравнения
из уравнения 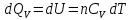 и
и 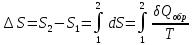 , получаем:
, получаем:
|
|
|
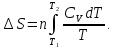 Если принять
Если принять 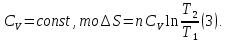
3. При нагревании любого вещества при постоянном давлении (p=const)
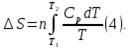 При
При 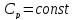
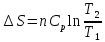 (4)
(4)
4.Для различных процессов с идеальным газом:
Если 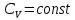 , вместо уравнения (5) можно написать
, вместо уравнения (5) можно написать
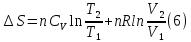
Учитывая, что для идеального газа 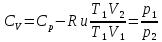 , уравнение (6) можно представить в виде:
, уравнение (6) можно представить в виде: 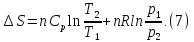
В изотермическом процессе, учитывая, что 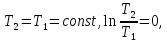 получаем из (6) и (7)
получаем из (6) и (7)
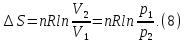
В изохорном процессе, учитывая, что  получаем из равенства (6)
получаем из равенства (6)
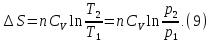
В изобарном процессе, учитывая, что 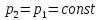 и
и 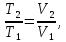 находим из (7)
находим из (7)
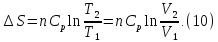
Смешение двух идеальных газов
При смешивании энтропия увеличивается. Причина: расширение каждого из газа при p=const и T=const.
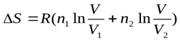 , где n1 и n2 – числа моль первого и второго газа: V1 и V2 – их начальные объемы:
, где n1 и n2 – числа моль первого и второго газа: V1 и V2 – их начальные объемы:
V= V1 + V2 - конечный объем.)
Химические и концентрационные элементы и их применение в технике.
Химические и концентрационные элементы и их применение в технике.
Гальванические элементы. Различают концентрационные и химические гальванические элементы.
|
|
|
Гальванические элементы – химические источники электрической энергии. Они представляют собой системы, состоящие из двух электродов (проводников I рода), погруженных в растворы электролитов (проводников II рода).
Электрическая энергия в гальванических элементах получается за счет окислительно-восстановительного процесса при условии раздельного проведения реакции окисления на одном электроде и реакции восстановления на другом. Например, при погружении цинка в раствор сульфата меди цинк окисляется, а медь восстанавливается( Элемент Даниэля-Якоби)
Zn + CuSO4 = Cu + ZnSO4
Zn0+Cu2+=Cu0 +Zn2+
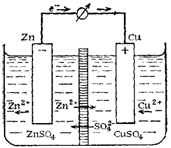
Схематически это можно записать следующим образом: 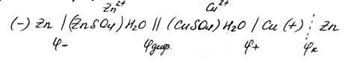
Концентрационные гальванические элементы состоят из двух одинаковых электродов (например, серебряных), опущенных в растворы одного и того же электролита (например, AgNO3), но разных концентраций. Источником электрического тока в таком элементе служит работа переноса электролита из более концентрированного раствора в более разбавленный. Элемент работает до тех пор, пока сравняются концентрации катионов у анода и катода. Концентрационный гальванический элемент изображают схематически следующим образом:
⊝Ag½AgNO3(C1) ║AgNO3(C2) ½⊕Ag , где С2> C1
|
|
|
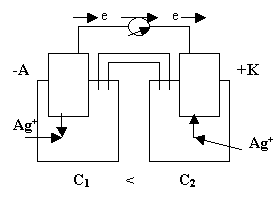
Рис.4
Эти электроды отличаются друг от друга только концентрациями солевых растворов.
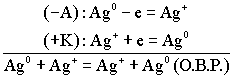
(По формуле Нерста) рассчитаем ЭДС концентрационного элемента.
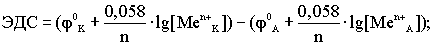
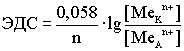
Недостатки концентрационных гальванических элементов:
- разрушаемый анод,
- малая ЭДС.
Концентрационные элементы используются в тех случаях, где необходима малая ЭДС.
Концентрационные элементы используют для определения активности ионов в растворе, химические цепи - как источники постоянного тока - аккумуляторы, окислительно-восстановительные элементы используются для определения констант равновесия и термодинамических функций.
Дата добавления: 2018-04-04; просмотров: 482; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
