Контрольні питання і завдання. 1. Що лежить в основі методів окисно-відновного титрування?
1. Що лежить в основі методів окисно-відновного титрування?
2. Класифікація окисно-відновних методів?
3. В чому суть перманганатометричного титрування, концентрацію яких речовин можна визначити цим методом?
4. Опишіть окисну дію 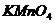 в кислому і лужному середовищі. Визначте еквівалентну масу калій перманганату.
в кислому і лужному середовищі. Визначте еквівалентну масу калій перманганату.
5. Чому реакція між перманганатом і оксалатною кислотою протікає повільно? Як прискорити реакцію? Яка роль йонів Mn2+ в цій реакції?
6. Яка маса калій перманганату потрібна для приготування 2-х літрів розчину молярної концентрації еквіваленту 0,02 моль/л?
7. Для визначення концентрації розчину калій перманганату необхідно приготувати 100 мл розчину натрій оксалату Na2C2O4 молярної концентрації еквіваленту С(1/2 Na2C2O4)=0,1 моль/л. Яку масу цієї солі потрібно зважити.
8. Яка маса KMnO4 потрібна для приготування 3 л розчину з титром Т=0,001616 г/мл
9. Скласти схеми електронного балансу, урівняти коефіцієнти та розрахувати молярні маси еквівалентів окисників та відновників у наступних реакціях:
а) KMnO4 + KNO2 + H2SO4 → MnSO4 + K2SO4 + KNO3 +H2O
б)FeSO4+K2Cr2O7+H2SO4→Fe2(SO4)3+Cr2(SO4)3 +K2SO4+H2O
в) K2Cr2O7 + KI + H2SO4 → Cr2(SO4)3 + I2 + K2SO4 + H2O
г) KMnO4 + K2SO3 + KOH → K2MnO4 + K2SO4 + H2O
д) H3AsO3 + KMnO4+H2SO4 → H3AsO4 +MnSO4 +K2SO4+H2O
ж) Au + HNO3 + HCl → AuCl3 + NO + H2O
з) FeS + HNO3 → Fe(NO3)2 + S + NO + H2O
Дати відповіді на тестові завдання
1. Молярна маса еквівалента КМnО4 в перманганатометрії дорівнює:
а) М(КМnО4)/5; б) М(КМnО4)/3; г) М(КМnО4).
2. Розчин КМnО4 в перманганатометрії виступає в якості:
|
|
|
а) окисника; б) відновника.
3. Індикатором в перманганатометрії служит:
а) робочий розчин КМnО4; б) крохмаль; в) фенолфталеїн.
4. Титрування в перманганатометрії розчином КМnО4 проводять:
а) в кислому середовищі; б) в нейтральному; в) в лужному.
5. Стандартизацію розчину КМnО4 проводять за допомогою:
а) бури;
б) щавлевої кислоти;
в) хлоридної кислоти.
Лабораторна робота № 11
Тема: Метод йодометрії (2 год)
Мета: Ознайомитись з методом йодометричного титрування; визначити вміст йоду у водному розчині калій йодиду
Техника безпеки: Бути уважними в хімічній лабораторії, проявляти обережність під час роботи з хімічними реактивами і хімічним посудом.
Актуалізація опорних знань
1. Що таке пряме і обернене титрування?
2. Для чого використовуються індикатори в титриметричному титруванні?
3. Який робочий розчин і який індикатор застосовують при титруванні методом перманганатометрії?
Теоретичні передумови до виконання роботи
Йодометричний метод аналізу базується на рівняннях окиснення йод-аніонів до вільного йоду (а) або відновлення вільного йоду до йод-аніонів (б).
|
|
|
2Іˉ -2е = І2 (а)
І2 + 2е = 2Іˉ (б)
Йод малорозчинний у воді, тому в розчин додають йодид калію; з йодид-аніонами йод утворює комплексні йони І3ˉ, розчинні у воді.
І2 + Іˉ = І3ˉ
Розчин йоду у водному розчині крохмалю має світло-синє забарвлення, чутливість цієї реакції велика — 10ˉ5 моль/л. У зв’язку з тим, що крохмаль адсорбує йод і повільно віддає його під час реакції, потрібно крохмаль додавати в кінці титрування, коли майже увесь йод відтитрований, розчин має бути солом’яного кольору.
Якщо в результаті окисно-відновної реакції утворюється йод, то в еквівалентній точці розчин синіє і навпаки, якщо в розчині накопичуються йод-аніони, синє забарвлення розчину зникає і стає безбарвним.
Методом йодометрії можна визначати як окисники, так і відновники.
Визначення відновників – широко розповсюджене на практиці, однак обмежене низьким стандартним окисно-відновним потенціалом системи І2/2Іˉ : Ео = +0,54 (йод слабкий окисник).
До числа відновників, з якими можлива окисно-відновна реакція, відносяться кислоти: сульфатна (IV), сульфідна, арсенатна (ІІІ) та їх солі. Нижче приводиться приклад реакції, де йод виступає як окисник.
I2 + H2S²ˉ + 2KOH → 2KI¹ˉ + S° +H2O
|
|
|
 1 I2 + 2e = 2Iˉ fекв. = ½ Me(I2) = ½ M(I2)
1 I2 + 2e = 2Iˉ fекв. = ½ Me(I2) = ½ M(I2)
1 S²ˉ - 2e = S° fекв. = ½ Me(H2S) = ½M(H2S)
При визначенні відновника до розчину відновника добавляють надлишок робочого розчину йоду, після чого залишок йоду, що не прореагував, титрують робочим розчином натрій тіосульфату. Такий спосіб називають способом зворотного титрування. Пряме титрування відновників йодом не застосовується через незначну швидкість окисно-відновної реакції: йод + відновник. При наявності в розчині залишку йоду реакція проходить до кінця і закінчується миттєво.
Визначення окисників ґрунтується на взаємодії калій йодиду з різними окисниками – калій дихроматом, Cu(ІІ), калій перманганатом та ін. у кислому середовищі. Нижче приводиться приклад однієї з таких реакцій:
2KMnO4 + 10KI + 8H2SO4 → 5I2° + 2MnSO4 + 6K2SO4 + 8H2O
 2 Mn+7 +5e = Mn²+ fекв.= 1/5 Me(KMnO4) = 1/5 M(KMnO4)
2 Mn+7 +5e = Mn²+ fекв.= 1/5 Me(KMnO4) = 1/5 M(KMnO4)
5 2I¹ˉ -2e = I2° fекв. = ½ Me(I2) = ½ M(I2)
При визначенні окисників в розчині, який містить окисник, вводять залишок калій йодиду, а виділений у еквівалентній кількості йод відтитровують розчином натрій тіосульфату; тут також застосовують спосіб зворотного титрування. Відтитрувавши йод, що виділився, відповідним відновником, за витратою останнього підраховують кількість Mn(VII) в досліджуваному розчині.
|
|
|
Робочі розчини. Для титрування йоду, невикористаного при визначені відновників (І2 → 2Іˉ) або виділеного в результаті реакції (2Іˉ → І2 ) при визначені окисників, в якості робочого розчину використовують розчин кристалогідрату натрій тіосульфату Na2S2O3*5H2O.
Окисно-відновна реакція між йодом і натрій тіосульфатом відбувається за рівнянням: 2Na2S2O3 + I2 → Na2S4O6 + 2NaI
З точки зору графічної будови перетворення натрій тіосульфату в натрій тетратіонат має вигляд:

Рівняння електронного балансу:
І2 +2е = 2Іˉ fекв. = 1/2
2S2²ˉ - 2е = 2S2° або 2S2O3²ˉ -2e = S4O6²ˉ fекв. = 1
З урахуванням ефективної валентності молярна маса еквівалента йоду Me(І2) дорівнює ½ його молярної маси, а молярна маса еквіваленту натрій тіосульфату дорівнює його повній молярній масі, оскільки з 2-х молекул Na2S2O3 утворюється одна молекула Na2S4O6 і виділяється два електрони, кожному з яких відповідає одна молекула Na2S2O3
Йодометричним методом визначають миш’як, мідь в мідьвмісних с/г ядах (хлор окису міді), нітрити в розчині, вільний хлор і інше.
Експериментальна частина
Дата добавления: 2018-02-28; просмотров: 877; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
