Змістова частина 2. Аналітична хімія
Лабораторна робота № 7
Тема: Метод нейтралізації. Приготування і стандартизація розчину сульфатної кислоти. (4 год)
Мета: Вивчити технику експерименту у кількісному аналізі. Ознайомитись з методом кислотно-основного титрування; приготувати розчин сульфатної кислоти заданої концентрації та провести стандартизацію його по бурі
Техника безпеки: Бути уважними в хімічній лабораторії, проявляти обережність під час роботи з хімічними реактивами і хімічним посудом.
Актуалізація опорних знань
1. Що вивчає кількісний хімічний аналіз?
2. Що таке кислоти, основи та солі з точки зору теорії електролітичної дисоціації?
3. Назвати основні способи вираження концентрації розчинів, які використовуються в титриметричному аналізі.
Теоретичні передумови до виконання роботи
В основі об`ємного (титрометричного) методу кількісного визначення речовин лежить вимір об`ємів двох взаємодіючих розчинів, один із яких містить аналізуєму речовину, а у другого наперед відома концентрація.
Розчин з точно відомою концентрацією в об`ємному аналізі називають титрованим (титрантом), або робочим розчином. Титрований розчин містить певне число еквівалентів реактивів в літрі.
Розчин, концентрацію якого встановлюють в результаті титрування, називають аналізуємим розчином.
Процес поступового приливання титрованого розчину до розчину аналізуємої речовини називають титруванням.
|
|
|
При титруванні прибавляють із бюретки титрований розчин реактиву до того моменту, поки кількість прибавленої речовини не буде еквівалентна кількості визначаємого компонента в розчині. Цей момент називається еквівалентною точкою титрування.
Еквівалентна точка титрування визначається візуально по зміні забарвлення або утворенню нової фази (поява або зникнення муті), що відбувається в результаті реакції між розчиненими речовинами.
Якщо при реакції не відбувається видимих змін, то для установки кінця титрування в розчин прибавляють допоміжний реактив, що називається індикатором.
Коли реакція між титрованим розчином реактиву і тітруємою речовиною дійде до кінця, індикатор в розчині змінює колір, або утворюється муть. Момент, при якому відбувається ця зміна індикатора, називається точкою кінця титрування
Титровані розчини можна одержати різними способами. В залежності від цього розрізняють стандартні (приготовлені) і стандартизовані (установлені).
Стандартні розчини. Точну наважку речовини переносять в мірну колбу певного об`єму, розчиняють і доводять об`єм розчину водою до мітки.
В цьому випадку титр розчину Т дорівнює наважці (г) поділеній на об`єм розчину (V):
|
|
|
Т=m/V
Титровані розчини, одержані із точної наважки речовини, називають стандартними (або приготовленими).
Стандартизовані розчини (установлені).
В якості титранів найчастіше використовують мінеральні кислоти, луги, перманганат калію, тіосульфат натрію. Розчин з точною концентрацією для цих речовин приготувати не можна. Так, мінеральні кислоти (Н2SO4, НСI) мають непостійний склад, їдкі луги (NaOH, KOH), поглинаючи оксид вуглецю (ІV) і вологу із повітря, змінюють склад при зберіганні; концентрація перманганату і тіосульфату натрію змінюється уже при розчиненні, бо вони взаємодіють з домішками в воді. Отже вміст їх в розчині не може точно відповідати наважці.
Концентрацію таких речовин встановлюють по стандартних розчинах інших речовин. Так, концентрацію гідроксиду натрію встановлюють по стандартному розчину щавлевої кислоти, а концентрацію сульфатної кислоти – по розчину тетраборату натрію.
Розчини, титр яких знаходять не по точній наважці, а встановлюють по тій чи іншій стандартній речовині, називають встановленими або стандартизованими.
Метод нейтралізації
Основною реакцією при цьому методі служить реакція нейтралізації – взаємодія кислот з основами. В одній формі вона виражається рівнянням:
|
|
|
Н+ + ОН- =Н2О
За допомогою цього метода проводять кількісне визначення різних кислот, основ, гідролізованих солей, визначають твердість води. Робочими розчинами в методі нейтралізації являються розчини кислот – сульфатна, хлоридна, щавлева, лугів – калій гідроксид, натрій гідроксид, а також гідролізованих солей, що мають в розчині лужну реакцію, наприклад, бура – Na2B4O7·10H2O і сода Na2СО3·10H2O.
Для знаходження точки еквівалентності (кінця титрування) при методі нейтралізації користуються індикаторами. Це речовини, які змінюють своє забарвлення в залежності від концентрації йонів Гідрогену в розчині.
Точка кінця титрування, яку встановлюють по зміні кольору індикатора, може не співпадати з точкою еквівалентності, що являється дійсною точкою кінця титрування.
Тому треба завжди вибирати такий індикатор, для якого різниця між точкою еквівалентності і точкою кінця титрування являється найменшою.
Основна вимога при виборі індикатора заключається в тому, що інтервал рН, в якому змінюється забарвлення індикатора, по можливості, повинен бути ближче до рН розчину в точці еквівалентності.
Вибір відповідного індикатора необхідно проводити на основі кривих титрування.
|
|
|
Інтервал значень рН, в якому індикатор змінює своє забарвлення, називається областю переходу індикатора.
| Назва індикатора | Область переходу рН | Показник титрування |
| Метил-оранж | 3,1-4,4 | 4,0 |
| Метил-червоний | 4,4-6,2 | 5,5 |
| Лакмус | 5,0-8,0 | 7,0 |
| Фенолфталеїн | 8,0-10,0 | 9,0 |
Розрахунки в титриметричному аналізі.Обчислення в титриметричному аналізі грунтуються на законі еквівалентів: один еквівалент однієї речовини завжди реагує з одним еквівалентом іншої. Тобто, однакові об’єми розчинів з рівними молярними концентраціями еквівалентів містять такі порції речовин, які повністю витрачаються реагуючи одна з одною.
Для загального випадку об’єми розчинів, що прореагували, обернено пропорційні їх молярним концентраціям еквівалентів:
 , або
, або 
Якщо нам відомо об’єм розчину, який аналізують, і об’єм та концентрація робочого розчину можемо обчислити молярну концентрацію речовини еквівалента аналізуємого розчину:

Експериментальна частина
1. Розрахунок і приготування 250 мл розчину H2SO4 молярної концентрації еквівалента 0,1 моль/л.
Для приготування розчину використовують концентровану або розведену (1:5) сульфатну кислоту, визначають її густину за таблицею і знаходять масову частку кислоти в %. Для заміру густини застосовують ареометр.
Густину розчину визначають таким чином. У мірний циліндр наливають розчин кислоти, опускають ареометр, щоб він вільно плавав у розчині, не доторкаючись дна і стінок циліндра. За шкалою ареометра визначають густину розчину.
Для кислот, лугів, солей є спеціальні таблиці, користуючись якими можна за густиною обчислити масову частку розчиненої речовини. Якщо в таблиці немає значення густини, що точно відповідає відліку за шкалою ареометру, то масову частку знаходять інтерполяцією (визначають проміжне значення між двома найближчими значеннями в таблиці).
Для виконання даної роботи проводимо наступний розрахунок:
Дано:
V(розч.) = 250 мл
С((1/2 H2 SO4) = 0,1 моль/л
ρ(розчину) = х г/мл
ω(H2 SO4) _= у%
______________________
V(H2 SO4) - ?
Розв`язання.
1. Обчислимо число молей еквівалентів H2 SO4 в 250 мл розчину:
ν((1/2 H2 SO4) = С((1/2 H2 SO4)∙ V(розч.)
ν((1/2 H2 SO4) = О,1моль/л ∙ 0,25 л = 0,025 моль
2. Знайдемо масу кислоти в розчині:
m(H2 SO4) = ν((1/2 H2 SO4) М(1/2 H2 SO4)
М (H2 SO4) = 98 г/моль; М(1/2 H2 SO4) = 98/2 = 49 г/моль
m(H2 SO4) = 0,025 моль ∙49 г/моль = 1,225 г
3. Обчислимо масу розчину більш концентрованої кислоти, в якій міститься 1,225 г H2 SO4:


 (г).
(г).
4. Визначимо об’єм розчину вихідної кислоти H2 SO4:

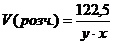 мл.
мл.
Хід роботи
В мірну колбу на 250 мл налийте 100-150 мл дистильованої води. Залийте кислоту в бюретку і відміртье об’єм H2 SO4, який розрахували, в цю мірну колбу. Доведить об’єм дистильованою водою до мітки по ніжньому меніску. Закрийте пробкою і ретельно перемішайте.
2. Стандартизація розчину H2 SO4 по бурі.
Хід роботи
1. Промийте бюретку і, користуючись лійкою, заповніть бюретку кислотою. Зніміть лійку і злийте залишки кислоти, встановивши нижній край меніска на нульовій поділки.
2. Чисту піпетку місткістю 10 мл промийте розчином бури. Відмірьте 10 мл розчину бури і перенесіть в конічну колбу для титрування місткістю 100 мл.
3. Прилийте до розчину бури 2-3 краплі розчину метилового оранжевого.
4. Відтитруйте розчин бури кислотою до появи слабкорозового забарвлення.
5. Повторіть титрування тричі, причому значення об’ємів кислоти повинні відрізнятись одне від одного не більш, ніж на 0,1 мл.
6. Результати титрування запишіть в таблицю і обчисліть молярну концентрацію еквівалента та титр розчину H2 SO4.
| № титрування | Стандартний розчин бури Na2B4O7∙10H2O | Аналізуємий розчин H2 SO4. | ||
| V, мл | C(1/zX), моль/л | V, мл | C(1/zX), моль/л | |
| 1 | ||||
| 2 | ||||
| 3 | ||||
| середнє | ||||
Формули для обчислення:

Дата добавления: 2018-02-28; просмотров: 990; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
