Контрольні запитання і завдання. 1.Що таке ароматичність бензен у світлі сучасних уявлень про пудову його молекули?
1.Що таке ароматичність бензен у світлі сучасних уявлень про пудову його молекули?
2.Напишіть структурні формули таких аренів та їх похідних: а) толуену; 6) о-, м- і n-ксилолів; в) нітротолуену; г) 2-хлор-4-нітротолуену; д) 2,4,6-тринітротолуену. Де використовують ці сполуки?
3.Напишіть структурні формули таких гомологів бензолу та їх похідних і назвіть ці сполуки за раціональною і міжнародною номенклатурами: .і) C8H10 (4 ізомери); б) С9Н12 (8 ізомерів); в) нітротолуолу (3 ізомери); г) бромметилбензену (3 ізомери); д) сульфохлорбензену (3 ізомери).
4.Напишіть хімізм реакцій: а) добування методом Фіттига відповідних аренів: хлорбензол + етилхлорид ; о-хлортолуол + ізопропілхло-ріід; 1-метил-3-хлорбензол + 2-хлорпропан; б) добування реакцією Густавсона - Фріделя - Крафтса: бензен + метилхлорид; толуен + хлорпропан; .м-ксилол + етилбромід; толуен + n-бромнітробензен.
5.Дайте коротку характеристику фізичних властивостей бензену та його найближчих гомологів. Що вам відомо про ІЧ- і УФ-спектри, властиві цим аренам?
6.Які хімічні реакції називають реакціями електрофільного і нуклеофільного заміщення? Наведіть приклади.
7.Як формулюється правило заміщення, або орієнтації, в бензольному ядрі? Які дві групи замісників ви знаєте? Покажіть хімізм реакції їх орієнтувальної дії.
8.Утворення яких органічних речовин можна очікувати при дії на огизол таких реагентів: а) NaО+2 і BF-4; б) HCl + СО(А1С13); в) (СН3)3СВr(А1С13); г) СН3СН = СН2 (А1С13 + HCl). У дужках показано каталізатори. Наведіть хімізм реакцій.
|
|
|
9.Напишіть хімізм реакції окиснення пропілбензолу, n-ксилолу, o-етилтолуену і назвіть продукти реакцій.
10. Виконайте реакцію галогенування толуену з хлором за різних умов (при яскравому світлі і нагріванні, на холоді та за наявності каталізаторів). Наведіть хімізм реакцій.
11. Наведіть хімізм реакцій нітрування і сульфування толуену.
12. Напишіть структурні формули нафталіну, антрацену і фенатрену. Яке значення мають ці речовини?
Лабораторна робота № 17
Тема: Спирти
Мета: набути навичок порівняння фізичних і хімічних властивостей одно- і багатоатомних спиртів, якісного їх визначення.
Знати: будову молекул (хімічну, електронну, просторову) алкенів; види ізомерії; фізичні властивості та їх закономірну зміну в гомологічному ряді; хімічні властивості, основні реакції, чітко розділяючи їх за типом реакцій.
Вміти: складати формули ізомерів насичених одноатомних спиртів та називати їх за систематичною номенклатурою; порівнювати фізичні та кислотні властивості одноатомних та багатоатомних спиртів.
Техніка безпеки: проявляти обережність і бути уважними при проведенні реакцій окиснення, добуванні етилату натрію під час роботи з хімічним посудом та реактивами.
|
|
|
Теоретична частина
Загальна формула спиртів СnH2n+1OH.
Спирти - нейтральні сполуки. Реагують з Nа, К, Lі, Mg, А1 та іншими металами з утворенням сполук типу алканолятів. Це кристалічні речовини, добре розчинні у воді. В результаті взаємодії спиртів із сильними мінеральними кислотами або кислотами Льюїса утворюються етери (прості ефіри). Етерифікація спиртів органічними й мінеральними кислотами призводить до утворення естерів (складних ефірів). Первинні й вторинні спирти окиснюються або дегідруються за наявності металічних каталізаторів до відповідних альдегідів і кетонів. Третинні спирти стійкі до реакцій окиснення у нейтральному й кислому середовищах, за певних умов розщеплюються до кетонів і кислот з меншою кількістю атомів карбону. Спирти легко дегідратуютьоя до алкенів. Гідроксильна група молекули спирту може заміщуватись на атом галогену, реагуючи з галогеноводнями, РС15, РОС13 тощо.
Спирти добувають різними способами. Ряд низькомолекулярних спиртів (етанол, пропанол, бутаноли) добувають бродінням вуглеводів, метанол - у результаті сухої перегонки тирси. Більшість спиртів добувають синтетичними методами-з алкенів гідратацією або гідроборуванням з подальшим окисиеиням, гідролізом відповідних галогенопохідних вуглеводнів, відновленням альдегідів і кетонів, карбонових кислот та естерів.
|
|
|
Хід роботи
Дослід 1.Розчинність одноатомних насичених спиртів у воді
Розчинність спиртів у воді залежить від їх молекулярної маси. Низькомолекулярні спирти (метанол, етанол, пропаноли) змішуються з водою в будь-яких співвідношеннях. Починаючи з бутаполів, розчинність спиртів поступово зменшується. Пентаноли у воді не розчиняються. При змішуванні спиртів з водою спостерігається підвищення температури суміші (вперше було відкрите Д. І. Менделєєвим), що зумовлено гідратацією спиртів.
Беруть чотири пробірки, в кожну з них наливають по 2 - 3 мл дистильованої води. В кожну пробірку добавляють по 4 - 5 крапель одного зі спиртів - етилового, пропілового, бутилового та амілового, збовтують і спостерігають за їх розчинністю.
Запишіть результати розчинності спиртів у воді.
Дослід2. Окиснення етанолу
Етанол легко окиснюється киснем повітря, атомарним оксигеном, що утворюється при розкладанні перманганату калію і дії на спирт хромової суміші.
|
|
|
Здатність етанолу вступати в реакції окиснення ілюструють такі реакції.
1. Окиснення етанолу розчином перманганату калію. У пробірку наливають 2 - 3 мл етанолу і добавляють такий самий об'єм 2 - 5 %-го розчину перманганату калію. Нагрівають. Перманганат калію розкладається. Виділяється атомарний оксиген, який і окиснює етанол. На дно пробірки випадає оксид мангану (IV). Для прискорення реакції рекомендують добавляти 2 - 3 краплі розчину сульфатної кислоти.
Реакція окиснення етанолу відбувається в два етапи:
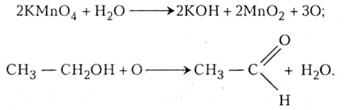
Етапаль (оцтовий альдегід) має температуру кипіння близько 20 °С, дуже леткий і має своєрідний запах.
2. Окиснення етанолу хромовою сумішшю. В експертизі алкогольного сп'яніння часто використовують реакцію Мохова - Шинкаренко, що ґрунтується на здатності хромової суміші окиснювати етанол до етаналю (оцтового альдегіду). Хромова суміш складається з однієї частини 2 н розчину сульфатної кислоти і однієї частини 0,5 н розчину дихромату калію.
У пробірку наливають 2 - 3 мл хромової суміші і добавляють 1 мл етанолу. Останній швидко окислюється до етапалю (його виявляють за своєрідним запахом). Оранжевий колір хромової суміші, в якій містяться йони шестивалентного хрому, при цьому змінюється на зелений, зумовлений наявністю йонів тривалентного хрому.
Реакція відбувається за звичайної температури:

Дослід 3.Добування алкаголяту натрію (етилату натрію)
Спирти енергійно реагують з металічним натрієм (або калієм). Алканогяти подібні до солей слабких кислот, що легко гідролізуються. Під дією води вони відразу розкладаються на спирт і луг:
СН3 - СН2ONа + НОН → СH3 - СН2ОН + NаОН.
Це дає змогу зробити висновок про те, що одноатомні спирти не здатні реагувати з лугами.
Беруть пробірку, на дно якої вміщують очищений від кірки і висушений від гасу фільтрувальним папером кусочок металічного натрію завбільшки з горошину. Пробірку ставлять у штатив у витяжну шафу і добавляють 2-3 мл абсолютного етанолу. Пробірку закривають пробкою з прямою, відтягнутою на кінці газовідвідною трубкою. Відчувається енергійна хімічна реакція - утворюються алканолят натрію і водень. Після закінчення реакції пробірку підносять до пальника і підпалюють водень. Для його накопичення в пробірці отвір трубки заздалегідь можна закрити пальцем. Пробірку охолоджують (іноді на льоду або в крижаній воді), після чого на її дно випадає кристалічний осад алканоляту натрію. До добутого розчину алканоляту натрію добавляють 4 - 5 мл води і кілька крапель розчину фенолфталеїну - з'являється червоно-малинове забарвлення.
При взаємодії етанолу з металічним натрієм атом гідрогену гідроксилу спирту заміщується металом з утворенням алканоляту і виділенням водню:
2С2Н5ОН + 2Na → 2С2Н5ОNа + Н2↑ .
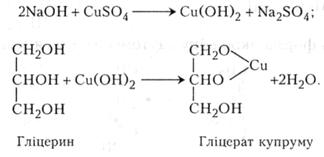
Дослід 4. Добування гліцерату купруму
Гліцерин НОСН2 - СНОН - СН2ОН - трьохатомний спирт. Добувають його гідролізом жиру або синтезують з пропілену. Гліцерин - безбарвна в'язка рідина, добре розчинна у воді, солодка на смак, кипить при 290 °С.
Гліцерин легко взаємодіє з гідроксидами металів, що призводить до утворення своєрідних алканолятів - гліцератів.
В пробірку вміщують 1 - 3 мл 5-10 %-го розчину їдкого натру і добавляють кілька крапель 3 - 5 %-го розчину сульфату купруму. Випадає голубий драглистий осад гідроксиду купруму. Після цього в суміш краплями добавляють гліцерин, збовтують і спостерігають за виникненням темно-сииього прозорого розчину гліцерату купруму.
Утворення гліцерату купруму відбувається в два етапи:
Дата добавления: 2018-02-28; просмотров: 1194; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
