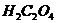Контрольні питання і завдання. 1. Які сполуки зумовлюють твердість природної води?
1. Які сполуки зумовлюють твердість природної води?
2. Які солі зумовлюють карбонатну твердість води?
3. Як визначають карбонатну твердість води?
4. Вода з тимчасовою твердістю 4 ммоль-екв/л містить тільки гідрокарбонат магнію. Яка кількість цієї солі міститься в 1 м3води?
5. Яка тимчасова твердість води, якщо у 300 л її міститься 43,8 г магній гідрокарбонату?
6. Вода з тимчасовою твердістю 4 ммоль-екв/л містить тільки гідрокарбонат кальцію. Яка маса осаду утвориться після кип'ятіння 1 л води, якщо осадження пройшло на 80% ?
7. Напишіть рівняння хімічних реакцій, які будуть відбуватися: при кип'ятінні твердої води, що містить Са(НСО3)2 ; при додаванні до неї Nа2СО3. Виразіть твердість води в ммоль-еквівалентах, враховуючи, що в 1 л води міститься 0,486 г Са(НСО3)2 .
8. Тимчасова твердість води дорівнює 3,0 ммоль/л. Розрахуйте, яка маса гідрогенкарбоната кальцію міститься в 10 л цієї води?
Лабораторна робота № 10
Тема: Метод пермангонатометрії(2 год)
Мета: Ознайомитись з методом окисно-відновного титрування; провести стандартизацію робочого розчину КМnO4, визначити ферум(ІІ) у розчині солі Мора
Техника безпеки: Бути уважними в хімічній лабораторії, проявляти обережність під час роботи з хімічними реактивами і хімічним посудом.
Актуалізація опорних знань
1. Які реакції називаються окисно-відновними?
2. Що таке окисник та відновник?
3. Як визначається молярна маса речовини еквівалента окисника та відновника?
4. Роль середовища в окисно-відновних реакціях.
Теоретичні передумови до виконання роботи
До методів окисно-відновного титрування (редоксіметрії) відносять методи об’ємних визначень, засновані на окисно-відновних реакціях. За допомогою цих методів можливо кількісно визначити окисники і відновники, а також речовини, що з ними реагують.
В якості робочих розчинів в методах окисно-відновного титрування застосовують розчини різних окисників і відновників.
В залежності від робочих розчинів методи окиснення і відновлення розділяються на декілька груп.
Основні серед них слідуючі:
Перманганатометрія.Робочим розчином являється калій перманганат KMnO4.
Хроматометрія.Робочим розчином являється калій біхромат K2Cr2O7.
Йодометрія.Робочим розчином являється розчин йоду в калії йодистому і розчин натрій тіосульфату Na2S2O3.
Йон, який потрібно визначити, повинен бути або окисником, або відновником, а робочий розчин — або відновником, або окисником, відповідно. В процесі титрування між розчином, який аналізують, та робочим розчином відбувається окисно-відновна реакція. Точка еквівалентності визначається за допомогою редокс-індикаторів, але іноді індикатором може бути робочий розчин, або розчин, який титрують.
Перманганатометрія
Перманганатометрією називають метод титрометричного аналізу, в якому робочим розчином служить розчин калій перманганату KMnO4.
В процесі титрування аналізуємого розчину малиново-фіолетове забарвлення розчину перманганату зникає. Однак, після досягнення точки еквівалентності перша ж надлишкова крапля розчину перманганату забарвлює титруєму рідину в блідо-малиновий колір. Індикатором в даному випадку являється сам перманганат калію. Тому при перманганатометричних визначеннях сторонні індикатори не добавляють.
Калій перманганат володіє сильними окисними властивостями. Марганець в ступені окиснення 7+ може змінювати ступінь окиснення до 2+, 4+, 6+. Зниження ступеня окиснення залежить від середовища, в якому протікає реакція.
В кислому (pH<7) MnO4ˉ → Mn²+ Е0 MnO4ˉ/ Mn²+ = 1.51B
В лужному (pH>7)MnO4ˉ → MnО4²ˉ Е0 MnO4ˉ/ MnО4²ˉ=0,56В
В нейтральному (pH=7)MnO4ˉ→MnО2 Е0 MnO4ˉ/ Mn =0.59B
Кисле середовище
2KMnO4 + 5NaNO2 + 3H2SO4 → K2SO4+5NaNO3 + 3H2O + 2MnSO4
Mn+7 +5e → Mn²+ fекв. = 1/5
5 N+3 -2e → N+5 fекв. = ½
Me(KMnO4) = M(KMnO4)/5 Me(KMnO4) = 31,6 г/моль
Me(NaNO2) = M(NaNO2)/2 Me(NaNO2) = 34,5 г/моль
Середовище лужне.
2KMnO4 + NaNO2 + 2KOH → NaNO3 + H2O + 2K2MnO4
 2 Mn+7 +1e → Mn+6 fекв = 1
2 Mn+7 +1e → Mn+6 fекв = 1
1 N+3 -2e → N+5 fекв = 1/2
Me(KMnO4 )= M(KMnO4)/1 Me(KMnO4) = 158 г/моль
Me(NaNO2) = M(NaNO2)/2 Me(NaNO2) = 34.5 г/моль
Нейтральне середовище
2KMnO4 + 3NaNO2 + 2H2O → 2MnO2 + 3NaNO3 + 2KOH
 2 Mn+7 +3e → Mn+4 fекв. = 1/3
2 Mn+7 +3e → Mn+4 fекв. = 1/3
3 N+3 -2e → N+5 fекв. = ½
Me(KMnO4) = M(KMnO4)/3 Me(KMnO4) = 52,7 г/моль
Me(NaNO2) = M(NaNO2)/2 Me(NaNO2) = 34,5 г-моль
Перманганатометрію використовують для кількісного визначення відновників прямим титруванням та окисників – методом оберненого титрування, коли до аналізуємого розчину окисника доливають надлишок допоміжного розчину відновника з відомим титром, а залишок відновника відтитровують розчином KMnO4.
Визначення молярних мас еквівалентів окисників і відновників має свої особливості. Фактор еквівалентності елементу (fекв) визначається за кількістю відданих або прийнятих електронів в електронному балансі окисно-відновного рівняння. Молярна маса еквівалента речовини визначається за формулою:
Ме(х) = М(х)/n,
де n - число електронів.
Перманганатометричним методом визначають в агрохімії вміст заліза (ІІ) в ґрунтах; визначають Са²+ в ґрунті і у витяжках із біологічних матеріалів.
Титрований розчин 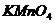 неможливо приготувати розчиненням точної наважки, оскільки він містить домішки і витрачається на окислення аміаку, органічних речовин, що присутні у воді, і розкладається за рівнянням реакції:
неможливо приготувати розчиненням точної наважки, оскільки він містить домішки і витрачається на окислення аміаку, органічних речовин, що присутні у воді, і розкладається за рівнянням реакції:
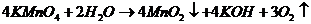
Тому точну концентрацію 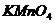 визначають через 7-10 днів після приготування розчину шляхом стандартизації свіже перекристалізованою щавелевою(оксалатною) кислотою
визначають через 7-10 днів після приготування розчину шляхом стандартизації свіже перекристалізованою щавелевою(оксалатною) кислотою 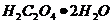 .
.
Приготування розчину 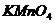
Припустимо, що для роботи потрібно приготувати 0,5 л розчину молярної концентрації еквівалента = 0,03 моль/л.
Розрахунок необхідної маси 
Дано: 

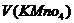 =500 мл
=500 мл 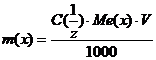
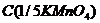 = 0, 03 моль/л
= 0, 03 моль/л


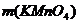 = ?
= ?
Згідно розрахунку потрібна маса 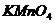 0,47 г.
0,47 г.
Проте, з урахуванням окислювальних процесів, треба зважити на технічних терезах 0,47 + 0,3 = 0,77 г 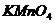 , цю наважку розчиняють у плоскодонній колбі в 500 мл дистильованої води при перемішуванні (воду видмірюють мірним циліндром).
, цю наважку розчиняють у плоскодонній колбі в 500 мл дистильованої води при перемішуванні (воду видмірюють мірним циліндром).
Через 7-10 діб розчин стабілізується. Одержаний розчин 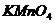 обережно зливають сифоном в посудину з темного скла з притертою пробкою.
обережно зливають сифоном в посудину з темного скла з притертою пробкою.
Експериментальна частина
1. Стандартизація розчину 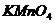
Хід роботи
1.Бюретку на 25 мл наповнюють розчином 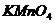 , відлік робіть за верхнім меніском.
, відлік робіть за верхнім меніском.
2. В колбу для титрування перенесіть піпеткою 10 мл стандартного розчину 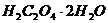 , додайте циліндром 10 мл розчину сульфатної кислоти
, додайте циліндром 10 мл розчину сульфатної кислоти  = 2 моль/л.
= 2 моль/л.
3. Вміст колби нагрійте до  не вище
не вище  (при кипінні щавелева кислота розкладається) і гарячий розчин
(при кипінні щавелева кислота розкладається) і гарячий розчин 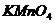 відтитруйте.
відтитруйте.
Кожну наступну краплю 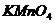 слід додавати після знебарвлення попередньої. Спочатку реакція проходить повільно, але при накопиченні
слід додавати після знебарвлення попередньої. Спочатку реакція проходить повільно, але при накопиченні  , що є каталізатором, реакція прискориться. Титрування припиніть, коли одна надлишкова крапля забарвить розчин у блідо-малиновий колір.
, що є каталізатором, реакція прискориться. Титрування припиніть, коли одна надлишкова крапля забарвить розчин у блідо-малиновий колір.
Титрування повторіть тричі і для розрахунку точної концентрації і титру 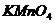 візьміть середнє значення об’єму розчину
візьміть середнє значення об’єму розчину 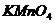 . Розрахуйте титр і молярну концентрацію еквіваленту розчину
. Розрахуйте титр і молярну концентрацію еквіваленту розчину 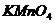 , що стандартизують. Результати занесіть у таблицю
, що стандартизують. Результати занесіть у таблицю
| № титрування | Розчин | |||
| Стандартизований | Робочий | |||
| V, мл | 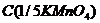 , моль/л , моль/л
| V, мл | 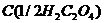 , моль/л , моль/л
| |
| 1 | 10,00 | |||
| 2 | 10,00 | |||
| 3 | 10,00 | |||
| середнє | 10,00 | |||
Формули для розрахунку:
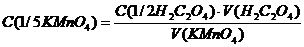

2. Визначення ферум(II) у розчині солі Мора 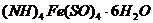
Суть методу: сіль Fe(II) у кислому середовищі титрується калій перманганатом; за кількістю використаного 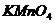 обчислюється маса
обчислюється маса 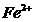 у розчині солі Мора. Реакція між сіллю Мора і калій перманганатом у кислому середовищі проходить за рівнянням:
у розчині солі Мора. Реакція між сіллю Мора і калій перманганатом у кислому середовищі проходить за рівнянням:
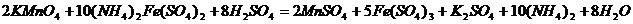

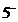
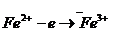
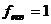
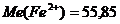 г/моль
г/моль
1 
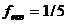
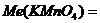 31,6 г/моль
31,6 г/моль
Хід роботи
1. Отримайте у викладача розчин для аналізу (“задачу”), який містить сіль Мора (мірна колба на 100мл). Об’єм розчину доведіть до позначки дистильованою водою і перемішайте.
2. У колбу для титрування перенесіть піпеткою 10мл “задачі”, додайте циліндром 10мл розчину 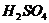 молярної концентрації еквіваленту 2 моль/л і відтитруйте стандартним розчином
молярної концентрації еквіваленту 2 моль/л і відтитруйте стандартним розчином 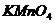 до рожевого кольору.
до рожевого кольору.
3. Титрування повторіть тричі, середнє значення об’єму 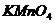 , що пішов на титрування, використайте для розрахунку концентрації титра солі Мора і маси ферум-йону
, що пішов на титрування, використайте для розрахунку концентрації титра солі Мора і маси ферум-йону  .
.
| № титрування | Розчин | |||
| Робочий | Для аналізу | |||
| V, мл | 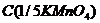 , моль/л , моль/л
| V, мл | С  , моль/л , моль/л
| |
| 1 | 10,00 | |||
| 2 | 10,00 | |||
| 3 | 10,00 | |||
| середнє | 10,00 | |||
Формули для розрахунку
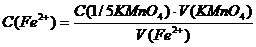
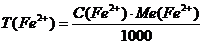
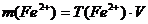 мірної колби
мірної колби
Дата добавления: 2018-02-28; просмотров: 867; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!