ОПРЕДЕЛЕНИЕ КАРБОНАТ- И ГИДРОКАРБОНАТ-ИОНОВ
Реактивы.Соляная кислота, НС1, 0,1000 М стандартный раствор.
Индикаторы: метиловый оранжевый, 0,1%-ный водный раствор;фенолфталеин, 0,1%-ный раствор в 60%-ном этаноле.
Выполнение определения
1. Определение карбонат-ионов. Раствор смеси СО32- и НСО3- в мерной колбе вместимостью 50 мл разбавляют водой до метки и хорошо перемешивают. Пипеткой отбирают 10,0 мл раствора в коническую колбу для титрования вместимостью 200-250 мл, прибавляют 20 мл воды, 5 капель фенолфталеина и титруют из бюретки раствором НС1 до обесцвечивания от одной капли титранта. Измеряют объем НС1 (V1).Раствор не выливают, а продолжают анализ по п. 2.
2. Определение гидрокарбонат-ионов. В оттитрованный по фенолфталеину раствор вводят 2 капли метилового оранжевого и титруют раствором НС1 до изменения окраски из чисто-желтой в оранжевую. Измеряют объем НС1 (V2). Рассчитывают содержание ионов (г).
Методы определения серной и фосфорной кислот при совместном присутствии
Реакции:
H2SO4 + 2 NaOH = Na2SO4 + 2 H2O,
H3PO4 + NaOH = NaH2PO4 + H2O.
При титровании этой же смеси с фенолфталеином взаимодействие кислот
со щелочью происходит в соответствии с уравнениями реакций:
H2SO4 + 2 NaOH = Na2SO4 + 2 H2O,
H3PO4 + 2 NaOH = Na2HPO4 + 2 H2O.
Ход работы. Анализируемую смесь переносят в мерную колбу, доводят объем дистиллированной водой до метки и после тщательного перемешивания отбирают аликвотную часть раствора из мерной в коническую колбу. Добавляют 2–3 капли метилового оранжевого и титруют смесь раствором щелочи известной концентрации. Титрование повторяют несколько раз. Затем титруют такую же порцию анализируемой смеси с индикатором фенолфталеином. Титрование повторяют несколько раз. По результатам титрования смеси кислот с двумя индикаторами определяют объемы NaOH, затраченные на взаимодействие ее с H2SO4 и с H3PO4. Зная концентрацию раствора NaOH, вычисляют содержание каждого компонента смеси. Индикаторы.метиловый оранжевый  фенолфталеин
фенолфталеин 
|
|
|
21. Титриметрический метод анализа. Закон эквивалентностей. Требования к реакциям в титриметрии. Кривые титрования. Монологарифмические и билогарифмические кривые. Характеристики кривых титрования. Влияние различных факторов на вид кривой титрования и величину скачка.Титриметрический метод анализа – это метод основанный на измерении количества реагента, затраченного на реакцию с определяемым компонентом.
Титриметрический метод анализа – это метод основанный на измерении количества реагента, затраченного на реакцию с определяемым компонентом.
Закон эквивалентностей:
Химические элементы соединяются друг с другом в строго определенных количествах, соответствующих их эквивалентам (Растворы с одинаковой концентрацией эквивалентно взаимодействуют в равных объёмах).
|
|
|
Эквивалент – это условная частица, в целое число раз меньшая (или равная) соответствующей ей формульной единицы - атома, молекулы, иона, радикала и др. (это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях).
n[fэкв(x)(X)]=n[fэкв(R)(R)] (X-опред. в-во, R-реагент, f-фактор эквив. n-кол-во эквив.).
С[fA1(A1)]∙V1=С[fA2(A2)]∙V2 (С[fA1(A1)]-эквив. конц.)
Если известны обьём и конц. титранта можно рассчитать массу опред. в-ва mx=CR∙VR∙Mэ(Х)
Требования к реакциям в титриметрии:
Взаимодействие между реагентом и определяемым веществом должно проходить стехиометрически, в точном соответсвии с уравнением реакции
Реакция должна протекать быстро, количественно, т.е. константа равновесия должна быть высокой
Реагент не должен вступать в побочные реакции
Должен существовать способ фиксирования точки эквивалентности.
Точка эквивалентности – точка, в которой рассчитывается теоретическое эквивалентное количество титранта.
Конечная точка эквивалентности – точка, в которой заканчивается титрование с помощью специального указателя – индикатора.
|
|
|
Кривая титрования – график зависимости параметра системы, связанного с концентрацией определяемого вещества, титранта или продукта реакции, от состояния раствора в процессе титрования.По оси ординат – C, lgC, E, I; по оси абсцисс – Vm или f(j)-степень оттитрованности.
ВидыПри построении кривых по осям координат можно откладывать разные величины. Если по оси ординат отложить логарифм концентрации или величину, пропорциональную этому логарифму, получаются логарифмические кривые титрования. Если же по оси ординат откладывать концентрацию или физико-химический параметр, пропорциональный концентрации, получаются линейные кривые титрования. Линейная кривая титрования выражается двумя прямолинейными участками, пересекающимися в точке эквивалентности. Такие кривые нашли применение для определения точки эквивалентности с помощью физико-химических методов, когда переменным параметром является какое-либо физическое свойство, пропорциональное концентрации. Для выбора индикатора и определения погрешности титрования более удобны логарифмичекие кривые титрования.Логарифмическая кривая титрования представляет собой S-образную кривую, на которой имеются области плавного и резкого изменения логарифма переменного параметра. Резкое изменение наблюдается вблизи точки эквивалентности; эта область называется скачком титрования.
|
|
|
В некоторых случаях продукты реакции титрования практически не влияют на равновесные концентрации [А] или [Т]. В этих случаях при построении кривых титрования по оси ординат можно отложить логарифм концентрации А или Т. Такие кривые называют монологарифмическими.
Если же продукты каким то образом влияют на [А] или [Т], то при расчете [А] следует учитывать равновесные концентрации продуктов. Переменный параметр будет определяться отношением концентраций сопряженной пары. Кривые, по оси ординат которых отложен логарифм отношения концентраций, называют билогарифмическими.
Представление количественных характеристик кривых титрования
границы скачка титрования устанавливаются в зависимости от требуемой точности, чем выше точность, тем уже скачок.
Кривая характеризуется количественной характеристикой – крутизной.
Крутизна – мера чувствительности и точности титрования.
Ƞ=  =
= 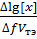
Ƞ - индекс крутизны,  – объем, пошедший на изменение
– объем, пошедший на изменение 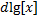
Максимальное значение Ƞ вблизи точки эквивалентности. Чем выше Ƞ, тем чувствительнее метод определения.
Представление факторов, влияющих на вид кривой титрования
1. Концентрация кислоты. Чем ниже концентрация титруемой кислоты, тем меньше скачок титрования.
2. Температура. Величина константы автопротолиза воды, входящей в формулы расчета рН, зависит от температуры - с повышением температуры величина константа автопротолиза заметно возрастает. Поэтому с повышением температуры рН воды также водных растворов оснований уменьшается. Это приводит к смещению точки эквивалентности и ветви кривой за точкой эквивалентности в область меньших значений рН; в результате скачок титрования уменьшается. При изменении температуры рН растворов кислот и буферных смесей изменяется в меньшей степени.
3. Природа титруемой кислоты. Чем меньше константа диссоциации кислоты, тем выше рН растворов в начале титрования и в области буферного действия. Чем слабее титруемая кислота, тем сильнее сопряженное основание, образующееся при титровании Отсюда ясно, что с уменьшением константы диссоциации кислоты точки эквивалентности и начальная ветвь кривой титрования смещаются в область более высоких значений рН, однако за точкой эквивалентности кривая остается без изменений, и скачок титрования уменьшается.
Чем слабее кислота, тем меньше скачок титрования. При каком же минимальном значении константы диссоциации кислоты возможно обнаружение точки эквивалентности с помощью кислотно-основных индикаторов? Величина скачка не должна быть меньше интервала перехода окраски индикатора, обычно лежащего пределах Кaинд ±1. Следовательно, необходимо выполнение условия КaHA >10-10 – 10-11.
Кислотно-основные индикаторы, примеры. Теории индикаторов. Равновесие кислотно-основного индикатора в растворе. Константа кислотности индикатора. Интервал перехода окраски индикатора. Показатель индикатора рТ. Выбор индикатора для титрования.
к-о индикаторы – органические соединения меняющие окрасу при изменении pH.
Примеры:
Азоиндикаторы



Дата добавления: 2016-01-05; просмотров: 22; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
