Представление условий титрования указанного протолита
Титрование исследуемого раствора стандартным раствором хлороводородной кислоты. Исследуемый раствор получают в мерную колбу, разбавляют до метки водой, перемешивают. Аликвотную часть задачи отбирают в коническую колбу, добавляют 2 – 3 капли индикатора метилового оранжевого и титруют рабочим раствором HCl до перехода окраски из желтой в оранжевую. Титрование повторяют несколько раз, усредняют три приемлемых результата (три значения объема титранта, отличающихся не более, чем на 0,1 мл).
Содержание КOH рассчитывают по формуле: m (КOH) =C (HCl) ×  ×
× 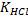 ×M экв. (КOH) ×P×10-3,
×M экв. (КOH) ×P×10-3,
где Р – разбавление, пипетки мерной колбы Р = 
18. Титриметрический кислотно-основной метод определения аммиака в медицинском препарате: возможные титранты, стандартизация рабочего раствора, первичные и вторичные стандарты, кривая титрования гидроксида аммония, условия титрования слабых протолитов, возможные индикаторы, индикаторные погрешности.
Титриметрический метод анализа – это метод основанный на измерении количества реагента, затраченного на реакцию с определяемым компонентом.
Возможные тиранты: C(НСl) = 0,1 моль/л
Стандартизация рабочего раствора, первичные и вторичные стандарты:
В титриметрическом анализе пользуются титрованными растворами: первичными и вторичными стандартами.
Когда вещество, соответствует химической формуле и является химически чистым, навеску этого вещества можно рассчитать в соответствии с заданным титром раствора и отвесить его на аналитических весах с точностью до 0,0002 г.
|
|
|
Навеску для приготовления раствора рассчитывают по формуле: 
Взвешенное вещество помещают в откалиброванную мерную колбу, растворяют в воде или другом подходящем растворителе, доводят объем раствора до метки и тщательно перемешивают.
Когда вещество не может быть получено в чистом виде или когда оно отличается неустойчивостью, из него готовят растворы приблизительной концентрации (беря навеску на технических весах с точностью до 0,01 г). Затем их стандартизуют, т.е. устанавливают истинную концентрацию, либо по так называемым исходным веществам (первичным стандартам), либо по рабочим растворам с уже точно определенной концентрацией (вторичным стандартам). Проверяют концентрацию приготовленного раствора и выводят коэффициент поправки К: 
Определение К раствора HCl методом отдельных навесок: Коэффициент поправки устанавливают по буре (Na2B4O7·10H2O) методом отдельных навесок.
Преимущество заключается в высокой молярной массе эквивалента, борная кислота слабая, что дает более резкий переход в конце титрования.
Реакция:
Na2B4O7 + 2HCl + H2O ® 4HBO2 + 2NaCl; fэкв(Na2B4O7) =1/2.
|
|
|

Недостаток при хранении постепенно теряет часть кристаллизационной воды, и состав такой выветрившейся соли не соответствует химической формуле. Поэтому ее подвергают перекристаллизации из воды. Водный раствор буры имеет щелочную реакцию среды:
Na2B4O7 + 7H2O ® 4H3BO3 + 2NaОН, поэтому его можно титровать кислотой:
Ход титрования Навеску буры, взятую на аналитических весах на часовом стекле или в ампуле, соответствующую 15 – 25 мл 0,1 моль/л раствора, количественно переносят в коническую колбу, растворяют в 50 мл теплой дистиллированной воды охлаждают, добавляют 2 – 3 капли раствора индикатора метилового оранжевого и титруют до перехода окраски из желтой в оранжево-розовую. Определение повторяют три раза. Рассчитывают КHCl, усредняют три значения, отличные не более, чем на 0,005:

Расчет кривой титрования:
Указание веществ, существующих в системе в тот или иной момент титрования:
До начала титрования – V(NH4OH)=100% V(HCl)=0%
До ТЭ:
V(NH4OH)=100% V(HCl)=50%
V(NH4OH)=100% V(HCl)=99%
V(NH4OH)=100% V(HCl)=99,9%
В ТЭ – V(NH4ОН)=100 % V(HCl)=100%
После ТЭ
V(NH4OH)=100% V(HCl)=100,1%
V(NH4OH)=100% V(HCl)=101%
V(NH4OH)=100% V(HCl)=110%
Представление формул для расчета: При условии С0=СТ
До начала титрования:


До ТЭ:


В ТЭ:


После ТЭ:

Кривая титрования: 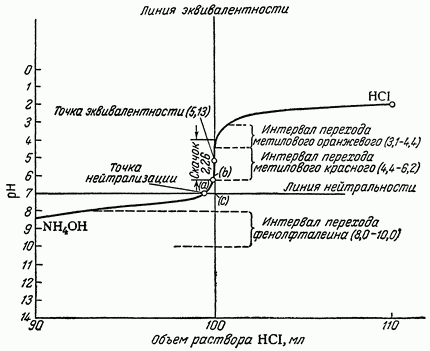
|
|
|
Представление возможных индикаторов с указанием структурных формул
| Индикатор | Структурная формула | рТ | Интервал перехода рН и окраска индикатора |
| Метиловый оранжевый | 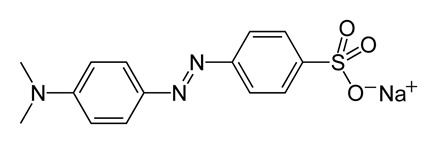
| 4,0 | 3,1–4,4 Красная – оранжево-желтая |
| Бромтимоловый синий | 
| 7,0 | 6,0–7,6 Желтая – синяя |
| Фенолфталеин | 
| 9,0 | 8,2–10 Бесцветная – фиолетовая |
Представление погрешностей титрования с тем или иным выбранным индикатором
Индикаторные погрешности – это погрешности обусловленные несоответствием между показателем индикатора и рН в точке эквивалентности.
«+»ошибка – избыток титранта. «-» ошибка – избыток титруемого вещества.
Индикаторные погрешности:
Водородная (гидроксониевая)
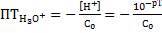 (без учета разбавления)
(без учета разбавления)
 (с разбавлением)
(с разбавлением)
Гидроксильная ошибка
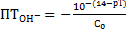 (без учета разбавления)
(без учета разбавления)
 (с разбавлением)
(с разбавлением)
Кислотная или НА-ошибка


Основная или В-ошибка

Представление условий титрования указанного протолита
Полученную контрольную задачу в мерной колбе на 25 мл разбавляют дистиллированной водой до метки и тщательно перемешивают. Отбирают мерной пипеткой аликвотную долю приготовленного раствора объемом 1 мл, добавляют из бюретки 2 мл раствора натрия гидроксида (титрант 1), предварительно стандартизованного по хлороводородной кислоте. Колбу нагревают на асбестовой сетке пламенем газовой горелки до кипения, после чего раствор осторожно кипятят еще 5-10 мин, не допуская разбрызгивания, до полного удаления аммиака из раствора.
|
|
|
Полноту удаления аммиака проверяют, держа над паром полоску влажной красной лакмусовой бумаги, которая не должна синеть, если весь аммиак улетучился. Содержимое колбы охлаждают, обмывают стенки колбы водой до восстановления первоначального объема раствора 3 мл, добавляют 1 каплю индикатора метилового оранжевого и титруют раствором HCl (титрант 2) до появления золотисто-оранжевой окраски раствора. Титрование проводят не менее 5 раз до получения воспроизводимых результатов.
рассчитывают для каждого i-го титрования массу аммиака в анализируемом растворе аммониевой соли по формуле для обратного титрования (2.20), которая в данном случае имеет вид:
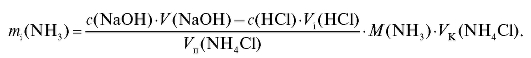
По полученным данным можно рассчитать ошибку титрования. При титровании NaOH HCl c метиловым оранжевым допускается положительная водородная ошибка, которую рассчитывают по формуле:

где V2 - объем титруемого раствора в КТТ, л.
Титрование многопротонных протолитов. Условия существования нескольких скачков на кривой титрования. Построить кривую титрования фосфорной кислоты, малеиновой кислоты или карбоната натрия (на выбор преподавателя), подобрать индикаторы.
Многопротонные протолиты как правило являются либо слабыми протолитами, либо по I ступени протолитами средней силы. Их диссоциация протекает ступенчато, причем по следующей ступени дисперсия протекает хуже, чем по предыдущей.
На кривой титрования может наблюдаться несколько скачков, их количество зависит от значений и соотношений Кдис. Чтобы получить отчетливые скачки титрования:
Значения  и т.д. должны быть достаточно велики, т.е.
и т.д. должны быть достаточно велики, т.е.  .
.
Последующие Кдис должны отличаться как минимум на 4 порядка  .
.
Малеиновая кислота 
 =1,2•10-2
=1,2•10-2 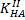 =6,0•10-7
=6,0•10-7
 2 скачка
2 скачка
Фосфорная кислота
 =7,6•10-3
=7,6•10-3 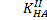 =6,2•10-8
=6,2•10-8  =4,4•10-13 3 скачка
=4,4•10-13 3 скачка

Карбонат натрия
0,10 М Na2CO3 0,10 М раствором HCl
| f | Компонент, определяющий рН | Формула для расчёта рН (pKa1 = 6,35; pKa2 = 10,32) | рН |
| слабое основание СO32- | 
| 11,7 | |
| 0,50 | буферная смесь HCO3-/CO32- | 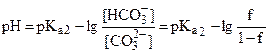
| 10,4 |
| 0,90 | то же | аналогично | 9,37 |
| 0,95 | то же | аналогично | 9,04 |
| 1,00 | амфолит HCO3- | 
| 8,34 |
| 1,05 | буферная смесь H2CO3/HCO3- | 
| 7,63 |
| 1,50 | то же | аналогично | 6,35 |
| 1,90 | то же | аналогично | 5,40 |
| 1,99 | то же | аналогично | 4,45 |
| 2,00 | слабая кислота H2CO3 | 
| 3,91 |
| 2,01 | сильная кислота | 
| 3,48 |
| 2,10 | то же | аналогично | 2,48 |
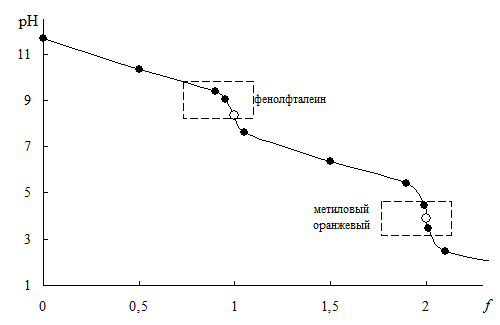
Рис. 13.3 Кривая титрования 0,10 М Na2CO3 0,10 М раствором HCl
H3PO4 расчет кривой титрования
указание веществ, существующих в системе в тот или иной момент титрования
До начала титрования – V(H3PO4)=100% V(NaOH)=0%
До первой ТЭ:
V(H3PO4)=100% V(NaOH)=50%
V(H3PO4)=100% V(NaOH)=99%
V(H3PO4)=100% V(NaOH)=99,9%
В первой ТЭ - V(H3PO4)=100% V(NaOH)=100%
После первой ТЭ:
V(H3PO4)=100% V(NaOH)=100,1%
V(H3PO4)=100% V(NaOH)=101%
V(H3PO4)=100% V(NaOH)=110%
Во второй ТЭ - V(H3PO4)=100% V(NaOH)=200%
После второй ТЭ:
V(H3PO4)=100% V(NaOH)=200,1%
V(H3PO4)=100% V(NaOH)=201%
V(H3PO4)=100% V(NaOH)=210%
В третьей ТЭ - V(H3PO4)=100% V(NaOH)=300%
представление формул для расчета
До начала титрования: рН≈1,7 рН= 
До первой ТЭ: pH= 
В первой ТЭ: pH≈4,66 рН= 
После первой ТЭ: pH= 
Во второй ТЭ: pH≈9,9 рН= 
После второй ТЭ: pH= 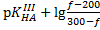
В третьей ТЭ: pH≈13,0 pH= 
Кривая титрования

Индикаторы
По I стадии титруется с метилоранжем  По II стадии титруется с фенолфталеином
По II стадии титруется с фенолфталеином 
Обоснование выбора того или иного индикатора
Выбор индикатора зависит от рТ индикатора и рН раствора на определенной стадии титрования раствора.
Титрование смесей протолитов. Дифференцированное титрование. 1) методы определения карбонат- и гидроксид-ионов при совместном присутствии; 2) методы определения карбонат- и гидрокарбонат-ионов при совместном присутствии; 3) методы определения серной и фосфорной кислот при совместном присутствии (на выбор преподавателя). Формулы для расчета каждого из компонентов смеси
Дифференциальное титрование – титрование, при котором происходит несколько скачков для каждого протолита.
Раздельное титрование смеси протолитов возможно в том случае:
К каждого из протолитов 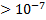
К 1-го/К 2-го 
Если  , то только 1 скачок, соответствующий сумме.
, то только 1 скачок, соответствующий сумме.
Определение содержания Na2CO3 и NaOH в их смеси
Сначала титруют анализируемую смесь 0,1 н. кислотой в присутствии фенолфталеина. При этом нейтрализуется весь NaOH и «наполовину» Na2CO3, превращаемый в NaHCO3. Этим путем можно установить, сколько миллилитров кислоты (VHCl) идет на титрование NaOH+1/2Na2CO3. Затем раствор дотитровывают кислотой в присутствии метилового оранжевого. Так устанавливают, сколько миллилитров кислоты требуется на титрование Na2CO3, образовавшегося из Na2CO3, т. е. половины Na2CO3.
Таким образом, пользуясь двумя индикаторами, удается наблюдать две. точки эквивалентности: первую, когда полностью нейтрализован NaOH и «наполовину» Na2CO3, и вторую, когда нейтрализуется Na2CO3. В этот момент наступает полная нейтрализация смеси Na2CO3+NaOH.
Формулы:
В первой точке эквивалентности:

Этот момент фиксируют с помощью фенолфталеина, меняющего свой цвет в интервале pH=8-10.
Во второй точке эквивалентности:

Этот момент фиксируют с помощью метилового оранжевого, меняющего свою окраску в интервале рН=3,1-4,4. Уравнения реакций:

Методика определения.
К титруемому раствору прибавляют 3-5 капель фенолфталеина и титруют 0,1 н. раствором HCl до обесцвечивания. По достижении первой точки эквивалентности отсчитывают количество 0,1 н. раствора к-т, израсходованной на нейтрализацию NaOH и «половины» Na2CO3. Затем к титруемому раствору прибавляют 1—2 капли метилового оранжевого и титруют быстро до появления оранжевой окраски. По окончании титрования отсчитывают израсходованное количество кислоты HCl.Титрование лучше проводить со «свидетелями».
Расчет результатов анализа.
Зная V1HCl (первое показание по шкале бюретки) и V11HCl (второе показание по шкале бюретки), можно рассчитать содержание в смеси Na2CO3 и NaOH, воспользовавшись соответствующими формулами.
Если на титрование NaOH+1/2 Na2CO3 пошло V1HCl, а на титрование смеси Na2CO3+NaOH пошло V11HCl то на титрование1/2 Na2CO3 будет израсходовано V111HCl= V11HCl -V1HCl
На титрование всего Na2CO3:
V1111HCl= V111HCl·2=2· (V11HCl -V1HCl);
на титрование NaOH: V11111HCl= V11HCl -V1111HCl = V11HCl -2• (V11HCl -V1HCl)= 2• V1HCl - V11HCl.
1. Метод отдельных навесок:

2. Метод пипетирования:

Если известна навеска смеси NaOH+Na2CO3, растворенная в Vk (общий объем раствора), то можно вычислить процентное содержание отдельных компонентов смеси, умножив 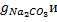
 на 100 и разделив на величину навески.
на 100 и разделив на величину навески.
Дата добавления: 2016-01-05; просмотров: 67; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
