Определение солей аммония формальдегидным методом
Суть: Одним из самых точных методов определения солей аммония является формальдегидный. Он основан на реакции
4NH4Cl + 6H2CO = (CH2)6N4 + 6H2O + 4HCl. Образующуюся в результате реакции кислоту титруют раствором NaOH в присутствии фенолфталеина 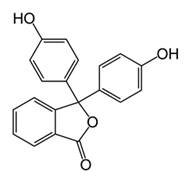 . Этот индикатор необходимо применять, потому что ТЭ находится при pH>7, т.к. в результате приведенной ниже реакции образуется слабое основание – гексаметилентетраамин (уротропин). Кроме того, H2CO часто загрязнен муравьиной кислотой, которая также оттитровывается раствором щелочи.
. Этот индикатор необходимо применять, потому что ТЭ находится при pH>7, т.к. в результате приведенной ниже реакции образуется слабое основание – гексаметилентетраамин (уротропин). Кроме того, H2CO часто загрязнен муравьиной кислотой, которая также оттитровывается раствором щелочи. 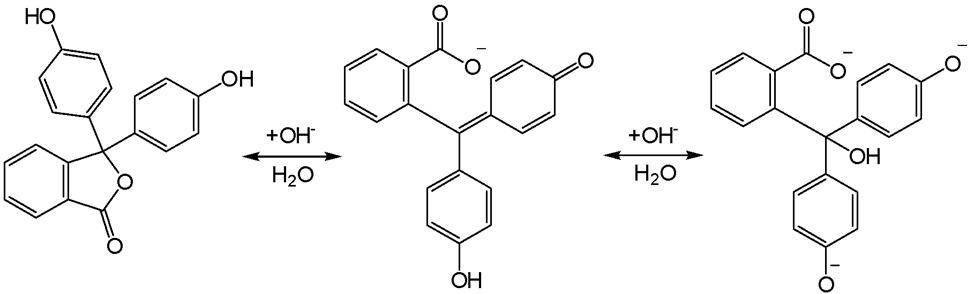
Возможные титранты: гидроксид натрия NaOH, стандартный, 0,1000 М раствор.
Выполнение определения: В колбу для титрования емкостью 100 мл из бюретки вносят 5,0 мл формальдегида и 4-5 капель фенолфталеина. Титруют 0,1000 М раствором NaOH до появления бледно-розовой окраски.
К полученному раствору добавляют 10,00 мл анализируемого раствора, содержащего соли аммония, оставляют на 1-2 мин и затем титруют стандартным раствором гидроксида натрия до появления бледно-розовой окраски, устойчивой в течение 30 сек. Рассчитывают содержание NH4Cl по формуле:
mNH4Cl,г =C(NaOH) ·Vср(NaOH) ·Mэкв(NH4Cl) ·P·10-3.
Подобный вид титрования называется титрованием по методу вытеснения (титрование заместителя). Этот вид титрования применяется тогда, когда определяемое вещество напрямую не взаимодействует с титрантом или реакция между определяемым веществом и титрантом протекает нестехиометрически. Титрование заместителя заключается в титровании не определяемого вещества, а эквивалентного ему количества заместителя Х’, получающегося в результате предварительно проведенной реакции между определяемым веществом и каким-либо определяемым реагентом.
|
|
|
Другие способы титрования: 1) прямое титрование – титрование раствора определяемого вещества непосредственно подходящим раствором титранта. 2) Обратное титрование – применяют, когда реакция между Xи Rпротекает недостаточно быстро, отсутствует подходящий индикатор или наблюдается нечеткий переход окраски индикатора, а также когда возможны потери определяемого компонента вследствие его летучести. 3) Косвенное титрование – титрование, когда определяемое вещество непосредственно не взаимодействует с титрантом, но определяется косвенно в результате использования стехиометрическипротекаемой промежуточной реакции его с другим веществом, реагирующим с титрантом.
Стандартизация рабочего раствора, первичные и вторичные стандарты. Поскольку в титриметрическом анализе содержание определяемого вещества рассчитывают по объему титрованного раствора, израсходованного на титрование, от тщательности приготовления последнего зависит успех анализа. Концентрация титрованного раствора (его титр) должна быть определена очень точно.
|
|
|
В титриметрическом анализе пользуются титрованными растворами: первичными и вторичными стандартами.
В тех случаях, когда вещество, применяемое для приготовления раствора строго соответствует химической формуле и является химически чистым, навеску этого вещества можно рассчитать в соответствии с заданным титром раствора и отвесить его на аналитических весах с точностью до 0,0002 г.
Навеску для приготовления раствора рассчитывают по формуле:

Взвешенное вещество помещают в откалиброванную мерную колбу, растворяют в воде или другом подходящем растворителе, доводят объем раствора до метки и тщательно перемешивают. Приготовление растворов известной концентрации требует соблюдения очень точных приемов работы и большого опыта.
В тех случаях, когда вещество не может быть получено в чистом виде или когда оно отличается неустойчивостью (легко теряет кристаллизационную воду, подвергается действию углекислого газа или воздуха, вступает во взаимодействие с примесями, содержащимися в воде и т.д.), из него готовят растворы приблизительной концентрации (беря навеску на технических весах с точностью до 0,01 г). Затем их стандартизуют, т.е. устанавливают истинную концентрацию, либо по так называемым исходным веществам (первичным стандартам), либо по рабочим растворам с уже точно определенной концентрацией (вторичным стандартам). Проверяют концентрацию приготовленного раствора и выводят коэффициент поправки К:  .
.
|
|
|
17. Титриметрический кислотно-основной метод определения гидроксида калия в техническом продукте: возможные титранты, стандартизация рабочего раствора, первичные и вторичные стандарты, кривая титрования гидроксида калия, возможные индикаторы, индикаторные погрешности.
Титриметрический метод анализа – это метод основанный на измерении количества реагента, затраченного на реакцию с определяемым компонентом.
Возможные тиранты: C(НСl) = 0,1 моль/л
Стандартизация рабочего раствора, первичные и вторичные стандарты:
В титриметрическом анализе пользуются титрованными растворами: первичными и вторичными стандартами.
Когда вещество, соответствует химической формуле и является химически чистым, навеску этого вещества можно рассчитать в соответствии с заданным титром раствора и отвесить его на аналитических весах с точностью до 0,0002 г. Навеску для приготовления раствора рассчитывают по формуле и готовят раствор:
|
|
|

Взвешенное вещество помещают в откалиброванную мерную колбу, растворяют в воде или другом подходящем растворителе, доводят объем раствора до метки и тщательно перемешивают.
Когда вещество не может быть получено в чистом виде или когда оно отличается неустойчивостью, из него готовят растворы приблизительной концентрации (навеску на технических весах с точностью до 0,01 г). Затем их стандартизуют, т.е. устанавливают истинную концентрацию, либо по так называемым исходным веществам (первичным стандартам), либо по рабочим растворам с уже точно определенной концентрацией (вторичным стандартам). Проверяют концентрацию приготовленного раствора и выводят коэффициент поправки К: 
Определение К раствора HCl методом отдельных навесок: Коэффициент поправки устанавливают по буре (Na2B4O7·10H2O) методом отдельных навесок.
Преимущество данного исходного вещества заключается в высокой молярной массе эквивалента, кислота слабая, что дает более резкий переход в конце титрования.
Реакция:
Na2B4O7 + 2HCl + H2O ® 4HBO2 + 2NaCl; fэкв(Na2B4O7) =1/2.

Недостаток при хранении постепенно теряет часть кристаллизационной воды. Поэтому ее подвергают перекристаллизации из воды. Водный раствор буры благодаря гидролизу имеет щелочную реакцию среды:
Na2B4O7 + 7H2O ® 4H3BO3 + 2NaОН,
поэтому его можно титровать кислотой: 2NaОН + 2HCl ® 2Н2O + 2NaCl.
Ход титрования:
Навеску буры, взятую на аналитических весах на часовом стекле или в ампуле, соответствующую 15 – 25 мл 0,1 моль/л раствора, количественно переносят в коническую колбу, растворяют в 50 мл теплой дистиллированной воды, охлаждают, добавляют 2 – 3 капли метилового оранжевого и титруют до перехода окраски из желтой в оранжево-розовую. Определение повторяют три раза. Рассчитывают КHCl, усредняют три значения, отличные не более, чем на 0,005:


Расчет кривой титрования:
Указание веществ, существующих в системе в тот или иной момент титрования:
До начала титрования – V(KOH)=100% V(HCl)=0%
До ТЭ:
V(KOH)=100% V(HCl)=50%
V(KOH)=100% V(HCl)=99%
V(KOH)=100% V(HCl)=99,9%
В ТЭ – V(КОН)=100 % V(HCl)=100%
После ТЭ
V(KOH)=100% V(HCl)=100,1%
V(KOH)=100% V(HCl)=101%
V(KOH)=100% V(HCl)=110%
Представление формул для расчета:
До начала титрования: pОH= - lg C0
До ТЭ: pОH=  =
= 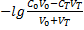 =
= 
В ТЭ: pH=pOH=  =7,0
=7,0
После ТЭ: pОH=  =
=  =
= 
При условии С0=СТ
Кривая титрования:
Расчёты для построения кривой титрования 0,10 М HCl 0,10 М раствором NaOH
 , мл , мл
| f | Формула для расчёта рН | рН |

| 1,00 | ||
| 50,0 | 0,500 | 
| 1,48 |
| 90,0 | 0,900 | аналогично | 2,28 |
| 99,0 | 0,990 | аналогично | 3,30 |
| 99,9 | 0,999 | аналогично | 4,30 |
| 100,0 | 1,000 | 
| 7,00 |
| 100,1 | 1,001 | 
| 9,70 |
| 101,0 | 1,010 | аналогично | 10,7 |
| 110,0 | 1,100 | аналогично | 11,7 |
| 150,0 | 1,500 | аналогично | 12,3 |

Рис. 13.1. Кривые титрования 0,10 М NaOH 0,10 M раствором HCl (1) и 0,10 M HCl 0,10 M раствором NaOH (2)
Представление возможных индикаторов с указанием структурных формул
| Индикатор | Структурная формула | рТ | Интервал перехода рН и окраска индикатора |
| Метиловый оранжевый | 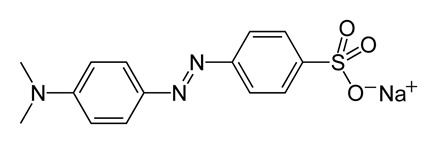
| 4,0 | 3,1–4,4 Красная – оранжево-желтая |
| Бромтимоловый синий | 
| 7,0 | 6,0–7,6 Желтая – синяя |
| Фенолфталеин | 
| 9,0 | 8,2–10 Бесцветная – фиолетовая |
Представление погрешностей титрования с тем или иным выбранным индикатором
Индикаторные погрешности – это погрешности обусловленные несоответствием между показателем индикатора и рН в точке эквивалентности.
«+»ошибка – избыток титранта. «-» ошибка – избыток титруемого вещества.
Индикаторные погрешности:
Водородная (гидроксониевая)
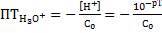 (без учета разбавления)
(без учета разбавления)
 (с разбавлением)
(с разбавлением)
Гидроксильная ошибка
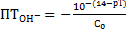 (без учета разбавления)
(без учета разбавления)
 (с разбавлением)
(с разбавлением)
Кислотная или НА-ошибка


Основная или В-ошибка

Дата добавления: 2016-01-05; просмотров: 183; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
