Йодометрическое определение нитрит-ионов, глюкозы, сульфитов. Основные реакции метода йодометрии. Приготовление и стандартизация рабочих растворов.
Определения нитрит-ионов: Нитрит-ионы напрямую с йодидом калия взаимодействуют медленно и недостаточно стехиометрично.
2NaNO2 + 2KI + 2H2SO4 = Na2SO4 + I2+ 2NO + K2SO4 + 2H2O
2NO2- + 2I- + 4H+ = I2+ 2NO + 2H2O
Поэтому определение проводят с использованием многостадийного процесса.
Реакции:
1)Сначала к задаче содержащей нитрит-ион приливают точно известный объём KMnO4, взятый в избытке:
2KMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
2MnO4- + 5NO2- + 6H+= 2Mn2+ + 5NO3-+ 3H2O
2) Затем избыток KMnO4 взаимодействует с KI:
2KMnO4 + 10KI + 8H2SO4 = 2MnSO4 + 5I2 + 6K2SO4 + 8H2O
2MnO4- + 10I- + 16H+= 2Mn2+ 5I2 + 8H2O
3)Выделившийся йод оттитровывают туосульфатом натрия:
I2+2Na2S2O3 = 2NaI+ Na2S4O6
Ход анализа и его условия:
Анализируемый раствор помещают в колбу на 100,0 мл, разбавляют дистиллированной водой до метки, перемешивают. В коническую колбу отбирают пипеткой 25 мл стандартного раствора KMnO4, прибавляют 5 мл H2SO4, вводят пипеткой 20 мл исследуемого раствора и выдерживают 2-3 минуты, затем прибавляют 10 мл 10%-го раствора KI, и еще выдерживают в темном месте 10 мин и титруют раствором Na2S2O3 до соломенно - желтой окраски, приливают раствор крахмала и титруют до обесцвечивания.
Индикатор: крахмал. Переходы окрасок: грязновато-красный (коричневый) - соломенно-желтый - синие-фиолетовый - обесцвеченный.
Формула для расчета массового содержания нитрита натрия:
W%= 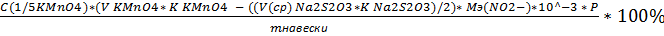
Определения глюкозы: Методика основана на восстановлении сахарами меди 2 до меди 1 из тартратного комплекса.
Реакции
1) Соль меди и тартрат калия берут в 2-3-х кратном избытке по отношению к глюкозе.
|
|
|
С6H12O6 + 2K2Cu(C4H4O6)2 + 5KOH= C6H11O7+ Cu2O+ 4K2C4H4O6+3H2O
2) После реакции избыток ионов меди восстанавливают йодидом в кислой среде.
2Cu2+ +5I- = 2CuI +[I3-]
1) Выделившийся йод титруют туосульфатом натрия:
I2+2Na2S2O3 = 2NaI+ Na2S4O6
Ход анализа и его условия:
Пипеткой отбирают 10 мл задачи в колбу для титрования, из бюретки добавляют 10 мл раствора сульфата меди, пипеткой вводят 3,0 мл тартрата калия и перемешивают. Образовавшийся темно-синий раствор подогревают на плитке, при этом выделяется желтый осадок, переходящий в красный. Раствор охлаждают под струей воды, добавляют 20 мл раствора йодида калия и 10 мл серной кислоты.Титруют раствором тиосульфата натрия до бледно-желтой окраски.Добавляют йод и продолжают титровать до исчезновения синей окраски.
Аналогично проводят контрольный опыт. Для этго из бюретки в колбу для титрования наливают 10 мл сульфата меди, пипеткой вводят раствор 3.0 раствора тартрата калия, 20 мл раствора йодида калия и 10 мл серной кислоты. Полученный раствор титруют до бледно-желтой окраски, затем вводят 305 капель раствора крахмала и титруют до обесцвечивания раствор.
Индикатор: крахмал. Переходы окрасок: соломенно-желтый - синие-фиолетовый - обесцвеченный.
|
|
|
Формула:
W% = 
Дата добавления: 2016-01-05; просмотров: 80; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
