Кері транскриптаза
Кері транскриптаза ДНҚ тізбегіне комплементарлы мРНҚ транскрипциясына пайдаланылады. Геномы бір-тізбекті РНҚ молекулаларынан тұратын ретровирустарды зерттеу кезінде жасушаішілік даму процесінде ретровирус геномының қос тізбекті ДНҚ түрінде жасуша қожайын хромосомасына интеграциялану стадиясынан өтетіндігі анықталды. 1964 жылы Темин аналық РНҚ негізінде комплементарлы ДНҚ синтездеуге қабілетті , вирус арнайылық қасиетке ие ферменттер туралы гипотезаны ұсынды. Осы ферментті бөліп алуға арналған жұмыстар сәтті аяқталды, 1970 жылы Темин мен Мизутани, және олардан тәуелсіз Балтимор Рауса саркома вирусы вирионының жасушадан тыс препараттарынан қажетті ферментті ашты. Бұл РНҚ-тәуелді ДНҚ-полимераза кері транскриптаза, немесе ревертаза деп аталды.
Ең егжей-тегжейлі зерттелген -құстар ретровирусының ревертазасы. Әрбір вирионда осы ферменттің, шамамен, 50 молекуласы бар. Кері транскриптаза екі суббірліктерден тұрады - a (65 кДа) және b (95 кДа), эквимолярлы мөлшерде болатын. Кері транскриптаза кем дегенде үш ферменттік активтілікке ие:
1) ДНҚ полимеразалық, аналық ретінде РНҚ ны және ДНҚны да пайдаланатын;
2) H РНКазалық активтілік, РНК-ДНК гибриді ішіндегі РНҚ-ны гидролиздейтін, бірақ бір немесе екі тізбекті РНҚ-ны емес;
|
|
|
3) ДНК эндонуклеазалық активтілік.
Алғашқы екі активтілік вирустық ДНҚ синтезіне керек,ал эндонуклеаза вирустық ДНҚ-ның қожайын жасушасы геномына интеграциялануына маңызды болуы мүмкін. Тазартылған кері транскриптаза ДНҚ-ны аналық РНҚ негізінде де және аналық ДНҚ негізінде де синтездейді. Синтезтеуді бастау үшін ревертазаға, басқа да полимеразалар секілді,қысқа қос тізбекті бөлік (праймер) қажет. Праймер ретінде процесс кезінде жаңа түзілген тізбекпен ковалентті байланысатын бір тізбекті РНҚ немесе ДНҚ сегменттері қолданыла алады.
Кері транскриптазаны мүмкіндігінше аналық РНҚ-ның комплементарлы ДНҚ-ға(кДНҚ) транскрипциясы үшін пайдаланады. Кері транскрипция реакциясын рнказалық активтілікті тежейтін ингибиторларды қолдана отырып,арнайы таңдалған жағдайда жүргізеді. Осылайша, мақсатты РНҚ молекулаларының толық көлемді ДНҚ- көшірмелерін алуға болады. поли (A) –құрамды аРНҚ кері транскриптазасы кезінде праймер ретінде олиго (dT), ал З'-поли (А) соңы жоқ РНҚ молекуларына зерттеліп отқан РНҚ-ның 3'- соңына комплементарлы, химиялық синтезделген олигонуклеотидтер пайдаланады. аРНҚ негізінде комплементарлы ДНҚ тізбегін синтездеп және РНҚ-ны ыдыратқан соң (әдетте сілтілік өңдеу пайдаланылады), ДНҚ-ның екінші тізбегінің синтезін жүзеге асырады. Ревертазалардың бір тізбекті кДНҚ-ның 3 'соңында өз-өзіне комплементарлы, праймер қызметін жүзеге асыра алатын шпилькалар түзе алу қабілеті қолданылады.
|
|
|
Матрица болып кДНҚ-ның бірінші тізбегі қызмет атқарады. Бұл реакцияны ревертаза немесе E.coli ДНҚ-полимераза I ферменті де жүргізуі мүмкін. Осы екі ферменттің қосындысы арқылы толық қос тізбекті кДНҚ молекулалардың пайда болу санын арттыруға болатыны көрсетілген. Синтез аяқталған соң кДНҚның бірінші және екінші тізбектері, екінші тізбекті синтездеу кезінде праймер ретінде қызмет атқарған шпилька ілгекпен ковалентті байланысқан болып қала береді. Бұл ілгекті арнайы біртізбекті нуклеин қышқылдары бөліктерін жоятын эндонуклеаза S1 арқылы ыдыратады. Пайда болған ұштары әрқашан тік бола бермейді, және клондау тиімділігін арттыру үшін оларды әрі қарай E.coli ДНҚ-полимераза I Кленова фрагменті көмегімен тік ұш алу мақсатында жөндейді. Алынған қостізбекті кДНҚ-ны клондаушы векторларға енгізуге, гибридті ДНК молекулалары құрамында көбейтуге және одан әрі зерттеулер үшін пайдалануға болады.
|
|
|
Лигазалар
1961 жылы Мезельсон мен Вейгл I фагы негізінде рекомбинация ажыраудан және ДНҚ молекулаларының қайта қосылуынан тұратынын көрсетті. Бұл ДНҚ фрагменттерін тігуге қатысатын ферментті іздеуге бастама болды. 1967 жылы осындай ферменттер табылды және ДНК лигаза деп аталды. Ол екі тізбекті нуклеин қышқылы молекуласында фосфодиэфирлі байланыстың синтезін катализдейді.
Басқаша айтқанда, ДНҚ лигазалар қант қалдықтары арасында байланыс түзе отырып, қатар орналасқан нуклеотидтерді тігеді. ДНҚ лигазалар ДНҚ репарация процестерінде, ДНҚ репликация процестеріне - ДНК тізбегінің екі еселенуіне өте қажет.
ДНҚ лигазаның екі түрі бар , олар кофакторға қажеттілігі және әсер ету әдісі бойынша ерекшеленеді. E.coli ДНҚ лигазасы кофактор ретінде дифосфопиридиннуклеотидті, ал T4 фагы лигазасы Мg2 + бар ортада АТФ пайдаланады. T4 фалы лигазасы әмбебап, ол жабысқақ ұштарды тігумен қоса, қостізбекті ДНҚ фрагменттерін тік ұштармен қосылу реакциясын катализдейді. Ол жиі пайдаланылады.
|
|
|
3.Молекулалық биология және молекулалық генетика негіздеріне сипаттама беріңіздер
Молекулалық биология – тіршілік құбылыстарының молекулалық негіздері туралы ғылым; генетика, биохимия және биофизика ғылымдарымен тығыз байланысты. Медицина (вирусология, иммунология, онкология, т.б.), а. ш. (жануарлар мен өсімдіктердің тұқым қуалау қасиеттерін белгілі бағытта қадағалай отырып зерттеу) және биотехнология (гендік инженерия, клеткалық инженерия) салаларының теориялық негізі. Негізгі мақсаты – биологиялық ірі молекулалар (ақуыздар, нуклеин қышқылдары) құрылымын барлық деңгейде зерттеу. Өсімдік клеткасындағы информосомалар, яғни, бос цитоплазмалық, полисомды-байланысқан және ядролы ақуыздардың (РНҚ-ны қоса) және төменгі молекулалы РНҚ-ның физика-химиялық қасиеттері зерттеліп, олардың өсімдік эмбриогенезі мен дамуы кезінде белок биосинтезі мен биогенезін реттеуге қатысатыны анықталды. Соның нәтижесінде функционалды белсенді әркелкі (гетерогалды) будан рибосомалары құрастырылды. Бұрын белгісіз болып келген өсімдік клеткаларындағы (қалыпты және стресс жағдайында) зат алмасу процесінің маңызды бөліктеріндегі (азотты, көмір сулы, фенолды) ферментті кешендердің реттелу механизмі ашылды. Бұл техникалық және астық дақылдарының бағалы шаруашылық белгілерін қалыптастыру бағытының ғылыми негізін салуға мүмкіндік берді.. Азот алмасу кезіндегі маңызды ферменті – НАДФ-ГДГ-ны (никотинамидадениндинуклеотидфосфат-глютаматдегидрогенез) активациялаудың жаңа жолы анықталды. Қазақстан өсімдіктерінен жасалынған биологиялық активті заттардың биотехнологиясы жетілдірілді. Қазір республикада молекулалық биология саласы бойынша: геномды құрастыру, экспрессиясы және оның реттелуі, клетканың маңызды полимерлері белок пен нуклеин қышқылының құрылымы мен қызметі, өсімдіктердің гендік инженериясы, молекулалық иммунология мәселелері зерттелуде.
Молекулалық генетика - организмдердің өзгергіштік және тұқым қуалау қасиеттерінің молекулалық негізін зерттейді. Молекулалық генетика XX ғасырдың 40 – 50-жылдарында генетикалық мәселелерді шешуде физика мен химия ғылымдарының жетістіктерін пайдаланудың нәтижесінде пайда болды.Молекулалық генетиканың ең негізгі жетістіктері – геннің химиялық құрылымының анықталуы (1953), организмнің тұқым қуалау ақпаратының
қолдануы мен оны жазылу әдісін талдау, гендік инженерия әдістерін зерттеу болып
табылады. Қазақстанда алғаш рет эукариоттардағы генетиканың тұрақсыздық мәселесі – генетика саласының классикалық объектісі дрозофила (Drоsophіla) шыбынында қарастырылатын жаңа ғылыми бағыт дамыды, яғни молекуллық генетика. Молекула генетика лабораториясында дрозофила шыбынының бірегей коллекциясы құрылып, осы коллекцияның негізінде молекула-генетикалық ғылыми-зерттеу жұмыстары жүргізіледі және жоғары оқу орындарында кеңінен қолданылады.жалпы генетиканың үш ірі тарауы бойынша зерттеу жұмыстарын жүргізеді. Олар мутагенез, даму генетикасы және жалпы цитогенетика. Экологиялық бағыт бойынша зерттеулер де – радиацияның және өндіріс химикаттарының зардаптарын тартқан адамдардың перифериялық қан үлгілері, ДНК молекуласы мен сұйық азотта сақталып жатқан лимфоциттерін қолдана отырып адам организміне антропогендік факторлардың әсерлерін гендік, хромосомалық және популяциялық деңгейлерде зерттеудің кешенді технологиясы жүргізілуде. Drоsophіla melanogaster-ге және адам клеткаларына генетикалық әсерін салыстырмалы талдау әдісін қолданып, тұмау вирусының мутагендік потенциалы зерттелді
4. Рекомбинантты ДНҚ құрылысына сипаттама беріңіз-2суракпен бирге
Генетикалық рекомбинацияның мәні – екі хромосоманың өзара гендерімен алмасуында. Екі немесе одан көп тұкым қуатын анықтауышы бар клетканың немесе организмнің пайда болуына әкеп соғатын кез келген процесті 1958 жылы Понтекорво рекомбинация деп атады. Міндетті түрде сүтқоректілердің жыныс клеткалары пайда болғанда, мейоздың барысында гомологты хромосомалар гендсрімен алмасады (кроссинговер — айқасу кұбылысы). Осы алмасулар ұрпақтарға берілетін тұқым қуатын белгілердің араласуын түсіндіруге мүмкіндік бсреді.
Гендер алмасуын, сондай-ақ клеткаға “бөтен” геиді енгізуді генетикалық рекомбинация арқылы in vitro — организмнен тыс жасауға болады.
5. Метандық ашу процесі мен оның сатылары
Анаэробты ашу (Метандық ашу) – бос метан бөлу арқылы жүретін органикалық заттардың биодеструкциялық процессі. Метандық ашу нәтижесінде бөлінетін биогаз құрамы — 50-80% метан, 20-30% көмірқышқыл газы, шамамен 1% күкіртсутек, сонымен қатар шамалы мөлшердегі басқа газдардан (азот, оттегі, сутегі, аммиак, т.б.) тұрады. Метантүзуші бактериялар органикалық қышқылдарды қажетті метанға, көмірқышқыл газына айналдырады.
Бұл күрделі жүйелену комплексіне микроорнизмдердің мыңдаған түрлері қатысады. Бірақ олардың негізгісі — метантүзуші бактериялар. Метантүзуші бактериялар қышқылтүзуші ашытқы микроорганизмдер мен салыстырғанда көбеюге ұзақ уақыт қажет етеді және қоршаған ортаның өзгерістеріне қарсы тұру потенциялы төмен. Сондықтан, ашу ортасында алғашында ұшқыш қышқылдар түзулуіне байланысты, метандық ашудың бірінші кезеңін қышқылдық деп атайды. Ары қарай қышқылдардың түзілуі және өнделуі жылдамдығы тенеледі. Сондықтан субстрактының ыдырауы мен газ түзіледі бір уақытта қатар жүреді. Газдың түзілу өнімділігі метантүзуші бактериялардың тіршілік жағдайына байланысты.
Биометаногенездің биохимиясы және микробиологиялық сипаттамасы.
Бұл процестің ерекшелігі сол таза культура жағдайында басқа өнім, ал синтрофиялық бірлестік жағдайында басқа өнім алынады. Мысалы, ірі қара мал қарнында Selenomonas ruminantum глюкозалы лактатқа дейін ашытады. Ал синтрофиялық ассоцияцияда Methanobrevibacter ruminantium ацетат, метан және СО2 түзеді.
Егер клетканы термофильді эубактериямен Clostridium thermoccelum бактериясының таза культурасымен ашытса этанол, ацетат, Н2 және СО2 түзіледі. Синтрофты ассоцияцияда Metronobacteruim thermoantotrophicum ацетат, метан СО2 түзіледі.
Сазды балшық газы «болотный газ» деп аталады. Көк түсті жалынмен жанады, иіссіз, түтінсіз жанады. Ал ағаштың, тезектің жануынан қорашаған ортаны ластайтын түтін бөлінеді.
Биохимиялық тұрғыдан метандық «ашыту» анаэробтық тыныс болып табылады. Органикалық заттардың (сірке қышқылы) электрондары көмірқышқыл газына тасымалданып, метанға дейін тотықсызданады. Метантүзуші бактериялар үшін электронның доноры қызметін сутегі атқарады.
4C6H5COOH + 24H2O → CH3COOH + 4HCOOH + 8H2
(бензоат)
12CH3COOH → 12CH4 + 12CO2
(ацетат)
4CHCOOH → 4CO2 + 4H2
3CO2 + 12H2 → 3CH4 + 6H2O
4C6H5COOH + 18H2O → 15CH4 + 13CO2
БактериятүрлеріненMethanobakterium formicicum және Metahanospirillum hungati басымқатысады. Мысалы, Methanobakterium kadomensis st 23-20күнжүретінметаногенезді 8 күндежүргізеді. Іріқарамалдың, үйқұстарыныңкөнініңөнелуіне 20 күдей, алшошқаныңсұйықкөнініңашупроцесіне 10 күндейқажет. Егержылсайынтүзілетінсиырдың 300 млн.ттезегінбиогазғаайналдырса, алынғанэнергиямөлшері 33 млн.т. мұнайданалынатынэнергиямөлшерінетенседі. Яғни , 1тсиыртезегініңқұны 0,11т. мұнайғатен. Іріқарамалжәнешошқакөндерініңтеңмөлшерінен, шошқакөнінен 50%-ғакөпбиогазөндіріледі.
Биомассадағыорганикалыққосылыстар (ақуыздар, көмірсулар, майлар) гидролитикалықферменттерәсеріненқарапайыморганикалыққосылыстарға (аминқышқылдар, қанттар, майқышқылдары) бөлінебастайды. Бұлкезең – гидролиздепаталадыжәнеацетогендібактерияларәсеріменағады. Екіншікезеңдегетерогендібактерияларәсеріненқарапайыморганикалыққосылыстарбөліктерініңгидролиздікқышқылдануыжүредіжәнесоныңнәтижесіндеацетат, еківаленттікөмірқышқылгазыжәнееркінсутегіпайдаболады. Ацетаттаналынғанорганикалыққосылыстары 2 кезеңдеС1 байланысынтүзеді (қарапайыморганикалыққышқылдар). Алынғанқосылыстар 3 кезеңдегіметантудыратынқоректікортаболады. 3 кезеңәртүрлібактериялартобыменалынғанекіпроцесспенағады.
Осыбактериялардыңекітобы 2 кезеңдегіқұнарлықосылыстардыметанғаСН4, суғаН2О, екітотықтыкөміртегінтудырады. Анаэробтықашупроцесібактериальдықбиомассадаболадыжәнекүрделіорганикалыққосылыстардыңконверсиясынқосады – полисахаридтер, майларжәнеақуыздардыметанғаСН4 жәнеекітотықтыкөміртегіСО (4).
Азықтыққажеттілігінебайланыстыбактериялардыүштүргебөледі:
- гидролиздіжәнеацетогенді. Бұлтүрге протеолитикалық, целлюлолитикалық, облигаттыанаэробтар, факультативтіканаэробтаржатады.
- гомоацетатты бактериялар.
6. Метантүзуші бактериялар және олардың табиғатта алатын орны. Метанды бактериялардың топтастырылуы мен оларды дақылдау ерекшеліктері
Метандық ашу нәтижесінде бөлінетін биогаз құрамы — 50-80 % метан, 20-30 % көмірқышқыл газы, шамамен 1 % күкірттісутек, сонымен қатар шамалы мөлшердегі басқа газдардан (азот, оттегі,
сутегі, аммиак, т.б.) тұрады. Метантүзуші бактериялар органикалық қышқылдарды қажетті метанға, көмірқышқыл газына айналдырады. Бұл күрделі жүйелену комплексіне микроорганизмдердің мыңдаған түрлері қатысады. Бірақ олардың негізгісі — метантүзуші бактериялар. Метантүзуші бактериялар, қышқылтүзуші ашытқы микроорганизмдермен салыстырғанда, көбеюге ұзақ уақыт қажет етеді және қоршаған ортаның өзгерістеріне қарсы тұру потенциялы төмен. Сондықтан, ашу ортасында алғашында ұшқыш қышқылдар түзілуіне байланысты, метандық ашудың бірінші кезеңін қышқылдық деп атайды. Ары қарай қышқылдардың түзілуі және өнделуі жылдамдығы тенеледі. Сондықтан субстраттың ыдырауы мен газ түзулуі бір уақытта қатар жүреді. Газдың түзілу өнімділігі метантүзуші бактериялардың тіршілік жағдайына байланысты. Метан бактериялары 0-70ºС аралығында өмір сүруге ыңғайлы. Егер температура жоғарыласа олар өледі, 900 С да өлмейтін кейбір штаммдары бар. Минусты температура болған жағдайда олардың қырылуы байқалмайды, бірақ тіршілік әрекетін тоқтатады. Әдебиеттерде бактериялардың өмір сүру температурасын 3-4ºС белгілейді [3]. Морфологиясы бойынша бұл бактерияларды таяқшатәрізділер (Methanobacterium), кокка тәрізділер (Methanococcus), сарцина тәрізділер (Methanosarcina) және спирилла тәрізділер (Methanospirillum) деп бөлуге болады.
Анаэробты жағдайда органикалық заттар бірнеше шіру этаптарынан өтеді: ацетатқа дейін, С02 және Н2. Метаболизмнің бұл өнімдері метантүзуші бактериялармен қолданылады. Биогаз анаэробты жағдайда, бактериялардың көмегімен органикалық материалдардың ыдырауынан пайда болып, метан мен басқа газдардың қосындысынан құралады да, мынадай пропорцияда болады:
1-кесте. Биогаз құрамы
Газ Химиялық формуласы Көлемі Метан СН4 40 – 70 % Көмірқышқыл газ СО2 30 – 60 % Басқа газдар 1 – 5 % Сутек Н2 0 – 1 % Көмірсутек Н2S 0 – 3 %
Сонымен қатар, оған айтарлықтай дәрежеде қоршаған орта да әсер етеді. Бөлінетін газдың айтарлықтай көлемі температураға байланысты: жылу көп болса, органикалық шикізат ферментациясының дәрежесі және жылдамдығы жоғары болады. Нақ осы себепті алғаш биогаз алу қондырғылары жылы климатты елдерде пайда бастады. Жылу оқшаулағыштарды, сонымен қатар кейде ысытылған суды қолдану, қыс кезінде температурасы 20ºС–ге дейін төмендейтін аудандарда биогаз генераторларының құрылысын меңгеруге мүмкіндік береді. Биохимиялық тұрғыдан метандық «ашыту» анаэробтық тыныс болып табылады. Органикалық заттардың (сірке қышқылы) электрондары көмірқышқыл газына тасымалданып, метанға дейін тотықсызданады. Метантүзуші бактериялар үшін электронның доноры қызметін
сутегі атқарады. Бактерия түрлерінен Methanobakterium formicicum және Metahanospirillum hungati басым қатысады. Мысалы, Methanobakterium kadomensis st 23-20 күн жүретін метаногенезді 8 күнде жүргізеді. Микробиология: органикалық қалдықтардан биогазды алу ол анаэробты, яғни оттексіз жағдайда ыдырағанда қалдықтың биогаз бөлу қасиетіне негізделген. Бұл процесс метанды ашу деп аталады және үш кезеңнен тұратын органикалық заттардың ыдырауы екі негізгі қышқылды және метанды микроағзалар топтарымен жүреді. Биогаз өндірісінің процесі үш сатыға бөлінеді: гидролиз, тотығу және метанның пайда болуы. Бұл күрделі айналу кешеніне көптеген микроағзалар қатысады, соның негізгілері болып – метантүзуші бактериялар, олардың үш түрі 1-суретте көрсетілген. Гидролиз. Бірінші этапта (гидролиз) органикалық зат сырттай клеткадан тыс микроағза ферменттерімен (клечатка, амилаза, протеаза және липаза), бактериялар көмірсутектің күрделі әрі ұзын шынжырын ажыратады, протеиндер мен липидтер – оданда қысқа шынжырларға айналдырады. Ашу. Биогаздың пайда болуының екінші кезеңіне қатысатын қышқыл өндіруші бактериялар күрделі органикалық қосылыстарды (клечатка, ақуыз, май т.б.) жәй заттарға дейін ыдыратады. Бұл кезде ашытылатын ортаға ашудың бірінші реттік өнімдері – ұшқыш май қышқылдары,төменгі спирттер, сутек, көміртек тотығы, сіркесу және құмырсқа қышқылдары пайда болады. Бұл органикалық заттар органикалық қышқылдарды биогазға айналдыратын метантүзуші бактериялардың қорек көзі болып табылады. Метанның түзілуі. Үшінші этаптағы метантүзуші бактериялар құрылымдары төменгі молекулалық салмақпен ыдыратады. Қалыпты жағдайда метантүзуші бактериялар анаэробты жағдайда тіршілік етеді, мысалы: су астында батпақтарда олар қоршаған ортаның өзгеруіне өте сезімтал, сондықтан метантүзуші бактериялардың өміршеңдігі үшін жасалған жағдайларға газдың бөліну қарқындығы тәуелді. Бактерия симбиозы (селбесу. Метан және қықшқыл түзуші бактериялар бір-бірімен симбиозда қарым-қатынас жасайды. Бір жағынан, қышқыл түзуші бактериялар метантүзуші бактериялар үшін тамаша параметрлері бар атмосфераны жасайды (анаэробты жағдай, төмен молекулалы салмағы бар химиялық құрылымдар), екінші жағынан, метантүзуші микроағзалар қышқыл түзуші бактериялардың арасындағы қосылыстарды пайдаланады. Егер мұндай қарым- қатынас жүрмесе реактордың ішінде екі микроағзаның өміршеңдігі үшін қолайсыз жағдайлар артатын еді. Биогаз алу үшін тағам қалдықтарынан басқа өсімдік және шаруашылық қалдықтарын, қи, ағын суларды т.б. қолдануға болады. Ферментация үрдісі кезінде резервуардағы сұйықтық үш фракцияға бөлінеді. Жоғары бөлігі – үлкен бөлшектерден құралған, біраз уақыттан кейін қатайып биогаздың бөлінуіне кедергі жасайды. Ферментатордың орталық бөлігіне сұйықтық жиналады, ал лас тәрізді фракция төменгі бөлігіне тұнбаға түседі.
7. ДНҚ-ның нуклеотидтік реттілігін анықтаудың (секвенирлеудің ) мағынасын түсіндіріңіз25ответпен бирге
8. Рестриктазалардың жіктелуіне, номенклатурасы мен сипаттамасына түсініктеме беріңіз
Рестрикциялау — модификациялау құбылысы 50-ші жылдары байқалған болатын. Рестрикция тоқтату деген мағынаны білдіреді, ал модификация — молекуланың белгілі топтарын химиялық жолмен немесе оларға баска топтарды жалғау арқылы өзгерту. Рестрикция мен модификациялау құпиясын В. Арбер ашты.
Бактерияның “өзінің” нуклеин кышқылын “бөтен” фагтардың (вирустардың) нуклеин қышқылынан ажырататын арнайы ферменттері болады. Рестрикция ферменттері фагтың нуклеин қышқылын үзіп, оның клеткада көбеюіне жол бермейді. Рестриктазалармен қатар бактерияларда метилаза деген фермент бар. Ол бактерияның өзінің ДНҚ тізбегіндегі азоттық негіздерге белгілі мөлшерде әрбір репликациядан кейін метил тобын (СН3) жалғап, модификациялап отырады. Метилденген ДНҚ-ны рестриктаза “өзінікі” санап оған “тиіспейді”. Бұл бактериялардағы өзіндік бір “иммундык жүйе” іспеттес. Дегенмен, кейде бактерия клеткасына енген фагтың кейбір нуклеин қышқылы кездейсоқ метилденіп кетеді. Осы қателігінен бактерияның өзі фагтың әсерінен қырылып калады. Осы құбылысты О. Смит, Д. Натанс және В. Арбер ашты. Рестриктазалар табиғаттың ген инженериясына арнап жасаған таптырмас құралы. Бактерия әр түрлі болғандықтан олардың рестриктазалары ДНҚ-ны әртүрлі жолмен үзеді.[Қазір 500-ден аса рестриктаза түрі белгілі және олар ДНҚ-ны бір-бірінен өзгеше 120 жерінен үзе алады. Яғни зерттеуші рестриктазаны тандай отырып ДНҚ-дан қалаған ферментті нсмесе генді бүлдірмей бүтін күйінде кесіп алады.
Генді бөліп алу мен ген өркенін (клондарын) алу үшін әртүрлі объектілер (бактериялардан, сүтқоректілер клеткаларынан, құстардан т. б. алынған) және әртүрлі вирустар жұқтырылган ортада өсірілетін ерекше ферменттер құрал ретінде пайдаланылады. Негізіндс олар үш түрлі ферменттер: рестриктазалар, лигаза жәис кері транскриптаза.
Рестриктазалар – дезоксирибонуклеазалардың ДНҚ молекуласын қысқа немесе ұзын болшектерге тіпті жеке нуклеотидтерге дейін кесетін ферменттердің бір түрі. Рестриктазалардың ерскшеліктері ДНҚ молекуласын кез кслген жерден кеспей тек белгілі нуклеотидтер арасынан кесуінде. Әрбір рестриктазаның тандайтын нуклеотидтср орналасу тәртібі бар. Бұл әдетте 4-6 жұп нуклеотидтер, әртүрлі рестриктазалар үзетін жеріндегі нуклеотидтердің құрамында айырмашылығы болады. Мысалы Е. соІі рестриктазасы ДНҚ молекуласын ГААТТЦ учаскесіндс үзеді, Ват -НІ-ГГАТЦЦ учаскесінде. Қазір әр түрлі рестрикта-залардың жүзден артық өзіндік бірізділігі белгілі.
ДНК тізбегінің ұзына бойында нуклеотидтер кездейсоқ орналасса, теөт белгілі нуклеотидтен тұратын жүйелілік (бірізділік) 1/256-ға, ал алты нуклеотидтен – 1/4096 тең болады. Сондықтан рестриктазалар ДНК-ны бірнеше жүздеген немесе мындаған нуклеотидтер жұптарынан түратын бөлшектерге үзеді,
Лигаза– ДНҚ-ның бос ұштарын бір-біріне жалғайтын фермент. Бұл фермент қалыпты клеткаларда ДНҚ синтезіне және репарация (қалпына келу) процестеріне қатысады, яғни ДНҚ молекуласының біраз бүлінген жерлерін қалпына келтіруге қатысады.
Кері транскриптаза– ДНҚ-полимераза тәріздес фермент. Бірақ ДНҚ-ны ДНҚ-дан емес РНҚ-дан синтездейді. РНҚ-полимеразамен салыстырғанда ол кері бағытта жүмыс істейді, яғни ДНҚ-дан РНҚ-ға емес, РНҚ-дан ДНҚ-ға. Кері транскриптаза ферментінің қалыпты сау клеткалары бар ма, және оларда ДНҚ синтезі РНҚ-да жүре ме? Бұл күмәнді сүрақ әлі толық шешілмеген. Алайда бұл фермент, эукариоттар клеткаларында оларға ДНҚ арқылы көбейетін РНҚ-сы бар вирустарды жұқтырғаннан кейін пайда болады. Бұл вирустардың геномы кері транскриптазаны кодтайды, соның көмегімен ви-рустың ДНҚ-үлгісі құрылады да, кейін вирустар молекулала-ының РНҚ-сы синтезделеді.
9. Ферменттердің иммобилизациялау әдістеріне сипаттама беріп, оларды салыстырыңыздар жок
10. ДНҚ клондау әдістері мен полимеразды тізбекті реакция процесін түсіндіріңіздер
ДНҚ-ны клондау әдістері
ДНҚ пробиркаға бекінгеннен кейін оны көбейту керек.
ДНҚ-ны клондаудың екі тәсілі бар. Бірінші тәсіл оларға енгізілген бөгде ДНҚ-ны көбейтуге бактериялық немесе ашытқы жасушаларын пайдалануды көздейді. Екінші әдісте ДНҚ амплификациясы in vitro жүреді.
ДНҚ клондау in vivo жағдайында
Микроорганизмдерді пайдалана отырып, ДНҚ кітапханаларының екі түрін жасауға болады: геномдық және клондық (кДНК) .
Геномдық кітапхана. Егер белгілі бір ағза геномын кесіп, плазмиданың немесе вирустың векторына салып және жасушаға енгізетін болса, онда осындай түрде оны сақтауға болады.Плазмида немесе фаг ДНҚ-сын кескенде геномның барлық және өзгеріссіз бөліктерінің түсіп қалу ықтималдығы өте жоғары болып келеді.
Геномдық кітапхананы өндірудің бұл әдісі «бытыралы мылтық әдісі» деп аталады, себебі бұл жағдайда геном жеке фрагменттер ретінде ұсынылған.
Плазмида және вирус векторларын құру принциптері ортақ, сондықтан оны плазмиданың мысалында қарастырамыз. Вирустық ДНҚ-дан фаг ДНҚ-сын пайдаланған жөн, өйткені олардың сыйымдылығы үлкен және геномның үлкен бөліктерін қоюға мүмкіндік береді.
Тазартылған сақиналы ДНҚ молекулаларын сызықтық ДНҚ алу үшін рестриктаза ферменттерімен өңдейді. Жасушалық ДНҚ-ны да тура сол рестриктаза ферментімен өңдейді, плазмидті ДНҚ-ға қосып, лигаза қосады. Осылайша бактериялық немесе ашытқы жасушаларына енгізілетін рекомбинантты плазмидалық ДНҚ алады. Плазмида көптеген көшірмелер қалыптастыра отырып репликацияланады. Көптеген плазмидалар антибиотикке төзімді генге ие және рекомбинантты плазмидада осындай ген бар болса, жасушаны антибиотик бар ортада өсіру арқылы оңай анықтауға болады.
Әрбір осындай колония клон немесе бір жасуша ұрпақтары болып табылады. Бір колония плазмидалары геномдық ДНҚ клонын құрайды, ал плазмидалар жиынтығын геномдық ДНҚ кітапханасы деп атауға болады. Бұл әдістің кемшілігі ДНҚ фрагменттері көп мөлшерде өндіріледі. Геномдық ДНҚ-ны кесу кездейсоқ анықталады, сол себепті фрагменттердің бір бөліктері ғана толық гендерге ие. Кейбір фрагменттердің геннің бөлігін немесе интронды реттілікті ғана қамтуы мүмкін.
кДНК кітапханасы. кДНҚ құрастыру кері транскриптазаның көмегімен аналық РНҚда комплементарлы ДНҚ тізбегін синтездеуден басталады. Содан кейін сілтілік орта жасап, РНҚ тізбегін нуклеотидтерге ыдыратады, ары қарай ДНҚ-полимеразаны пайдаланып комплементарлы ДНҚ тізбегін синтездейді. Бұл жағдайда тік ұшты ДНҚ фрагменті қалыптасады. Мұндай ДНҚны плазмидаларға орналастырып, бактерия жасушаларына енгізеді. Амплификация нәтижесінде плазмидалар клонның комплементарлы ДНҚ көшірмелерін (кДНК) түзеді.
Клондық ДНҚ-ның геномдық ДНҚ клондарынан артықшылығы геннің ақуыз кодтайтын нуклеотидтік тізбегі үздіксіз. Эукариот гендерінде транскриптық РНҚдан аналыққа ауысар алдында алынып тасталатын интрондар бар, кейін сплайсинг жүреді. Бактерия жасушалары эукариот жасуша гендерінің транскрипциясы жолымен түзілетін РНҚ-ның мұндай модификациясын жүргізе алмайды.Сондықтан, клондалған геннің экспрессиясы арқылы ақуыз алу жолын көздесе,онда ақпараттық РНҚ негізінде дайындалған кДНҚ банкін пайдаланған жөн.
Полимеразды тізбекті реакция
1985 жылы К. Мюллис қызметкерлерімен полимеразды тізбекті реакция (ПТР) деп аталатын in vitroда ДНҚ тізбегін клондау әдісін ұсынған.
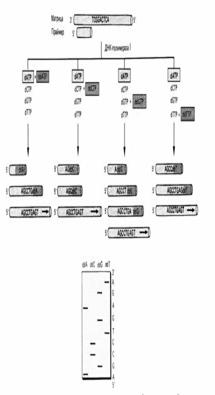
Тексерілетін ДНҚ үлгісіне ұзындығы шамамен 20 нуклеотид болатын екі синтетикалық олигонуклеотидтер -праймерлер қосады. Олардың әрқайсысы ДНҚ фрагментінің 3'-соңының біріне комплементарлы. ДНҚ-ны қос спираль тізбектерін бөлу үшін қыздырады, ал суытқан кезде комплементарлы ДНҚ фрагменттерінің праймерлермен гибридизациясы пайда болады. Нәтижесінде алынған ерітіндіде қостізбекті қысқа бөліктері - астар (праймер) бар біртізбекті ДНҚ болады. Нуклеотидтер мен ДНҚ полимеразаны қосқанда, комплементарлы тізбектер түзіледі және ДНҚ фрагменттері қалыптасады (алғашқы циклі, сур. 43). Реакция тоқтатылады және ДНҚ жылыту арқылы тағы денатурацияланады.
Сур. 43. Полимеразды тізбекті реакция бірінші циклі
Салқындату барысында артық праймерлер қайтадан бастапқы ДНҚ тізбектерімен және сондай-ақ, жаңадан синтезделген ДНҚ тізбектерімен тиімді бірігеді. Жүйеге ДНҚ-полимераза қосу полимеразды реакцияның екінші циклына бастама береді. Бұл үрдістің бірнеше рет қайталануы праймердің ферментативтік ұзаруының 30 немесе одан да көп циклын жүргізуге мүмкіндік береді. Бұл жағдайда екі шетінде пайдаланып отырған праймерлермен шектелген ДНҚ сегменттерінің саны ПТР әрбір циклінде экспоненциальды (2n қатынасына байланысты, мұнда N- циклдардың саны) өседі. Барлық басқа реакция өнімдерінін шығуы сызықтық арақатынас бойынша (сур. 44) артады. Осылайша, осы реакция процесінде праймерлермен шектелген ДНҚ тізбегі ғана тиімді амплификацияланады.
Алғашқы кезде ПТР үшін E.сoli ДНҚ-полимераза I Кленова фрагменті пайдаланылды. Алайда, бұл тәсілдің кемшілігі әрбір реакция циклынан кейін реакциялық қоспаға ферменттің жаңа бөлігін енгізу қажеттігі болды. Сонымен қоса, мұндай полимеразды реакцияның оңтайлы температуралық жағдайларында (37 ° C) праймердің екінші реттік байланысу аймақтары пайда болды және күтпеген геном сегменттерінің амплификациялануы бақыланды, яғни амплификация арнайылығы толық болмады. Полимеразды тізбекті реакцияның айтарлықтай жақсаруына Кленова фрагментін Thermus aquaticus термофильді бактериясы ДНҚ-полимеразасына (Taq-полимераза) ауыстырылғаннан кейін қол жеткізілді. Taq-полимеразаға бағытталған реакцияның оңтайлы температурасы шамамен 70 ° С. Тағы бір маңызды ерекшелігі берілген полимеразаның 95 ° С температурада ұзақ инкубациялаудан кейін белсенділігі жойылмайды.
Taq-полимераза пайдалану арқылы бірден екі мәселе шешілді. Біріншіден, термостабильді полимераза ДНҚ денатурациясы этапында белсенділігін жоғалтпайды, сондықтан әрбір реакция циклынан кейін ферменттің жаңа бөлігін қосудың қажеттілігі жоқ. Бұл ПТР жүргізуді автоматтандыруға мүмкіндік берді, себебі енді үлгілерді қажет тәртіппен белгілі бір уақыт аралығында әр түрлі температуралық жағдайларға ауыстыру ғана қалды: 90-95 ° C (денатурация температурасы) және 60-70 ° C (ДНҚ ренатурация және ферменттативті реакция температурасы). Екіншіден, Taq-полимераза катализдейтін реакцияның жоғары температуралық оңтайлығы зерттеліп отырған геномның тек берілген аймағында праймерлер будандасуын қамтамасыз ететін қатаң температура жағдайын таңдауға мүмкіндік береді, яғни, айтарлықтай, әдістің арнайылығы мен сезімталдығын арттырады. 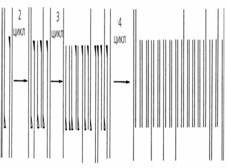
Сур. 44. Полимеразды тізбекті реакция схемасы
ПТР әдісін пайдалана отырып, in vitroда селективті жағдайда ДНҚ препаратын млн немесе одан да көп рет белгілі реттілікке ие фрагментпен байытуға болады. Бұл адам геномы сияқты ірі және күрделі геномдарда біркөшірмелі гендер мен олардың нұсқаларын анықтауға сенімді мүмкіндік береді. Әдістің сезімталдығы ПТР-де амлификация жасап, мақсатты реттілікті анықтау үшін ол 105 жасушадан тұратын үлгідегі бір рет кездесетін жағдайда да табуы мүмкін. Алынған ДНҚ сегменті ДНҚ молекулаларын электрофорездік бөлгеннен және бромисті этидимен бояғаннан кейін дискретті жолақтар түрінде анық анықталады. Егер праймерге фермент тігіп қойса, онда амплификация кезінде ферменттік белгі жиналады. Амплификация өнімі ИФА арқылы тексеріледі, яғни субстрат беріліп, түстің өзгеруі күтіледі. Белгі ретінде стрептавидин пайдаланылуға болады (3-тармақты қараңыз). Оны праймерлерге де немесе нуклеотидтерге де тігуге болады. Соңғы жағдайда, стрептавидинмен белгіленген нуклеотидтер комплементарлы ДНҚ тізбегі синтездеуге қажет қалыпты нуклеотидтерге қосылады. Бұл да сигналдарды үлкен күшейтуге алып барады.
in vitro көбейтілген фрагмент оны тікелей секвенирлеуге жеткілікті мөлшерде алынады. Бұл жағдайда молекулалық векторларда ДНҚ фрагменттерін клондаудың аралық этапы талап етілмейді, ПТР кейде жасушасыз молекулалық клондау (cell-free molecular cloning) деп аталады. 30 немесе одан да көп циклдардан тұратын автоматтандырылған Taq-полимеразды тізбекті реакция процедурасына 3-4 сағат кетеді, ДНҚ белгілі фрагментін векторлық молекулалар құрамында клондау процедурасына қарағанда, айтарлықтай, тезірек және қарапайым.
11. ДНҚ реакциясына (екі еселену процесіне) және оның энзимологиясына толықтай сипаттама беріңіздер
ДНҚ репликациясының екі еселену процесін репликация деп атайды. Репликация бірлігі –репликон, өздігінен репликацияланатын генетикалық элемент. Оның құрамында ДНҚ репликациясының инициациалық учаскесі және реплыкация процесіне қатынасатын блоктардың синтезңн бақылайтын гендер орналасқан. Репликация аса күрделе биохимиялық процес. Бұл процеске генетикалық ақпараттың өте дәлдікпен көшірілуін, ДНҚ тізбектеріндегі қателіктерді түзетіп, алмастыруды және рекомбинацияны қаитамасыз ететін көптеген белоктар қатысады.
Репликация процесі мына принциптер бойынша іске асырылады;
- Жартылай консервативті ДНҚ ның бастапқы тәзбектерінің әр қайсысы жаңа тізбек түзілуі үшін матрица болып табылады. Реплиациядан кейінгі әр ДНҚ молекуласындағы екі тізбектің біреуі бастапқы матрицалық тізбек болса, екіншісі жаңадан синтзделген тізбек болады.
- Комплементарлық ДНҚ молекуласының жаңа тізбегі комплементарлық принципке негізделіп адениннңғ тиминмен, гуаниннің цитозинмен байланысуына сай түзіледі. Сондықтан жаңадан синтезделген тіхбек бастапұы матрицалық тңзбеке комплнментарлы болып келеді.
- Униполярлығы комплементарлы жаңа тізбектердің синтезделуі тек 5!-3! Бағытында іске асырылады, яғни әрдайым ДНҚ молекуласының 3!ұшы ұзарып отырады.
- Анти парллельдік ДНҚ ның жаңа тізбектері матрицалық тізбектерге қарама қарсы бағытта синтезделеді. өйткені бастапқы ДНҚ дағы аппараттың оқылуы ДНҚ полимераза ферментінің қатысуымен 3!-5! Бағытында ңана жүреді.
- Үзілмелігі репликация ДНҚ молекуласының бірнеше жерінде бір уақытта басталады. Синтезделген түрлі ұзындықтағы кесінділер арнайы лигаза ферменттерінің көмегінмен бір біріне жалғанып ДНҚ молекуласының тғтас тізбегін құрайды. ДНҚ ның бойындағы репликация жүріп жатқан учаскені айрықша шеңбер пішіндес «репликациялық көзше» арқылы тауып,тануға болады. Көзшенің мұндай пішіні ДНҚ репликациясының шеңберлік тәсілмен жүретінін сипаттайды.
Прокариоттық жасушаларда тек бір ғана репликациялық көзше қызмет атқарса, эукариоттарда ДНҚ молекуласының мөлшеріне байланысты жүздеген, мыңдаған репликациялық көзшелер қызмет етуі мүмкін. Репликациялық көзше тек арнайы нуклеотиттер жүйесі орналасқан учаскелерде ғана түзіледі. Ұзындығы 300 нуклеотитке шамалас келетін мұндай учаскелер репликация басталатын нүкте немесе «О» сайты ( ағыл. origin) деп аталады. ДНҚ дағы жалпы репликациялық учаскелердің саны ағзаның генетикелық бағдарламасының мөлшерңмен анықталады.
ДНҚ ның ширатылңан тізбектері таратылып репликация басталатын учаске репликациялық айыр деп аталатын арнайы құрылым түзіледі. Репликация кезінде ДНҚ синтезделуі бағытының қос тізбектің тарқатылу бағытымен сәйкес келуі тек жаңа синтезделген бастаушы тңзбекте көрінеді. Екінші артта алған тізбек үзік үзік болып, қысқа Оказаки ферменттері түрінде синтезделеді. Нәтижесінде тізбектердің екеуі 5!-3! Бағытта ұзарады.
Прокариоттық және эукариоттық жасушаларда ДНҚ мен әсерлесе алатын ядролық ферменттердің үш типі анықталған. Олар; нуклеазалар, полимеразалар және лигазалар.
- Нуклеазалар ДНҚ молекуласының 3! Немесе 5! Ұшына әсер ете отырып полинуклеотиттік тізбекті жеке нуклеотиттерге дейін ыдырататын ферметтер.
- Полимеразалар немесе репликазалар полинуклеотиттік жаңа тізбектің синтезін қамтамасыз ететін фермент тер тобы. Егер полимеразалардың әрекетіне байланысты хромосоманың екі еселенуі журсе, ол кезде фермент репликаза деп аталады.
- Лигазалар репликация және репарация процестері кезінде ДНҚ ның түзілген жеке фрагменттерін бір біріне жалғастырып, тігіп тұтас молекула құрастыратын ферменттер.
Репликация процесінің іске асырылуы үшін ДНҚ полимеразалардан басқа дезоксинуклеозид үшфосфаттардың(d АМФ,d ЦМФ, d ТМФ, d ГМФ) және ұштары 3! ОН болып аяқталған полинуклеотиттік тізбектердің болуы қажет.
12. Биологиялық азотфиксация процесіне процесіне түсініктеме беріңіз
Азот табиғатта өте көп тараған элементтің бірі болып есептеледі. Жер бетіндегі оның негізгі түрлері — литосферадағы байланысқан және атмосферадағы молекулалық азот. Атмосферадағы бос азотты өсімдіктер өздігінен сіңіре алмайды. Органикалық заттар шірігенде ондағы азоттың біраз белігі аммиакқа айналады. Топырақтағы нитрлеуші бактериялардың көмегімен сол аммиак азот қышқылына дейін тотығады. Өз кезегінде топырақтағы карбонаттар СаС03 қышқылмен реакцияға түсіп, нитратқа айналады да өсімдікке сіңеді. Шіру процесі кезінде азоттың біраз бөлігі атмосфераға бос күйінде бөлініп отырады. Табиғи жағдайда топырақтағы байланысқан азоттың мөлшері кемімейді. Ауадағы бос азот та түрлі себептермен толықтырылып отырады. Мысалы, ағаш, шымтезек (торф), таскөмірді жаққанда, органикалық заттар шірігенде, атмосфераға азот бөлінеді. Топырақта тіршілік ететін кейбір бактериялар да ауа жетіспейтін жағдайда нитраттардан оттекті өзіне тартып, атмосфераға бос азот бөледі .Осы процестер нәтижесінде табиғатта үздіксіз азот айналымы жүріп отырады Атмосферадағы азот (75,5%) электр құбылыстары мен фотохимиялық процестердің әсерінен әртүрлі азот қышқылының тұздарын түзеді де, жаңбыр суында еріп, топыраққа сіңеді, сөйтіп мұхит суына араласады.
Түйнек бактериялары ауадағы молекула күйіндегі азотты басқа организмдер сіңіре алатындай органикалық қосылыстарға айналдырады.
Белокты денелерде 17%-ке дейін азот болады.
Денитрификаттану процесі (топырақ және су бактериялары арқылы азот қышқылы тұздарының бос азотқа дейін ыдырауы) жүріп, әуелі азот қышқылына, одан кейін бос азотқа айналады да, ол ауаға түседі. Ал нитрификаттану процесінің (аммиак пен азотты органикалық қосылыстардың тотығуы) нәтижесінде әртүрлі азот тотықтары (N2O, NO, N2O3,N2O5) түзіледі.Тұздар
Азот қышқылы металдармен қосылып, азот қышқылының тұздарын түзеді. Олар ауа райы ыстық және құрғақ аймақтарда көбірек жиналады.
Суда жақсы еріген азот қышқылының тұздарын тірі организмдер қайтадан қабылдайды.
Міне осылайша табиғатта азот айналымы үздіксіз жүріп тұрады.
13. Түйнешекті бактерияларға негізделген бактериялық тыңайтқыштарды биотехнологияда қолдану принциптерін түсіндіріңіздер
Түйнек бактериялары– Rhіzobіun туысына жататын аэробты бактериялар.
Түйнек бактериялары кейбір бұршақ тұқымдас өсімдіктердің тамырында түйнек түзіп және олармен селбесе даму нәтижесінде атмосферадан азот сіңіріп, өсімдікке қажетті физиол. белсенді заттар түзеді. Бұршақ тұқымдасына жататын өсімдіктердің (жоңышқа, т.б.) топырақты азотқа байытатынын алғаш рет француз химигі Ж.Б. Буссенго (1802 – 87) байқады. Егер бұршақ дақылдарының тамырында Түйнек бактериялары көп жиналса, онда бұл өсімдіктер байланысқан азоттың болмағанына қарамастан тіршілік ете береді. Жас Түйнек бактериялары таза дақылдарда пішіні таяқша тәрізді, көл. 0,5–0,9*1,2––3,0 мкм, спора түзбейді, терісграмды (Грам әдісі бойынша клеткалары боялмайтын) бактериялар. Түйнек бактериялары аммоний тұздарын,нитрит,амин қышқылдарын, тыңайтқыш құрамындағы қоректік заттарды сіңіреді, көмірсуларды, органик. қышқылдарды, спирттерді көміртек көзі ретінде пайдаланады. Әр түрлі өсімдікке тән өзіндік арнаулы Т. б. болады. Бұршақ тұқымдас өсімдіктерді алғашқы жылы өсіргенде, оның тамырында түйнек тез түзілуі үшін себілетін тұқымды нитрагин препаратымен өңдеп, бактериялармен байытады. Сонда өсімдік алғашқы жылдың өзінде-ақ жақсы өнім бере алады.
Түйнек бактерияларының қазір бірнеше формалары табылды. Түйнек бактерия-лары әдетте бүршақ түқымдас өсімдіктердің тамырындағы түйнектерінде, ал кейбір түрлері топырақта жеке күйінде кездеседі. Олар қолайлы жағдайлар болғанда топырақта өсіп дамиды да кебейе береді. Өсіп түрған өсімдіқтердің тамыр түктері арқылы түйнек бакте-риялары тамыр клешасының ішіне енеді. Топыраққа ауа жақсы енетін болса түйнек бактерияларына қолайлы жағдай туады. Түйнек бактерияла-ры өсімдіктермен селбесш тіршілік еткенде, оларды азотты қоректік заттармен қамтамасыз етеді де, өздері өсімдіктердің тамырыиан бөлінетін көміртекті қосылыстармен қо-ректенеді. Сонымен қатао байланысқан азоттың бір бәлігін бактериялардың өздері пайдаланады. Бұршақ тұкымдас өсімдіктердің тамырындағы азотты сіңіруі өсімдіктің даму фазасына байланысты. Өсімдіктер гүлдер алдында және гүлдеп түрған кезінде азотты едәуір дәрежеде сіңіреді. Түйнек бактерияларының ауадағы сіңірген азотының 75%-ін өсімдіктер, ал 25%-ін бактериялардың өздері қорегіне пайдаланады. Түйнек бактерияларының атмосфера азотын қалай сіңіре алатыны әлі күнге дейін аньііқталмай келе жатыр. С. Н. Виноградский бүл бактериялар атмосфера азотын аммиакқа айналдырады деген пікір айтты. Бұл пікірді Ф. В. Турчиннің жүргізген тәжірибелері дәлелдеді.
Атмосфера азотын сіңіру үшін түйнек бактерияларына кәміртегінің қосылыстары қа-жет. Ондай қосылыстарға түрлі қанттар: глюкоза, левулеза, раффиноза, мальтоза, галактоза жатады. Сонымен катар, олар спирт және басқа органикалық заттарды пайдалана алады. Осы көрсетілген органикалық заттарды түйнек бактериялары тотыктырады да осы процесс барысында атмосфера азотын сіңіреді.
Нитрагин – Rhizobium туысының белсенді түйнек бактерияларының негізінде дайындалған бактериалды тыңайтқыш, ол бұршақ тұқымдастардың (бұрқаш, фасоль, сол, клевер, люцерна т.б.) өнімін жоғарылатуғы арналған. Нитрагиннің өнеркәсіптік өндірісі асептикалық биотехнологиялық өндіріске негізделген. Культивирлеу үшін жүгері экстракты, меласса, минералды тұздар сияқты компоненттері бар қоректік ортаны қолданады.
Азотобактерин – Azotobacter chro-ococcum микроорганизмінің культурасының негізінде алынған бактериалды тыңайтқыш.
Биотыңайтқыщтар – атмосфералық азотты фиксациялайтын микроорганизмдер өсімдіктерді азотпен байыту көзі ретінен басқа олардың өсуін ширататын гормондар түзеді, фитопатогенділерге антагонизмдік байқатады.
14. ДНҚ векторына қойылатын талаптар мен оның құрамына талдау жасаңыздар
Вектор - екі компоненттен тұратын ДНҚ немесе РНҚ молекуласы, векторлық бөлік (тасушы) және клондалған бөгде ген. Вектордың мақсаты - таңдалған ДНҚны реципиент жасушаға жеткізу, оны геномға енгізу, трансформирленген жасуша идентификациясына мүмкіндік беру, енгізілген геннің тұрақты экспрессиясына жағдай жасау.
Осылайша, вектор қожайын жасушасында сақтала алатындай үлкен болмауы қажет (репликацияланатын), көп рет көшірілетін (амплификацияланатын), қажет генді экспрессиялайтын ( сәйкес регуляторлық реттілікке ие), гибридті жасушаларды тиімді селекция үшін ажыратуға мүмкіндік беретін маркерлік генге ие, сәйкес организм жасушасына беріле алуы қажет.
Генінің тұрақты экспрессиясы үшін жауапты реттеуші реттілік кейінірек талқыланатын болады.
Трансформирленген жасушалары бөлуге мүмкіндік беретін маркерлік гендерді екі топқа бөлуге болады:
1.Селективті гендер антибиотиктерге қарсы (канамицин, тетрациклин, неомицин және т.б.) гербицидтерге қарсы (өсімдіктерде). Бұл кез келген субстратқа ауксотрофтылық гендері болуы мүмкін. Мұндай маркердің жұмыс істеу негізгі қағидасы - емес қайта, трансформирленген жасушалардың селективті ортада өсу қабілеті.
2. Репортерлі гендер, ақуыз жасушаларына бейтарап кодтаушы, тіндерде болуын оңай тексеруге болады.
Ең жиі репортер ген ретінде β-глюкуронидазы (GUS), жасыл флуоресцентті ақуыз (GFP), люцифераза (Люк), хлорамфениколацетилтрансфераза (CAT) гендері қолданылады. Бүгінгі күні ең жиі пайдаланылатын GFP және GUS гендері, сирек қолданылатыны LUC и CAT. Қазіргі кезде репортерлі ген ретіндет қолданылатын GUS Escherichia coli ден алынған молекулалық массасы68 кДа β-glucuronidase кодтаушы модификацияланған ген болып табылады. GUS рН 5-8 және 37 ° С температура қоршаған орта жағдайында кең ауқымды белсенділік көрсетеді. Ол табиғи және синтетикалық глюкуронидтердің кең спектрін гидролиздейді, яғни ферменттің қызметін спектрофотометриялық немесе флюрометриялық анықтау үшін, тіндердің гистохимиялық бояуы in situ (мысалы, көк түс ) үшін тиісті субстрат таңдауға мүмкіндік береді. Фермент жеткілікті тұрақты болып табылады: ол жылуға тұрақты (55 ° С температурада жартылай ыдырау шамамен 2 сағатта) және детергент әрекетіне тұрақты. Суыту-жылыту процесінде GUS қызметінің жоғалуы орын алмайды. Генетикалық инженерия әдістерімен құрылған химерді белоктар бөлігі ретінде, әдетте, GUS өз функционалдық қызметін сақтайды. Тірі жасушаларда GUS ақуызы бірнеше сағаттан бірнеше күнге дейін жоғары тұрақты және белсенді болып табылады.
GFP (green fluorescent protein - жасыл флуоресцентті ақуыз немесе жасыл флуоресцентті ақуыз) Симомура және басқа авторларымен 1962 жылы люминесценттік медуза Aequorea victoria да анықталды. GFP гені 1992 жылы Прашер және басқа авторлармен клондалды, ал бірнеше жылдан кейін түрлі прокариоттық және эукариоттық ағзалармен жұмыстарда репортер ген ретінде осы геннің белсенді пайдаланылуы басталған болатын. Қазіргі уақытта GFP гені бүкіл әлем бойынша жүздеген зерттеулерде пайдаланылады және олардың саны тез өсіп келеді. Бұл тез өсу GFP ақуыздың, атап айтқанда, ұзақтолқынды УК сәулелену кезінде көрінетін (жасыл) спектрлік облысында флуоресценциялану қабілетіне байланысты. Бұл флуоресценция ақуызға тікелей байланысты, оның пайдп болуына субстрат немесе кофермент талап етілмейді. Осыған қасиетіне байланысты GFP гені трансгенді организмдермен түрлі зерттеулер (деструктивті емес) орындауға мүмкіндік беретін перспективті репортерлі ген.
Көптеген GFP туындылары жалпы атауы AFP (autofluorescent proteins – автофлюоресцентті ақуыздар) ретінде белгілі. Теңіз анемоны Discosoma sp дан жақында тағы қызыл түсте флуоресценттенуші бір DsRed ақуызы алынды.Тағы бірнеше ұқсас флюроресценттеуші ақуыздар соңғы жылдары Ресей ғылым академиясының ғалымдарымен түрлі Anthozoa маржан полиптарынан бөлінген. Бұл өте жоғары температурада, рН төтенше жағдайында немесе Na2SO4 секілді күшті қайта қалпына келтіруші агенттермен денатурацияға ұшырайды. Физиологиялық жағдайға қайтып оралған соң GFP негізінен флуоресценцияға қабілетін қалпына келтіреді. Гендік инженерлік әдістермен құрылған химерлі белоктар құрамында, әдетте, GFP өзінің функционалдық қызметін сақтайды. Тірі жасушаларда GFP ақуызы өте тұрақты болып табылады.
15. Генді жасушаға тікелей енгізу әдістерін көрсетіңіз
Трансфекция
Микроинъекция
Электропорация
Метод «мини-жасуша»
Липосомаға қабатталу
Электронды пушка
Трансфекция кезінде ДНҚ кальций фосфаты кристаллдарында адсорбцияланады (Грэхем Ван дер Эб, 1973). Кальций периципатының бөлшектері пайда болады. Олар фагацитоз жолымен жұтылады.
Трансформацияның тиімділігін арттыру үшін генді тасымалдайтын арнайы ДНҚ-ға арнайы емес ДНҚ тасмалдаушы қосылады. Бұл мақсатта ДНҚ-ны бұзаудың тимусынан немесе лососьтың спермасынан бөлініп алынады. ДНҚ бөлігі мембранамен байланыспайды және жасушаға түспейді. ДНҚ 15-тен 90% -ға дейін акцептирленеді. Енгізгеннен кейін жасушалардың аздаған мөлшері бөтен гендерді экспрессиялауға қабілетті, соңынан экспрессия мөлшері төмендейді немесе трансформацияның тұрақты түрі пайда болады.
Трансфекцияға ДЭФЭ-декстран, ДНҚ адсорбциялаушы полимерлер қолданылады. Трансфекцияның жиілігін глицеринді шок арттырады (глицериннің 15% ерітіндіде 4 минут HEPES буферде).
Генді алдын-ала клонлдалған селективті маркермен алдын-ала лигирлесе жасушаға кез-келген генді енгізуге болады. Алайда алдағы уақыттағы зерттеулер жасушадан тыс лигирлеу қажет емес екендігін көрсетті.
Трансфекцияға хромосома мен хромосомалар фрагментін қолдануға болады. Жасуша донорлар митоз сатысында блокталады. Митотикалық хромосомалар осмос қысымы мен гомогенизациясының әсерінен босап шығады. Оларды дифференциалды центрифугалау әдісімен тазалайды. Хромосомаларды жасуша бетіне хлорлы кальциймен тұндырады, бірнеше сағаттан соң реагентпен өңдеп, мембрананы перфорирлейді. (мысалы глицеринмен).
Жасуша-реципиенттерін өңдеу үшін хромосоманың үлкен тазаланған препараттарын өолданады, өйткені хромосомалар оңай бұзылмайды. Бір жасушаға өңделетін хромосома саны шектеулі. Бір жасуша-реципиентке 20 хромосомадан артық емес санын қолданған дұрыс, өйткені жоғарғы концентрацияда суспензиядағы хромосомалар агллютинацияланады. Реципиент жасушалар донорлы хромосомалар фрагменттеріне ие, олар геномға өздігінен орналасуы мүмкін немесе өздігінен реплицирлей алады.
Жоғарғы жиіліктегі геномды ДНҚның трансформациясына барлық жасушалар ие бола алмайды. Адамның фибриобластары плазидалық ДНҚ-ны тиімді қосады және геномдыны қоспайды.
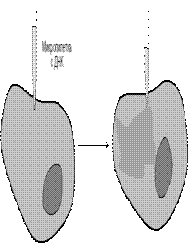
ЖасушағаДНҚ микроинъекциясыарқылы енгізу диаметрі 0,1-0,5 микрон болатын микропипеткалар немесе микроманипуляторлар пайда болғаннан соң ғана мүмкін болды. Тимидинкиназа гені бар герпес вирусының фрагменті бар плазмида мен pBR322 плазмидасы екуін қолданған. Тимидтинкиназасы бар ген иньецирленген және ТК-ген ядроға еніп қалыпты реплицирленегн болатын. ДНҚ-ны микроиньекция көмегімен енгізу 70-жылдардың басында Андерсон мен Диакумакоспен құрастырылған болатын. Жақсы аспап болса 1 сағатта 500-100 жасушаны иньецирлеуге болады жақсы эксперименттерде жасушалардың 50% -да қалыпты интеграция мен иньецирленген гендердің экспрессиясы байқалады. Бұл әдістің артықшылығы кез-келген жасушаға кез-келген ДНҚ-ны енгізуге мүмкіндік береді.
Сурет 45. ДНҚ-ны микроиньекция жолымен енгізу
Электропорация-жоғарғы кернеудегі импульстер биомембраналардың қайтымды өткізгіштігін арттырады.Электропорация ортасына жасуша мен енгізетін ДНҚ фрагменттерін енгізеді. Цитоплазмалық мембранада саңылаулар түзетін жоғарғывольтті импульстерді (кернеу 200-350В, импульстің ұзақтығы 54 мс) жібереді. Осмостық күштің әсерінен жаушаға ДНҚ енеді. Жасуша көлемі осы жағдайда ұлғаяды.
Электр өрісінің кернеуі мен оның әрекетінің ұзақтығы трансформацияланатын ДНҚ-ның концентрациясыжасушаның әр жағдайы үшінэкспериментті түрде таңдап алынады. Электропорацияның оптималды шарттарында трансформанттардың саны тірі қалған асушалардың 80% құрауы мүмкін.
Электропорация –биохимиялық емес, кең қолданылатын физикалық әдіс. Көптеген зерттеулер электропорация көмегімен ДНҚ-ны жасушаның әр түрлі типіне мысалы, культивирленетін жануарлар жасушалары, қарапайымдылар, ашытқылар, бактериялар, өсімдіктер протопластарына енгізуге болатынын көрсетті. Жоғарғы вольтті разрядтың екіқабатты липидті мембрананың электрпорациялық эффектісі қисығының радиусына тәуелді. Сондықтан да үлкен жануарлар мен өсімдіктер жасушаларына қарағанда жоғарғы кернеуде ұсақ бактерялар жасушалары ДНҚ-ны қарқынды жұтады.
Электропорация –ДНҚ-ны жасушаға енгізудің қарапайым, тиімді әдісі. Алайда қазіргі күнге дейін бұл әдіс электропораторлардың жоқтығынан лабороториялардың азаған санында ғана пайдаланылып келді. Бұндай аспаптардың болуы мен жетілуі гендік инженерияның бұл әдісін кең қолдануға мүмкіндік береді.
Сурет 46 Электропорация әдісі 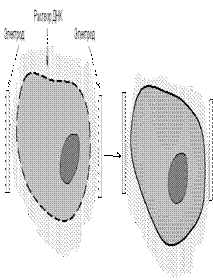
«Мини-жасуша» донорлы жасушада митозда кальцемидпен блоктау жолымен алады. Ары қарайғы жасушаларды кальцемидпен өңдеу кезінде әр хромосома маңайында жаңа ядролық мембрана пайда болады. В цитохолазинмен өңдеу және центрифугалау мини-жасушалардың түзілуіне алып келеді, олар цитоплазмалық мембранаға инкапсулденген микроядро түрінде болады.
Алынған мини-жасушалар әр түрлі ісерлерге төзімді, сондықтан құйылу үшін арнайы жұмсақ шарттарды таңдап алады. Әдіс өте қиын, өнімділігі төмен 106-107.
Липосомаға қабатталуы экзогенді генетикалық материалдың рестриктазалардың бұзғыш әсерінен өорғау үшін қолданады.
Липосомалар-фосфолипидтерден тұратын сфералық қапшықтар. Оларды сулы ерітінімен фосфолипидтерді лезде араласуы мен фосфолипидтің сулы эмульсиясын ультрадыбыспен өңдеу арқылы аладықы. Липосомалалар арқылы тасымалдау жасушаларға аз токсикалық ісер етеді.
Биологиялық баллистика әдісі (биолистика) бүгінгі күні өсімдіктерді, әсіресе даражарнақтыларды трансформациялауда қолданылатын тиімді әдістердің бірі.
Бұл әдістің мәні диаметрі 0,6-1,2 мкм диаметрдегі вольфрам бөлшектеріне трансформацияланатын ген конструкцисы бар ДНҚ вектор толтырылады. ДНҚ-сы бар вольфрам бөлшектері целлофан төсемеге орналастырылып биолитикалық пушканың ішіне қойылады. Каллус немесе жасушалар суспензиясы агарланған ортасы бар Петри табақшасына егіліп, биолитикалық пушканың астына 10-15 см қашықтықта орналастырылады. Пушкада вакуумды насоспен 0,1 атм. Қысымға дейін төмендетіледі. Қысымды төмендеткен кезде вольфрам бөлшектері жоғарғы жылдамдықпен пушкадан шығып жасуша қабырғасын жарып цитоплазма мен жасуша ядросына енеді.
Ортада орналасқан жасушалар вольфрам бөлшектерінің қысымы мен санына байланысты өледі, центрден 0,6-1 см қашықтықта орналасқан жасушалар сәтту трансформацияланады. Ары қарай жасушаларды ортаға ары қарайғы культивирлеу мен регенерациялауға жібереді.
Биолистикалық пушкалар көмегімен бидай жүгері, күріш, арпа сияқты дара жарнақты өөсімдіктер протрансформацияланған. Осыдан тұрақты трансформант-өсімдіктер алынған. Трансгенді даражарнақтыларды алудағы жетістіктермен қатар биолистикалық трансформация эмбриогенді тозаңға ДНҚ –ны тікелей тасымалдау мен ары қарайғы дигаплоидты өсімдіктерді алу үшін қолданады. Қазірі таңда бұл әдіспен темекі өсімдігінің трансформациясы жүзеге асқан және гаплоидты өсімдіктердің регенерациясынан кейін тұрақты трансформанттар алынған.
16. Метандық ашыту процесіндегі органикалық заттардың биодеградациясы
Биодеградация - биологиялық агенттердің әсерінен заттектер мен нысандардың өзіндік құрылымы мен қасиетін өзгертуі. Әдетте, пайдалы қасиеттерін жоғалтуын айтады.Метандық ашу нәтижесінде бөлінетін биогаз құрамы — 50-80 % метан, 20-30 % көмірқышқыл газы, шамамен 1 % күкірттісутек, сонымен қатар шамалы мөлшердегі басқа газдардан (азот, оттегі,
сутегі, аммиак, т.б.) тұрады. Метантүзуші бактериялар органикалық қышқылдарды қажетті метанға, көмірқышқыл газына айналдырады. Бұл күрделі жүйелену комплексіне микроорганизмдердің мыңдаған түрлері қатысады. Бірақ олардың негізгісі — метантүзуші бактериялар. Метантүзуші бактериялар, қышқылтүзуші ашытқы микроорганизмдермен салыстырғанда, көбеюге ұзақ уақыт қажет етеді және қоршаған ортаның өзгерістеріне қарсы тұру потенциялы төмен. Сондықтан, ашу ортасында алғашында ұшқыш қышқылдар түзілуіне байланысты, метандық ашудың бірінші кезеңін қышқылдық деп атайды. Ары қарай қышқылдардың түзілуі және өнделуі жылдамдығы тенеледі. Сондықтан субстраттың ыдырауы мен газ түзулуі бір уақытта қатар жүреді. Газдың түзілу өнімділігі метантүзуші бактериялардың тіршілік жағдайына байланысты. Метан бактериялары 0-70ºС аралығында өмір сүруге ыңғайлы. Егер температура жоғарыласа олар өледі, 900 С да өлмейтін кейбір штаммдары бар. Минусты температура болған жағдайда олардың қырылуы байқалмайды, бірақ тіршілік әрекетін тоқтатады. Әдебиеттерде бактериялардың өмір сүру температурасын 3-4ºС белгілейді [3]. Морфологиясы бойынша бұл бактерияларды таяқшатәрізділер (Methanobacterium), кокка тәрізділер (Methanococcus), сарцина тәрізділер (Methanosarcina) және спирилла тәрізділер (Methanospirillum) деп бөлуге болады.
Анаэробты жағдайда органикалық заттар бірнеше шіру этаптарынан өтеді: ацетатқа дейін, С02 және Н2. Метаболизмнің бұл өнімдері метантүзуші бактериялармен қолданылады. Биогаз анаэробты жағдайда, бактериялардың көмегімен органикалық материалдардың ыдырауынан пайда болып, метан мен басқа газдардың қосындысынан құралады да, мынадай пропорцияда болады:
1-кесте. Биогаз құрамы
Газ Химиялық формуласы Көлемі Метан СН4 40 – 70 % Көмірқышқыл газ СО2 30 – 60 % Басқа газдар 1 – 5 % Сутек Н2 0 – 1 % Көмірсутек Н2S 0 – 3 %
Сонымен қатар, оған айтарлықтай дәрежеде қоршаған орта да әсер етеді. Бөлінетін газдың айтарлықтай көлемі температураға байланысты: жылу көп болса, органикалық шикізат ферментациясының дәрежесі және жылдамдығы жоғары болады. Нақ осы себепті алғаш биогаз алу қондырғылары жылы климатты елдерде пайда бастады. Жылу оқшаулағыштарды, сонымен қатар кейде ысытылған суды қолдану, қыс кезінде температурасы 20ºС–ге дейін төмендейтін аудандарда биогаз генераторларының құрылысын меңгеруге мүмкіндік береді. Биохимиялық тұрғыдан метандық «ашыту» анаэробтық тыныс болып табылады. Органикалық заттардың (сірке қышқылы) электрондары көмірқышқыл газына тасымалданып, метанға дейін тотықсызданады. Метантүзуші бактериялар үшін электронның доноры қызметін
сутегі атқарады. Бактерия түрлерінен Methanobakterium formicicum және Metahanospirillum hungati басым қатысады. Мысалы, Methanobakterium kadomensis st 23-20 күн жүретін метаногенезді 8 күнде жүргізеді. Микробиология: органикалық қалдықтардан биогазды алу ол анаэробты, яғни оттексіз жағдайда ыдырағанда қалдықтың биогаз бөлу қасиетіне негізделген. Бұл процесс метанды ашу деп аталады және үш кезеңнен тұратын органикалық заттардың ыдырауы екі негізгі қышқылды және метанды микроағзалар топтарымен жүреді. Биогаз өндірісінің процесі үш сатыға бөлінеді: гидролиз, тотығу және метанның пайда болуы. Бұл күрделі айналу кешеніне көптеген микроағзалар қатысады, соның негізгілері болып – метантүзуші бактериялар, олардың үш түрі 1-суретте көрсетілген. Гидролиз. Бірінші этапта (гидролиз) органикалық зат сырттай клеткадан тыс микроағза ферменттерімен (клечатка, амилаза, протеаза және липаза), бактериялар көмірсутектің күрделі әрі ұзын шынжырын ажыратады, протеиндер мен липидтер – оданда қысқа шынжырларға айналдырады. Ашу. Биогаздың пайда болуының екінші кезеңіне қатысатын қышқыл өндіруші бактериялар күрделі органикалық қосылыстарды (клечатка, ақуыз, май т.б.) жәй заттарға дейін ыдыратады. Бұл кезде ашытылатын ортаға ашудың бірінші реттік өнімдері – ұшқыш май қышқылдары,төменгі спирттер, сутек, көміртек тотығы, сіркесу және құмырсқа қышқылдары пайда болады. Бұл органикалық заттар органикалық қышқылдарды биогазға айналдыратын метантүзуші бактериялардың қорек көзі болып табылады. Метанның түзілуі. Үшінші этаптағы метантүзуші бактериялар құрылымдары төменгі молекулалық салмақпен ыдыратады. Қалыпты жағдайда метантүзуші бактериялар анаэробты жағдайда тіршілік етеді, мысалы: су астында батпақтарда олар қоршаған ортаның өзгеруіне өте сезімтал, сондықтан метантүзуші бактериялардың өміршеңдігі үшін жасалған жағдайларға газдың бөліну қарқындығы тәуелді. Бактерия симбиозы (селбесу. Метан және қықшқыл түзуші бактериялар бір-бірімен симбиозда қарым-қатынас жасайды. Бір жағынан, қышқыл түзуші бактериялар метантүзуші бактериялар үшін тамаша параметрлері бар атмосфераны жасайды (анаэробты жағдай, төмен молекулалы салмағы бар химиялық құрылымдар), екінші жағынан, метантүзуші микроағзалар қышқыл түзуші бактериялардың арасындағы қосылыстарды пайдаланады. Егер мұндай қарым- қатынас жүрмесе реактордың ішінде екі микроағзаның өміршеңдігі үшін қолайсыз жағдайлар артатын еді. Биогаз алу үшін тағам қалдықтарынан басқа өсімдік және шаруашылық қалдықтарын, қи, ағын суларды т.б. қолдануға болады. Ферментация үрдісі кезінде резервуардағы сұйықтық үш фракцияға бөлінеді. Жоғары бөлігі – үлкен бөлшектерден құралған, біраз уақыттан кейін қатайып биогаздың бөлінуіне кедергі жасайды. Ферментатордың орталық бөлігіне сұйықтық жиналады, ал лас тәрізді фракция төменгі бөлігіне тұнбаға түседі.
17 Трансгендік өсімдіктердің қолдануын көрсетіңіз. Зиянды жәндіктерге трансгенді өсімдіктерді алу жолдарын түсіндіріңіздер
18. Генетикалық модификацияланған организмдердің қолданылуының маңыздылығы туралы мәлімет беріңіз
Гендік модификация және медицина.Ұлыбританиялықғалымдар бүгінгі таңда трансгенді тауықтар алуды жолға қойып жатыр.Өйткені мұндай тауықтардың жұмыртқасының медициналықүлкен маңызы бар дейді олар. Трансгенді тауықтардың жұмыртқасындағы протеиндерденқатерлі ісікті емдейтін препараттар алуға болады екен.Бұл жаңалықәлемгеәйгілі клон қой Доллиді жасап шығарған зерттеу орталығында ашылды.Эдинбург қаласының маңында орналасқан ғылыми орталықтыңғалымдарықазір трансгенді бес тауықты өсіргендері жайлы айтады. Егер де бұл жаңалыққолдау тауып,препараттар кеңінен таратылатын болса адамдар осы бір аты жаман аурудан құлан таза айығып кетуге мүмкіндік алар еді.
Қатерлі ісікпен күресте генетик ғалымдар топырақта тіршілік ететін және анаэробты,оттекті ортада тіршілігін жоятын Clostridium novyi – NT бактерияларын қолдануды ұсынып отыр.Көптеген қатерлі ісіктердің оттегі мөлшері аз болып келетін орталық аймақтары болады.Бұл аймақтағы қатерлі жасушалар тез көбеюге қабілетсіз болып келеді.Бактерия споралары тамырға егіліп,қан айналым жүйесі арқылы мүшелер мен ұлпаларға таралып,қатерлі ісіктің гипоксия аймағына да жеткізіледі. Қолайлы жағдайға тап болған споралар өсіп,дамып –жетілген бактериялар қатерлі ісік жасушаларымен қорек үшін бәсекеге түсе бастайды.Осылайша бірте-бірте ісік жасушалары жойылып кетеді.
Гендік модификация және экология.Вашингтон университетінің ғалымдары табиғатты улап жатқан өндірістік токсиндерді ыдыратып,зиянсыз затқа айналдыра алатын гендік модификацияланған теректі жасады.Фиторемедиация деп аталатын өсімдіктер әлемін табиғаттағы өндірістік қалдықтармен күресуге пайдаланатын бағыт өндірістік ластаушылар мәселесін шешудегі болашағы зор бағыттардың бірі.Бүгінгі күнге дейін фиторемедиация күмән туғызып келген болатын, себебі ластанған аймақтардың беткі қабаттары тек бір емес бірнеше қалдықтармен уланғандықтан,бұл әдіс тиімсіз деп саналды.Бірақ жасап шығарылған теректер органохимиялық улардың біреуін ғана емес,бірнешеуін залалсыздандыра алатыны белгілі болды.Олар хлороформ, бензол,трихлорэтилен тәрізді улы заттарды ыдыратып,суға,көмірқышқыл газына,тұздарға айналдыра алады.Енді ғалымдардың алдында тұрған мәселе-бұл теректердің қоршаған орта үшін зиянсыздығын дәлелдеу.
Гендік модификацияланған балдырлар және автомобиль отыны.
Иллинойс университетінің ғалымдары ірі көлемдегі сутегі өндіру үшін теңіз балдырларын молекулалық деңгейде модификациялаумен айналысуда. Зерттеушілер сутегі балдырлардағы фотосинтез реакциясына қатысатын элементтердің бірі екендігін тапты.Бірақ оны өндірістік көлемде алу үшін сутегінің түзілуіне қажетті процесстер мен гидрогеназа ферменттері мен оттегін алу реакцияларын анықтау қажет.Бұл тізбектерді ашу үшін ғалымдар өте қуатты компьютерлер мен балдырларды модификациялау әдістерін қолдануда.Қажетті модификациялар жасалған соң балдырар табиғи балдырларға қарағанда сутегіні он есе көп өндіретін болады дейді ғалымдар.Яғни,модификацияланған балдырлардың көмегімен барлық жеңіл автокөліктердегі қоршаған ортаға қауіпті жанармайды сутегі отынына ауыстыруға мүмкіндік туар еді.
19. Тоған суларды тазарту жолдарын түсіндіріңіздер және қолданылатын микроорганизмдерге сипаттама беріңіздер
20. Екі еселену процесіне қатысатын ДНҚ полимераза ферментіне жалпы сипаттама беріңіз
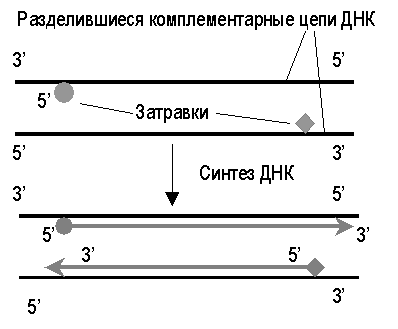
Бактерияларда ДНҚ-полимераза I, II және III ферменттері ашылған. Оның ішіндегі негізгісі ДНҚ молекуласы тізбегінің элонгациясына жауапты ДНҚ-полимераза III болып табылады. ДНҚ-полимераза I ферменті қалып жүретін тізбектегі «брешті» толтырады, ал ДНҚ-полимераза II ферментінің қызметі әлі белгісіз. Бастаушы тізбектің синтезі кезінде ДНҚ-полимераза ферментінде қосарланған 3′-соңы болады, ол келесі жаңа тізбекті синтездеуге көмектеседі. Бірақ-та «қалып жүретін» тізбекті синтездейтін ДНҚ-полимераза ферментіне 3′-соңымен қосарланған (3-гидроксилді тобы) «затравка» керек. Бұл затравканы қысқа РНҚ молекуласы ретінде рибонуклеотидүшфосфаттан ДНҚ-примаза ферменті синтездейді. Бұл процесс кезінде әр қысқа бөліктер ДНҚ молекуласының жаңа синтезін бастайды. Сонан соң 5′-фосфатдезоксирибонуклеотид қалдықтарын 3′-гидроксилді соңдарымен байланыстыратын ДНҚ-полимераза ферменті іске қосылады да ДНҚ тізбегінің қалыпты синтезі басталады. Келесі ретте синтезді бастаған «затравка» бөлініп кетеді де, бос кеңістік ДНҚ-мен толады. Сонымен Оказаки фрагменттері синтезінде «затравка» рөлін қысқа РНҚ молекулалары атқарады.
ДНҚ—полимеразалар (әсіресе бактериялардың ДНҚ-полимераза ІІІ-) нуклеотидтердің аналық тізбекке комплиментарлы синтезделуін қамтамасыз етуімен бірге 31—>5'-экзонуклеазалық-та қызмет атқарады. Соңғы қызметі ДНҚ синтезі барысында дұрыс —комплиментарлы нуклеотидтердің орнына, бұрыс, комплиментарлы емес нуклеотид, жалғанған кезде жүзеге асады. Осы кезде ДНҚ-полимераза бұрыс жұптасқан нуклеотидті «байқап» қалып, оны өсіп келе жатқан 31 ұшынан шығарып (үзіп) алып тастайды. Осылайша полимеразалар өз жүмыстарын үнемі бақылап отырады в) Кез келген жаңадан еинтезделген ДНҚ фрагменттері-(ұзын лидерлік не Оказаки фрагменттері) праймерлерден («РНҚ-ұйытқыдан) басталады. Аналық (матрицалық) тізбек бойымен жылжып отыратын ферменттік кешен келесі ДНҚ фрагментіне жанасқаннан кейін, ДНҚ-полимераза ІІІ ферменті «қыстырушы» РСNА ақуызын ашып, кешенді матрицадан ажыратады және ДНҚ синтезін тоқтатады. 5-сурет синтезделген ДНҚ фрагменттерінің түйісуі (Мушкамбаров, Кузнецовтан, 2003) Осыдан кейін ДНҚ полимераза І-іске кіріседі. Ол өсіп келе жатқан ДНҚ фрагментінің 3' ұшына жалғанады және 3 белсенділікке ие болады. Біріншіден ол «алдыңғы» немесе 51—>3'-экзонуклеазалық белсенділікке ие болады, яғни ол бұрынғы ДНҚ тізбегінің «РНҚ-ұйытқысының» (праймер) 51 ұшынан бір-бірлеп нуклеотидтерді алып тастап отырады, ал босаған жерге өз фрагментінің 31 ұшына дезоксинуклеотидтерді жалғайды (ДНҚ-полимеразалық белсенділік). Сонымен қатар, ДНҚ-полимераза ІІІ-сияқты «артқы» 31—>5' экзонуклеазалық белсенділік арқылы өз жұмысын қадағалауды да «ұмытпайды». ДНҚ-полимераза-І-қызметі өсіп келе жатқан ДНҚ фрагментінің бұрынғы ДНҚ фрагменттерінің дезоксинуклеотидтерімен түйіскеннен кейін аяқталады. Эукариоттарда ДНҚ-полимераза ІІІ-қызметін α және σ—ДНҚ полимераза кешені атқарады; бұл жерде 31—5' экзонуклеазалық белсенділік σ -ДНҚ —полимеразаға тиесілі болса, ДНҚ-полимераза І-қызметін, 51—>3' —экзонуклеазалық қызметті ерекше фермент нуклеаза (Н), ДНҚ-полимеразалық белсенділікті (босаған жерді толтыру) β -ДНҚ - полимераза атқарады. Жоғарыда аталған ферменттер кешені қызметтері нәтижееінде жаңадан синтезделінген әрбір тізбектер бір-бірімен тығыз орналасқан көптеген фрагменттерден тұрады.
21. Плазмидалық векторларға қойылатын шарттарды атаңыз. pBR322 плазмидалық векторына сипаттама беріңіздер
Векторлардың бірнеше түрлері бар:
Бактериалды плазмидалар
Бактерияның жасушалық ДНҚ-сының негізгі массасы хромосомада кездеседі. (Мысалы, E.Coli хромосомасында 4 млн жұп нуклеотид). Алайда бактерияларда хромосомадан басқа аз мөлшерде сақиналы ДНҚ плазмида бар. Осындай минихромосомалар плазмидалар деп аталады.
Плазмидалар өқрамында анибиотикке төзімділік гендері, ауыр металлдардың ионы (R-плазмида), сонымен қатар кейбір органикалық қосылыстарды катоболизмңн бақылайтын органикалық қосылыстар (биодеградация плазмидасы немесе D- плазмида). Бұл гендер плазмидада кездесетіндіктер олардың копиялары өте көп. Плазмидалардың копиясының көп болуы жасушалардың антибиотиктер мен ксенобиотиктерді химиялық нейтралдайтын ферменттерді көп мөлшерде синтездеуіне мүмкіндік береді.
Плазмидалы ДНҚ хромосомалықтан қарағанда аз болғандықтан, оны таза күйінде оңай бөліп алуға болады. Кальций иондарының бар болуы кезінде плазмидалар бактерия-реципиенттермен оңай жұтылады, бақтерияларда плазмида болмаса да бактерия қрпақтарында жұтылған плазмиданың көптеген копияларын табуға болады. Сәйкессіздік топтары болуы –Inc-топтар болады (ағылшынша incompotability-cәйкессіздік). Бұл топтар да бір бірімен сәйкесетін бірақ басқа плазмидалармен сәйкеспейтін бірнеше плазмиалар болуы мүмкін. Бұл плазмидаларда көптеген қасиеттері ұқсас және ДНҚ гомологиясы да жиі.
Жасушадағы плазмида копиясының саны өзгеруі мүмкін. Бұл жасуша мен плазмиданың генетикалық ерекшеліктеріне байланысты. «Әлсіз бақылауда» болатын плазмидалар жасушадағы саны 10-200 копия болғанға дейін плазмида көбейе алады. Егер плазмида «қатаң баұылауда» болса ол негізгі хромосоманың жылдамдығымен реплицирленеді. Бұндай плазмидалар жасушада бәр немесе бірнеше копияда болады. Рекомбинантты ДНҚ-ны клондауға бірінші типті плазмидаларды қолдануға тырысады. Бірақ бұл маңызды емес, өйткені плазмидалар хроромфениколдың қатысында хромосома бөлінуінен тыс көбейіп, плазмида копияларының саны өседі.
1. рBR 322 клондауға жиі қолданылатын плазмидалар E.Coli-ден бөлініп алынған табиғи плазмидалар болып табылады. Бқл плазмида да екі антибиотикке төзімділік гені бар: ампициллин және тетрацеклинге,бқл антибиотиктерге төзімділік генінде рестрикция сайттары орналасқан. Осылай вектор рекомбинантты плазмидасы бар бакерияларды анықтауға мүмкіндік береді.
Генетикалықинженерияда Е. Соlі бактериясы үшін көптеген векторлық плазмидалар құрастырылды. Олардың ішінен әсіресе СоlЕ1 плазмидасының туындылары кең таралды. Ф. Болвар және Р. Родригес құрастырған осындай плазмида — рВR322 бірнеше мың жұп негіздерден (4362 н. ж.) құралған. Бүл плазмидада антибиотиктер — ампициллин мен тетрациклинге төзімділіктің гендері бар және бірнеше рестриктазалар үзе алатын сайттары (нуклеотидтік нүктелері) бар рВR322 плазмиданың құрамында екі плазмида (рМВ1 және рSС101) және Тn З транспозоны бар. Ампициллинге тұрақтылықтың генінде Pst1 рестриктазасына арналған сайтқа және тетрациклинге тұрақтылық генінде ВаmН1 және SaL1 рестриктазаларына арналған қос сайтқа мән беріңіз. Осындай рестрикциялық сайттарда екі антибиотиктерге төзімділік гендерінің болуы қажет ДНҚ-сы (бөтен ДНҚ-сы) бар плазмидаларды сұрыптап алуға мүмкіндік береді.
Плазмиданы Ваm1 рестриктазасымен үзеді де, босаған орынға бөтен ДНҚ молекуласын (олар да, алдын ала Ваm1 рестриктазасымен үзіледі) жалғайды, нәтижесінде рекомбинантты плазмида тетрациклинді ортада өсе алмайды, өйткені плазмиданың tet генінің біртұтастығы бұзылған. Керісінше, плазмида ампицилинді ортада өсе алады, міне, осындай ортада көбейетін бактериялардан қажет генді оңай табуға болады. Бұл арада, вектор антибиотиктерге төзімділік гендері бойынша таңбаланды.
pBR322 векторынан басқа СоlЕ1 плазмидасы негізінде бірнеше векторлар құрастырылған.Басқа плазмидалар (рSC101 т. б.) негізінде алынған векторлар да белгілі.
22. Рекомбинантты ДНҚ-ны клондаудың жалпы бейнесін көрсетіңіздер
Рекомбинантты ДНҚ құрылысы
Рекомбинантты ДНҚ дегеніміз әр түрлі биологиялық көздерден алынған екі немесе одан да көп ДНҚ фрагменттерінің in vitroда (пробиркада) біріктіру арқылы қалыптасатын ДНҚ. Осы анықтамадағы генетикалық инженерия негізін көрсететін және оның, генетикалық селекция, эмбрионалдық инженерлік секілді, басқа гибридтік организмдер (немесе химера) алу жолдарынан айырмашылығын сипаттайтын негізгі сөз «ДНҚ фрагменті» және «in vitroда біріктіру» болып табылады.
ДНҚ фрагменттерін, соның ішінде генге ие фрагменттерді рестриктаза ферменттері көмегімен алады. Рестриктазалар тік және жабысқақ ұштары бар фрагменттер түзе алады. ДНҚ фрагменттерін тігу тігілетін ДНҚ фрагменттері қандай ұшқа ие соған байланысты үш негізгі әдіспен жүргізіледі.
Аттас «жабысқақ» ұшы бойынша тігу (рестрикциалы лигазды әдісі)
Бұл әдіс ең көп тараған және танымал. Осы жолмен гибридті ДНҚ алғаш рет 1973 жылы С. Коэн және оның әріптестерімен алынды. Кейбір рестриктазалар, Pst I секілді, ДНҚ тізбегінде симметриялы, тану сайты орталығынан бірдей қашықтықта бір бірінен диагональ орналасқан және «қадам» қалыптастыратын үзілістер жасайды (сур. 36). Бұл бір-бірімен комплементарлы бөліктерде негіздердің жұптасуы әсерінен бірігу үрдісі жүреді, сондықтан оларды комплементарлы немесе жабысқақ ұштары деп аталады. Негіздердің жұптасуы тек комплементарлы қатарлар арасында жүреді, сондықтан Eco RI түзетін AATT-соңы Hind III түзетін AГЦТ-соңымен жұптаспайды. Бірақ бір рестриктаза ферментінің әсерінен түзілген кез келген екі фрагмент (шыққан тегіне қарамастан) комплементарлы нуклеотидтердің біртізбекті бөліктері арасында сутектік байланыстар түзілуінен байланысады (сур. 39).
Сур. 39. Рестрикциялы - лигазды әдіс схемасы
Алайда, осындай жұптасудан кейін қос спираль толық тұтастығын қайта қалпына келтірмейді, себебі фосфодиэфирлі бөлікте екі үзіліс қалады. Оны қалпына келтіру, яғни тігу үшін немесе тізбектерді байлау үшін ДНҚ лигаза ферменті пайдаланылады. Бұл фермент тірі жасушада репликация кезінде түзілетін ДНҚ фрагменттерін тігу кезіндегі атқаратын функцияны орындайды.
«Тік» ұштары арқылы тігу (коннекторлы әдісі)
ДНҚ фрагменттерінің байланысуы үшін жабысқақ шеттері міндетті түрде қажет емес. Тік ұштар да ДНҚ лигаза әсерінен қосыла алады, егер лигаза және тік ұштар концентрациясы реакциялық қоспада жоғары мөлшерде болса. Бұл жағдайда бірігу реакциясының өз ерекшеліктері бар және оның тиімділігі жабысқақ ұштары бойынша тігілүге қарағанда төмен болады. Алғаш рет мұндай эксперименттерді АҚШ Стэнфорд университетінде Пол Берг 1972 жылы жүргізді. Сондай ақ, жабысқақ ұштарды ферментативті жол арқылы тік ұшты ДНҚ молекулаларына қоса тiркеуге болады. Осы мақсатта ДНҚ тізбегінің 3 'соңына нуклеотидтер қосатын бұзау тимусының трансфераза ферментін қолданады. Егер in vitro-да рекомбинацияланған ДНҚ фрагменттерінің бірінің 3 '-соңына дезоксинуклеотидилтрансфераза көмегімен белгігі ұзындықтағы біртізбекті олиго (dA)-сегменттерін, ал келесі фрагмент соңына олиго(dT)-сегменттерін құрастырса, онда осындай жолмен алынған фрагменттердіараластыру кезінде олиго(dA) және олиго(dT) тізбектері арасында сутектік байланыс түзілуінен жұптасу жүреді (Cурет 40). Екі фрагменттің ковалентті байланысуы үшін ДНҚ-лигаза пайдаланылады. Бұл рәсімдер рекомбинантты ДНҚ молекуласын алудың екінші жалпы әдісі үшін негіз болып табылады.
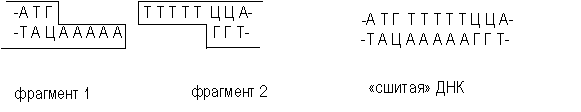
Сур. 40. «Жабысқақ» ұштарын тігу, және ДНҚ фрагменттерін байланыстыру
Ұзын өзара комплементарлы біртізбекті ұштарды құрастыруға болатындықтан, гибридті молекулалары жоғары тиімділікпен шығарылады. Атап айтқанда, сондықтан тек шектеулі мөлшерде қол жетімді аналық РНҚ-ның ДНҚ көшірмелерін клондау кезінде коннекторлы әдіс пайдаланылады. Байланысудың осы әдісінде фрагменттер арасына AAAA бөліктері енгізіледі. Мұндай қосымша TTTTT реттілігі байланысқан молекулалардың функциясына әсер етуі мүмкін, сол себепті, мүмкіндігінше,рекомбинантты ДНҚ молекулаларын алу үшін рестриктаза ферменттерінің әсерінен пайда болатын жабысқақ ұштарды пайдаланады.
Әр аттас жабысқақ ұштары бар фрагменттерді тігу
Әр түрлі рестрикциялық эндонуклеазалар әсерінен түзілген және әр түрлі комлементарлы емес жабысқақ ұштарға ие фрагменттерді тігу қажет жағдайда линкерлерді пайдаланады (немесе «өткізгіш»). Линкерлер - рестрикция сайттары ретінде химиялық синтезделген олигонуклеотидтер немесе олардың комбинациясы. Алғаш рет бұл идеяны 1977 жылы Шеллер әріптестерімен ұсынған болатын.
Мұндай гендік «өткізгіштердің» үлкен жиынтықтары бар. Әрине, линкерлерді пайдалану кезінде генетикалық ақпараттың экспрессиясы ережелерін қадағалау қажеттігі ескерілуі тиіс. Көбінесе, линкерлер ортасына генетикалық реттеу элементтерін орналастырады, мысалы промоутер немесе рибосомамен байланысты бөлік. Бұл жағдайда линкерлер тек гендер бірігуін қамтамасыз етіп қоймай, олардың экспрессиясына жағдай жасайды. «Тік ұшты - жабысқақ ұшты» линкерлер бар.
Егер қажет болса, жабысқақ ұштары тік ұшқа түрлендіріледі. Бұл біртізбекті ДНҚ-ны бұзатын эндонуклеаза S1 ферменті көмегімен жабысқақ ұштарды ыдыратумен жүреді немесе жабысқақ ұштар аяғына дейін соғады, яғни ДНҚ-полимераза I көмегімен біртізбекті жабысқақ ұштың екінші тізбегін синтездейді.
23. Рестрикциялық эндонуклеазаларды және олардың классификациясын сипаттаңыздар-2ответпен бирге
24. Ағын суларды органикалық қосылыстардан тазртуға бейімделген арнайы микроорганизмдерге сипаттама беріңіз
Ауыр өнеркәсіптің суларында көбінесе минералдык ластағыштар, ал жеңіл өнеркәсіпте органикалык ластағыштар кездеседі.
Ағынды суды тазалауда бактерия – балдыр кешенін қолданады. Біріншілері ластанған сулардың органикалық қосылыстарын ыдыратады, ал екіншілері молекулалық оттегінің мөлшерін көбейтеді және ішек бактерияларының санын азайтады. Қазіргі кезде балдырларды тазалау құрылғыларында көп мөлшерде өсіру кеңінен қолдануда, бұл өте тиімді, себебі аэрацияга энергия қажет емес. Chlorella көмегімен бүгінгі күні 500 млн тонна ластанган су тазаланып, қайта қолданысқа түсіп жатыр. Мысал ретінде, алтын өндіретін зауыттардан күніне 60 мың м3 қоюланган куйіндегі агын сулар шыгарылады. Биологиялық тазалауда жасыл жэне диатомды балдырлар ғана қолданылып жатыр, бірақ келешекте эвгленалыларды да қолдану көзделіп отыр. Балдырлар жэне кошкыл бактериялар көмегімен малшаруашылығының ластанган суларының дезодорациясын жургізеді.
Ластанган су тогандарында микробалдырлардың органо-минералды косылыстарды тотыктыру мен тотықсыздандыру арқылы ыдырату жэне ауырметалдар иондарын биоаккумуляциялау қасиетін зерттеудің ғылыми жэне практикалық маңызы зор. Ластанган суларга микробалдырлар дақылдарын 10 тәулік өсіргеннен кейін судың иісі түзеліп, ілінетін заттар -73.8%, ОБП5 -91%, минералдытұздар 100% дейін тазаланғанын көрсетті. Сонымен катар мыс, мырыш жэне кадмий иондарының микробалдыр клеткаларымен жиналып тазарганы жэне де коли-индекс - 900, коли-титр 0,4 құрағандығы анықталды. Осылайша ауырметалдармен ластанган қалдық сулардың физикалық, химиялык жэне микробиологиялық қасиеттерін микробалдырлардың аралас дақылдарын (Chlorella vulgaris - Ш-63, Chlorella vulgaris Z-l жэне chlamydomonas reinhardtii CC-124 Res -1 ) өсіру нэтижесінде жақсартуға болатыны лабораториялық модельді эксперимент аркылы аныкталып отыр.
25. ДНҚ-ның нуклеотидтік қатарын анықтаудың негізгі әдісіне түсініктеме беріңіздер
ДНҚ-ның маңызды генетикалық аймақтарын анықтауға мүмкіндік беретін сипатталған әдістер үлкен маңызға ие болды. Олар, сондай-ақ, ДНҚ секвенирлеу және рекомбинантты молекулалар құрудың өте тиімді әдістерін дамыту үшін жол ашты. Секвенирлеу ДНҚ-ны рестрикциялық эндонуклеазалармен ыдырату кезінде түзілетін ұзындығы 100-500 жұп нуклеотид болатын сегменттің толық нуклеотидтік реттілігін тез анықтауға мүмкіндік береді.
Сэнгер әдісі (ферментативтік)
Сэнгер ұсынған және оның атымен аталатын тағы бір әдіс химиялық емес, ферментативті тәсілге негізделген. Сэнгер ДНҚ-полимераза I қолданды. Жасушада бұл фермент жаңадан синтезделген ДНҚ фрагменттері (Оказаки фрагменттері) арасындағы үзілістерді толтыру арқылы ДНҚ репликациясы процесіне қатысады. Фермент жұмысы үшін ДНҚ ізашарлары- дезоксирибонуклеотидтрифосфаттар (dNTP), сондай-ақ, шағын қостізбекті бөлігі бар бір-тізбекті матрица, синтез басталатын праймер қажет (сур. 41). Сондай-ақ, төрт ДНҚ негіздерінің әрқайсысы үшін дезоксирибоза 3'-OH болмайтын модификацияланған дидезоксирибонуклеотидтер синтезделді. ДНҚ-полимераза осы ізашарларды ДНҚ-ға қосады. Алайда, ДНҚ-ға қосылған модификацияланған негіз келесі дезоксирибонуклеотидпен фосфодиэфирлі байланыс құра алмайды. Нәтижесінде берілген тізбектің өсуі (элонгация) ДНҚ-ға дидезоксирибонуклеотид (ddNTP) қосылған жерде (терминация) тоқтатылады. Сол себепті, оларды элонгация терминаторы атайды.
Сурет 41. ДНҚ секвенирлеудің ферментативтік әдісі
Сэнгер бойынша реакциялық қоспа нуклеотидтік реттілігі анықталуы тиіс ДНҚ тізбегінен, осы тізбектің терминал бөлігіне комплементарлы «белгіленген» қысқа ДНҚ фрагментінен (праймерден), төрт ddNTP-дің біреуінен және белгілі бір қатынаста (конкуренция болатындай) сәйкес dNTP және басқа үш dNTP-ден тұрады. Әрбірі төрт ddNTP-дің тек біреуін қамтитын төрт қоспа дайындайды. Әр түтікте түрлі ұзындықты белгіленген фрагменттердің жинағы құралады. Олардың ұзындығы тізбекке ақаулы нуклеотидтің қосылу жеріне байланысты. Нәтижесінде алынған белгіленген ДНҚ фрагменттерін (бір нуклеотидке дейінгі дәлдікпен) полиакриламидті гелде бөледі, авторадиография жүргізеді және төрт сынамадағы фрагменттердің орналасу суреті бойынша ДНҚ-ның нуклеотидтік қатарын орнатады (сур. 41).
Қазіргі уақытта біркелкі ұзындықты кезкелген ДНҚ сегментінің дәл нуклеотидтік қатарын анықтау - толық шешілетін мәселе. Қазірдің өзінде бірнеше жүз прокариот және эукариоттар гендері реттілігі анықталды. Геннің реттілігін және генетикалық кодты біле отырып, ол арқылы кодталатын ақуыздың аминқышқылы ретін анықтау оңай. Бұрын ақуыз құрылымын анықтау үшін бөлініп, тазартылған ақуызға мұқият және тынымсыз талдау жасауға тура келетін. Енді ақуыз құрылымын тікелей секвенирлеуге қарағанда, нуклеотидтік реттілігі арқылы анықтау жеңіл. Ақуызды секвенирлеуге ай, тіпті, жыл қажет етсе, ал ДНҚны бірнеше аптада секвенирлеуге болады.
ДНҚ реттілігін анықтау, сондай-ақ, ақуыздарды кодтамайтын, бірақ ген экспрессиясының реттелуіне және ДНҚ репликациясына қатысатын аймақтардың барын анықтады. 1996 жылы ашытқы геномы, 1998 жылы арабидопсис геномы, 2000 жылы адам геномы секвенирленді, сондай-ақ бұл жағдайда біз нуклеотидтік реттілігін анықтау туралы ғана айтып отырмыз, себебі геномның жекелеген бөліктерінің генетикалық құрылымы және функциясы әлі анықталған жоқ, бұл қиын міндет.
Секвенирлеудің жылдам әдістері пайда болысымен, алдын ала белгіленген ретпен салыстырмалы ұзақ олигонуклеотидтерді синтездеудің тез және қарапайым әдістері пайда болды. Енді, үш -төрт күн ішінде 12-20 нуклеотидтен тұратын қатарды синтездеуге болады. Осы процессті автоматтандыру синтезтеуді одан әрі жеңілдетіп, жылдамдатады. Осы жұмысты бірнеше сағатта орындайтын ДНҚ-синтезатор - құрылғылар пайда болды.
26 Азотфиксация процесіне қатысатын бактериялардың топтастырылуы және олардыі табиғатта алатын орнына сипаттам беріңіздер
Азот табиғатта өте көп тараған элементтің бірі болып есептеледі. Жер бетіндегі оның негізгі түрлері — литосферадағы байланысқан және атмосферадағы молекулалық азот. Атмосферадағы бос азотты өсімдіктер өздігінен сіңіре алмайды. Органикалық заттар шірігенде ондағы азоттың біраз белігі аммиакқа айналады. Топырақтағы нитрлеуші бактериялардың көмегімен сол аммиак азот қышқылына дейін тотығады. Өз кезегінде топырақтағы карбонаттар СаС03 қышқылмен реакцияға түсіп, нитратқа айналады да өсімдікке сіңеді. Шіру процесі кезінде азоттың біраз бөлігі атмосфераға бос күйінде бөлініп отырады. Табиғи жағдайда топырақтағы байланысқан азоттың мөлшері кемімейді. Ауадағы бос азот та түрлі себептермен толықтырылып отырады. Мысалы, ағаш, шымтезек (торф), таскөмірді жаққанда, органикалық заттар шірігенде, атмосфераға азот бөлінеді. Топырақта тіршілік ететін кейбір бактериялар да ауа жетіспейтін жағдайда нитраттардан оттекті өзіне тартып, атмосфераға бос азот бөледі. Осы процестер нәтижесінде табиғатта үздіксіз азот айналымы жүріп отырады Атмосферадағы азот (75,5%) электр құбылыстары мен фотохимиялық процестердің әсерінен әртүрлі азот қышқылының тұздарын түзеді де, жаңбыр суында еріп, топыраққа сіңеді, сөйтіп мұхит суына араласады.
Түйнек бактериялары ауадағы молекула күйіндегі азотты басқа организмдер сіңіре алатындай органикалық қосылыстарға айналдырады.
Белокты денелерде 17%-ке дейін азот болады.
Денитрификаттану процесі (топырақ және су бактериялары арқылы азот қышқылы тұздарының бос азотқа дейін ыдырауы) жүріп, әуелі азот қышқылына, одан кейін бос азотқа айналады да, ол ауаға түседі. Ал нитрификаттану процесінің (аммиак пен азотты органикалық қосылыстардың тотығуы) нәтижесінде әртүрлі азот тотықтары (N2O, NO, N2O3,N2O5) түзіледі.Тұздар
Азот қышқылы металдармен қосылып, азот қышқылының тұздарын түзеді. Олар ауа райы ыстық және құрғақ аймақтарда көбірек жиналады.
Суда жақсы еріген азот қышқылының тұздарын тірі организмдер қайтадан қабылдайды.
Міне осылайша табиғатта азот айналымы үздіксіз жүріп тұрады.
27. ДНҚ-ның екі еселену процесіне молекулалық деңгейде түсініктеме беріңіздер11-ответпен бирге
28. Бактериялық плазмидаларға жалпы түсініктеме беріңіздер және оларға қойылатын талаптарды көрсетіңіз21- ответпен бирге
29.Эукариоттардағы геномның ұйымдасуының ерекшеліктеріне тоқталыңыз
Эукариотты организмдерде транскрипция регуляциясының механизмі күрделірек. Эукариот гендерін клондау мен секвенирлеу нәтижесінде транскрипция мен трансляцияға қатысатын арнайы тізбектер анықталған.
Эукариот жасушаларына тән:
1. ДНҚ молекуласында интрондар мен экзондардың бар болуы.
2. А-РНҚ-интрондар мен экзондардың тігілуі.
3. Транскрипцияны реттейтін регуляторлы элементтердің болуы:
а)3 түрлі промотерлер, олардың әрқайсысына арнайы полимераза қонады. РОІ І рибосомалы гендерді реплицирлейді, РОІ ІІ-белоктардың құрылымдық белоктарын, РОІ ІІІ- азғантай РНҚ кодтайтын РНҚ. РОІ І және РОІ ІІ транскрипция инициациясының аймағының алдында тұрады, промотор РОІ ІІІ- құрылымдық геннің маңайында. Б) модуляторлар- транскрипцияны тездететін ДНҚ тізбегі; в) күшейткіштер-транскрипция деңгейін тездететін және өзінің озінің геннің кодталатын аймағына тәуелсіз әрекет ететіндер; г) терминаторлар- транскрипция, трансляцияны тоқтататын арнайы тізбектер.
Бұл тізбектер өздерінің біріншілік құрылымы мен орналасуына байланысты прокариоттардан ерекшеленеді, бактериялық РНҚ полимераза оларды «танымайды».
30. Вирустарды бөгде ДНҚ-ны енгізуге қолданылатын векторлар ретінде қарастырыңыздар.
Жасушаны өлтірмей, жасуша иесінің геномына кіріп алып, онымен бірге көбейіп, немесе олардың бақылаусыз өсуін туғызады, яғни оларды ісік жасушасына айналдырады. Оларға SV-40 ДНҚ вирусы мен полиома жатады. Кейбір РНҚ ісік жасушасын енгізу вирустық бөлшектердің жасушадан олардың лизисінсіз жинақталуына алып келеді. Бұндай вирустарға ретровирустар )Раус саркома вирусы, ЖИТС). Бактерия жасушасына вектор ретінде бактериофагтарды қолданады.
Вирустар бөгде ДНҚ-ны енгізуге қолданылатын векторлар ретінде негізгі кандидат бола алады. Вирустық инфекция кезінде әрбір жасуша бөгде геннің көп мөлшерін қабылдап алады. ДНҚ-ны генге қатаң вирустық промоторлердің бақылауында болатындай етіп орналастыруға болады, бұл ген экспрессиясының жоғарғы деңгейін қамтамасыз етеді және олардың өнімдері тексеруге қолалы болады.
Соңғы жылдары көптеген «мақсатты» векторлар және жануарлар және бактериалдық жасушаларға репликациялана алатын және жануар жасушасына экспрессирленетін клондалған гендер рекомбинантты туындылары көп қолданылады. Кең таралған векторлар рBR322 плазмидасынан және SV40 ДНҚ-сының транскрипциясының ерте интактті аймағынан тұрады,ал қажет ген соңғы гендердің промотерлерінің бақылауында орналасады. Мысалы, SV40 ДНҚ-сына қоянның В-глобин генін енгізген, ол ген рекомбинантты виуспен зақымдалған маймыл жасушаларының линияларына экспрессияланған болатын: жасушада глобин генінің аРНҚ-сы да, белоктың өзі де түзілген.
Вирус ДНҚ-мен рекомбинацияланғаннан кейін өмір сүруге қабілетті болу керек. Вирустардың кемшілігіне олардың аз көлемі жатады. Сонымен қатар вирустар иелердің аз түрлерін зақымдайды.
ДНҚ фаг пен плазмидасынан тұратын гибридті векторлар бар. Оларға космидалар мен фазмидаларжатады.
Космидалар-λ-фагтің геномы енген плазмидті векторлар, ол ДНҚ молекуласының фаг бөлшектеріне еніп, орналасуына мүмкіндік береді. Фаг бөлшектері гибридті ДНҚ-ның жасушаға (инъекция жолымен) енуін жақсы қамтамасыз етеді, одан кейін ДНҚ-ның сақинаға тұйықталуы мен оның плазмидалы типке репликациялануы жүреді.
Фазмидалар да плазмидалар мен фагтың гибриді болып табылады. Бөгде ДНқ-ны енгізгеннен кейін белгілі бір жағдайда фагтар, ал басқа жағдайда –плазмидалар дамиды.
Вириоидтар
Тәуелсіз репликациялана алатын өте кішкене вирустар геном өлшемімен бірдей, молекулалық массасы 1М, яғни 1500 мың жұп негіздер. Бұны вирустың өнімдерін кодтау мен жасуша иесінің метаболизмін төмендетугеқажетті генетикалық ақпараттың аз мөлшері деп есептеген.
Алайда 1971 жылы 270-300 нуклеотидтерден тұратын, белоктық қабықшамен қапталмаған сақиналы РНҚ-мен ковалентті байланысқан 1 жіпті қысқа тізбекті инфекциялық агенттер табылған. Олар ерекше патогендер-өте қарапайым және өте кішкене бөлшектер.
Вириоидтардың зақымдалған өсімдіктерде ауру симптомдарын қалай тудыратыны әлі белгісіз. Олар клетка –иесінің ферменттерімен репликацияланады, арнайы полипептидтерге трансляцияланбайды, жасуша-иесінің геноына интеграцияланады.
Вириоидтар персистентті әсер етеді. Жүйелі инфекцияны қамтамасыз етеді, яғни енгізу сайтынан өсімдіктің басқа бөлшектеріне миграцияланады, механикалық жолмен немесе жасуша шырынымен , тұқыммен, тозаңмен таралады. Вириоидтар өсімдіктің ядролық фракцияларымен байланыады, ядрода да тарала алады.
Вириоидтармен жұмыс істегенде 1-тізбектң ДНҚ-дан –РНҚ көшірмесін алады, оған комплементарды тізбекті орналастырады да вириоидтың 2-тізбекті ДНҚ -сы алынады. Бұндай екі тізбекті ДНҚ плазмидаға орналасып, Е.Coli жасушасына клондауға жіберіледі. Генді санау ДНҚ-ның РНҚ-ға транскрипциясын қамтамасыз ететін РНҚ полимераза танитын промотерден басталады. Әдетте бұл ДНҚ фрагменті 41-44 негізден тұрады. Ген солдан оңға қарай 5`-3` бағытында саналады және геннің терминацияланатын аймағында аяқталады. Бактериялар гендері мен жоғарғы органзмдердің гендерінің промоторлық аймақтары нуклеотидтердің қысқа тізбегінен тұрады.
Бір тізбекті және екі тізбекті ДНҚ механикалық инокуляцияланған темекідегі вириоидтардың репликациясын иницирлеуге қабілетті. Өсімдіктер үшін жоғары инфекциялық РНҚ вириоидтары in vitro жолымен синтезделген. Вириоидар қожайынын бүкіл тіршілік циклінде инфицирлей алады, өйткені вириоидты векторлардың жүйесін қолданғанда өсімдікте бөтен геннің тұрақты экспрессиясын байқауға болады.
Агробактериялардың плазмидалары
Векторлар ретінде бактериялардың ісік тудыратын плазмидаларын қолдануға болады. Agrobacterium түйнек бактерияларына эволюциялық туыс, Rizobium тобына жатады. Алайда агробактериялардың өсімдіктермен әсері өзіндік ерекшеліктерге ие.
Agrobacterium түрлерінің өсімдіктермен байланысы ерекше қызығушылық тудырады, өйткені паразитизмнің бұл түрінде партнерлердің біреуі өзінің генін қожайынның геномына енгізіп қасиеттерін өзгертеді. Сонымен қатар бұл ДНҚ-ның поркариоттардан эукариоттар жасушасына миграциясының еркңн мысалы бола алады.
Митохондриялар мен хлоропластардың ДНҚ-сы.
Хлоропластар мен митохондриялар толыққанды генетикалық жүйеге ие, яғни генетикалық ақпаратты экспрессиялауға қабілетті барлық компоненттер бар: ДНҚ, ДНҚ-полимераза, РНҚ-полимераза және белоксинтездейтін аппарат (рибосома, т-РНҚ, аминоацил-тРНҚ-синтетаза).
Хлоропластық және митохондриалды ДНҚ да ғалымдарды генді жасушаға тасымалдаушы ретінде қызықтырады. Бұл жасушалық субгеномдардың құрылымдық ұйымдасуы ерекшеленеді.
Хлоропластар және басқа пластидтер және басқа пластидтер бірдей генетикалық ақпаратқа ие, олар пластома деп аталады. Жоғарғы өсімдіктерде олар ДНҚ-ның 150т ж. н. ұзындығындағы тұйық молекуласы түрінде болады. Пластидтерді синтездеуде белоктардың көп мөлшері қажет. Басқа белоктар ядрода кодталады, цитоплазмада синтезделеді, хлоропластарға транспортталады, олар басқа полипептидтармен бірігеді. Функционалды активті хлоропластың биосинтезі үшін геном мен пластомның келіскен эксрпессиясы қажет.
Өсімдіктердің гендері де E.Coli жасушасында экспрессиялануға қабілетті. РБФК суббірлігінің үлкен гені. Хлоропластық гендердің артықшылығына Хлоропластық гендердің артықшылығына ішек таяқшасының жасушасындағы экспрессиясы транскрипцияланатын негіздердің қарапайым ққосылуы арқылы жүзеге асады, яғни хлоропластар ДНҚ-сы мен бактерияларда старт кодондардың трансляциясының басында бірдей нуклеотидтік тізбектер орналасқан. Бұл өсімдіктің экономикалық маңызды полипептидтерін прокариоттардың жасушалары арқылы синтездеуге мүмкіндік береді.
Хлоропласты ДНҚ-ға қарағанда митохондриялы ДНҚ әр түрлі өасиетке ие және өлшемдері 200-ден 2400 ж.н. өзгереді. Алайда митохондриялы геном мен белоктық өнімдердің арасындағы корреляциясы байқалмайды.
Митохондриялы ДНҚ құрамында құрылымдық гендер, кодтаушы полипептидтер, рибосоманың және транспорттық РНҚ-ның гендері бар. Алайда митохондриялардың да хлоропластардың да белоктары ядролық гендармен кодталады. Егер хлоропластардың геномы ірі сақиналы молекуланың гомогендң популяциясымен қсынылса, онда митохондрияларда сақиналы молекулалардың біпнеше класы бар, бірақ олардың функциялары әлі белгісіз.
Жануарлардың митохондриалды геномы сәл аздау, 15-19ж.н. және құрылымы бойынша консервативті. Митохондриялардың гендері белгілердің екі тобын кодтайды-тыныс алу жүйелерінің және антибиотиктер мен басқа уларға төзімділігін қамтамасыз етеді. Өсімдіктердің митохондриалды геномында цитоплазманың аталық ұрықсыздығына жжауап беретін гендер бар.
Дата добавления: 2018-02-15; просмотров: 3673; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
