Тема 24. Санитарно-микологические исследования кормов
Цель занятия. Изучить принципы микологического исследования кормов с целью определения их пригодности для скармливания.
Практические навыки. Научить студентов определять и дифференцировать роды плесневых грибов.
Материалы и оборудование. Лабораторные весы, термостат, шуттель-аппарат, шприц с иглами, химические стаканы, стерильные пробирки, пипетки, чашки Петри, фарфоровые ступки, ватно-марлевые фильтры, питательные среды, индикаторные бумажки, лабораторные животные (белые мыши и т.д.), культуры инфузорий, рыбы гуппи, экстракт корма.
Задание. 1. Провести органолептическое и микроскопическое исследования пораженных грибами кормов.
2. Выполнить первичное выделение грибов из корма.
3. Микроскопия посевов проб кормов.
Санитарно-микологический контроль кормов включает отбор проб для исследования, органолептический анализ, определение токсичности кормов, микологическое исследование кормов, определение токсичности выделенных культур грибов.
Пробы кормов отбирает комиссия с участием зоотехнических, ветеринарных специалистов и представителей хозяйств или предприятий, а в конфликтных ситуациях – с участием представителей поставщика. Отбор средних проб кормов проводят в соответствии с действующими стандартами. Отобранную среднюю пробу делят на 2 части не менее 1 кг каждая, упаковывают в чистые сухие банки и опечатывают. Одну часть пробы с актом комиссии и сопроводительным документом направляют для исследования, вторую оставляют в хозяйстве. Для микологического исследования отбирают пробы всех кормов, входящих в рацион в течение одного месяца до появления болезни.
|
|
|
На основании органолептического анализа считаются недоброкачественными:
– сено и солома, содержащие в непрессованном виде более 10% горелых, заплесневелых, с затхлым запахом участков, а в спрессованном - более 10% кип с прослойкой заплесневелой соломы (сена) с затхлым запахом;
– комбинированные корма, отруби с затхлым или плесневым запахом, а подвергшиеся самосогреванию - комковатые;
–мякина, жмыхи и шроты с затхлым, плесневым или гнилостным запахом, часто с измененным цветом;
– корма животного происхождения с плесневым или гнилостным запахом, комковатостью:
– силосованные корма, местами покрытые грибными налетами различного цвета в зависимости от вида гриба - красный (Fusarium), зеленый различных оттенков (Aspergillus, Penicillium), черный (Alternans и др.).
Определение токсичности кормов. Стандарт устанавливает основной (арбитражный) метод определения токсичности по кожной пробе на кроликах и взаимозаменяемые ускоренные методы – по биопробе на инфузориях Tetrachymena pyriformis, Stylonychia и Coproda steinii и др.
|
|
|
Для определения токсичности зернофуража, продуктов переработки зерна, грубых, комбинированных кормов и силоса основным методом (кожная проба) сначала готовят экстракт из образцов кормов одним из следующих способов:
1. 50 г измельченного корма помещают в гильзы (пакеты) из фильтровальной бумаги и экстрагируют в аппарате Сокслета эфиром (петролейным или серным) в течение 6 ч. Экстракт переносят в бюксу и конденсируют при комнатной температуре (в вытяжном шкафу) до исчезновения запаха растворителя;
2. При отсутствии аппарата Сокслета 50 г измельченного корма помещают в поллитровую банку с притертой пробкой и заливают эфиром, спирт-эфиром (1:3), бензолом или метанолом так, чтобы жидкость покрывала пробу корма на 2–3 см. Экстрагируют в течение 24 ч при комнатной температуре, периодически встряхивая. Затем жидкость сливают в бюксу и оставляют в вытяжном шкафу до полного испарения растворителя. Для ускорения испарения растворителя сосуды с экстрактами ставят в водяную баню и выпаривают при температуре 45–50 0С.
Экстракт из зерна и продуктов его переработки имеет вид растительного масла, желтого или коричневого цвета. Экстракт из грубых кормов (желтого или зеленого цвета) имеет крошковатую консистенцию, поэтому перед постановкой кожной пробы в него добавляют 2 капли растительного масла.
|
|
|
Постановка кожной пробы на кроликах. Для постановки кожной пробы используют кроликов (серых, белых) весом не менее 1,5–2 кг с непигментированной кожей. За несколько часов до постановки опыта в области боков выстригают до полного оголения шерсть на участке размером 6х6 см (на каждом боку допускается испытание не более 3 проб, в зависимости от величины кролика). Нанесение экстракта на травмированные участки кожи не допускается. Повторное использование бывших под опытом кроликов допускается после того, как оголенный участок кожи покроется шерстью и будет пигментирован.
На оголенную, гладкую неповрежденную поверхность кожи кролика наносят экстракт и слегка втирают его в кожу стеклянной палочкой или шпателем. Экстракт наносят двукратно с интервалом 24 ч, и за животными устанавливают ежедневное наблюдение. Для предупреждения слизывания нанесенного экстракта на шею кролика надевают фанерный или картонный воротник. Наблюдение за реакцией продолжают в течение 3–5 суток.
Токсичность исследуемых кормов определяют по наличию воспалительного процесса на участке нанесения экстракта: нетоксичный корм – отсутствие воспалительной реакции или наличие гиперемии, сохраняющаяся не более 2 суток после нанесения экстракта и не сопровождающейся шелушением кожи; слаботоксичный корм – гиперемия, сохраняющаяся 2–3 суток, заканчивающиеся шелушением кожи или гиперемия, болезненность и отечность, проявляющаяся незначительным утолщением кожи с последующим образованием отдельных чешуек; токсичный корм – резкая гиперемия, болезненность, складчатость, отек, проявляющиеся сильным утолщением кожи, по всей поверхности участка появляются язвы, затем сплошной струп.
|
|
|
Введение экстракта корма в желудок белым мышам. Для определения токсичности отрубей, жмыхов, шротов и кормов животного происхождения экстракты их этих кормов вводят в желудок белым мышам, для чего пробу корма помещают в колбу (жмых предварительно измельчают), заливают стерильным физраствором в соотношении 1:2 – 1:5 (в зависимости от вида корма), оставляют при температуре 4–6 0С на 24 ч, периодически встряхивая, затем массу отжимают и экстракт фильтруют через двойной марлевый фильтр.
Полученную таким образом вытяжку по 0,5 мл вводят ежедневно в течение 3 дней в желудок натощак через зонд 3–6 мышам. Зондом служит надетая на шприц тупая, слегка согнутая игла длиной 3–4 см (или такая же игла с наплавленной на конце оливой диаметром 1мм).
Скармливание кормов подопытным животным. Для определения токсичности зерна путем скармливания используют цыплят в возрасте от 10 до 15 дней, утят – в 10-дневном возрасте, молодых самцов мышей – весом 20–25 г, а при определении токсичности сена – молодых морских свинок и кроликов.
Суточную норму кормов заменяют исследуемым кормом и скармливают его опытным животным не менее 10 дней подряд.
Токсикоз проявляется быстрее, если пораженный корм скармливать подопытным животным на голодный желудок; для этого перед опытом животных оставляют на 5–6 ч без корма (дачу воды не ограничивают).
Проба на рыбах гуппи. Принцип метода основан на извлечении из зернофуража ацетоном жиро-и водорастворимых фракций токсических веществ и в последующем воздействии этих фракций на рыб гуппи. Метод позволяет определять токсичность зернофуража в течение 24 ч.
Пробу зернофуража в количестве 50 г тщательно измельчают на лабораторной мельнице, помещают в плоскодонную колбу с притертой пробкой, заливают 100 мл ацетона и экстрагируют при встряхивании на шуттель-аппарате в течение 2 ч. Экстракт фильтруют через бумажный фильтр в фарфоровую чашку (экстракты из кукурузы и проса фильтруют дважды) и выпаривают под тягой в водяной бане (55-60 0С) досуха. Сухой остаток растворяют в 5 мл ацетона и переносят его в стеклянную емкость с 500 мл аквариумной воды комнатной температуры (17-20 0С). В раствор помещают 5 гуппи независимо от пола и возраста, за которыми наблюдают в течение 24 ч. Рыбок, вышедших из опыта, выбраковывают. Степень токсичности исследуемого зернофуража определяют по таблице 36.
Таблица 36
Оценка степени токсичности исследуемого корма
| Степень токсичности корма | Число погибших гуппи | Время гибели, ч |
| Нетоксичен | не более 1 | до 24 |
| 1 (очень слабо токсичен) | 2–3 | 12–24 |
| 2 (слабо токсичен) | 4 | 4–8 |
| 3 (токсичен) | 5 | 2–4 |
| 4 (резко токсичен) | 5 | 1 |
Для контроля используют 1 %-ный водный раствор ацетона, в котором гуппи в течение 3 суток должны оставаться живыми.
Проба на инфузориях тетрахимена пириформис. Выполняют экстрагирование токсических веществ ацетоном из проб корма. Исследования каждой пробы проводят 3 раза. В флаконы для антибиотиков вносят по 1 мл экстракта, приливают 0,1 мл 3–5 суточной культуры инфузории тетрахимена пириформис и оставляют при комнатной температуре. Через 30 и 60 мин. подсчитывают эффект биопробы в капле, взятой пастеровской пипеткой на предметном стекле под микроскопом, просматривают весь объем капли и всех ее слоев.
Степень токсичности корма: не токсичный корм – гибель и никаких морфологических изменений в инфузориях не происходит в течение 60 мин. наблюдений; слаботоксичный корм – морфологические изменения и частичная (от 25 до 30%) гибель инфузорий в течение 30 мин. наблюдений; токсичный корм – гибель всех инфузорий в течение 60 мин. наблюдений.
Микологическое исследование кормов
Микологическое исследование включает в себя: выделение грибов из корма, количественный учет и дифференциацию их, выделение чистых культур из первичных посевов.
Для первичного выделения грибов из мучнистых кормов, зернофуража используют обычно агаровую среду Чапека. Для дифференциации видов и разновидностей грибов в каждом отдельном случае используют специальные методы и приемы культивирования.
Заражение зерен грибами может быть поверхностным – заспорение и глубинным – поражение.
Для выделения глубинного поражения проводят дезинфекцию зерен 3 %-ным раствором формалина: 50 шт. зерен, завернутых в марлевую салфетку, помещают в стаканчик с дезинфицирующим раствором. Через 5–7 мин. их переносят в стаканчик со стерильной водой, к которой для нейтрализации формалина добавляют 2–3 капли 5 %-ного раствора аммиака, затем воду сливают, слегка раздвигают марлю и стерильным пинцетом раскладывают зерна на поверхности агара Чапека так, чтобы они не соприкасались друг с другом (нельзя перемещать зерна по поверхности среды).
Мелкие зерна (пшеница, овес, ячмень, рожь, просо и др.) раскладывают по 10 штук на чашке, более крупные (кукуруза, бобы, горох) – по 5 штук. Крупные зерна после дезинфекции необходимо разрезать пополам или расщеплять. Число чашек при посеве мелких зерен должна быть не менее 5, а при посеве крупных – не менее 10.
Для выделения грибов их грубых кормов применяют влажные камеры. На дно чашки Петри кладут тонкий слой ваты и на нее помещают кружок фильтровальной бумаги (по диаметру чашки), затем чашку стерилизуют и перед посевом фильтровальную бумагу увлажняют небольшим количеством стерильной среды Ван-Итерсона или стерильной водой.
Солому, сено нарезают кусочками длиной по 2 см и переносят стерильным пинцетом во влажную камеру, по 10 кусочков в каждую чашку. Чашек должно быть не менее 5. Параллельно делают посев на 2 чашки агара Чапека для выделения других сапрофитных грибов.
Одновременно с посевом кормов проводят контроль зараженности грибами воздуха в боксе, где проводили посев, для чего чашку со средой оставляют открытой в течение 3 мин.
Нарезанный силос и измельченный жмых для выделения грибов раскладывают по 10 кусочков в чашку на поверхность агара Чапека.
Для выделения грибов из муки, отрубей, комбикорма, шрота, мясо-костной муки и рыбной муки пользуются методом разливки. 10 г мучнистого корма помещают в стерильные колбы, куда добавляют 10 мл стерильной воды и получают таким образом основное разведение 1:10. Колбу с содержимым взбалтывают на шюттель-аппарате или вручную в течение 15–20 минут. Из основного разведения на стерильной воде готовят разведение 1:100, 1:1000, 1:10000 и т. д. Комбикорм обычно сеют в разведении 1:1000 на питательную среду в 5 чашек; при большой степени поражения грибами – в разведении 1:10000 в 8–10 чашек. Для каждого высеваемого разведения берут отдельную стерильную пипетку.
Из готового разведения вносят в чашки Петри по 1 мл, при этом материал распределяют каплями на дне чашки. В чашки заливают по 10 мл расплавленного, остуженного до 40–50 0С агара Чапека. Круговыми движениями чашек материал равномерно распределяют в агаре.
Посевы всех грибов выдерживают при температуре 22–25 0С. Чашки просматривают на 3,5 и 9-е сутки после посева. На 2–3-й день после посева начинают количественный подсчет колоний грибов.
Выделение чистых культур грибов из посевов. При появлении роста грибов проводят отсев культур в чашки Петри с соответствующими средами для определения и дальнейшего изучения грибов. Для этой цели применяют следующие методы:
1. Иглой, изогнутой под тупым углом, осторожно захватывают кусочек мицелия и помещают его на поверхность питательной среды, при этом следует избегать комкания, скручивания или прочих деформаций подхваченного кусочка мицелия;
2. При наличии обильного спороношения у гриба сухой иглой переносят минимальное количество спор (метод «сухой иглы»).
При работе с грибами нельзя производить посевы штрихом, а тем более зигзагообразным штрихом. Допускается только легкое касание в одном месте (если посев проводится в пробирку, то посередине ее) поверхности среды иглой, несущей споры или мицелий.
Метод непосредственного пересева возможен только тогда, когда в чашке с первичными посевами имеются достаточно чистые колонии или когда необходимо возобновить культуру для длительного поддержания культуры гриба;
3. В случае, если колония загрязнена другими грибными организмами, применяют методы разделения. Один их основных методов разделения - метод последовательного разведения суспензии спор гриба. Последнее разведение в количестве 1 мл разливают в стерильную чашку Петри, куда добавляют 10 мл расплавленной и остуженной до 40–45 0С среды. Число разведений зависит от степени загрязнения колонии. Если загрязнение невелико, можно ограничиться просто пересевом суспензии спор гриба, не прибегая к ее разведению.
После истечения срока культивирования гриба изучают колонии. При этом обращают внимание на цвет, окраску субстратного мицелия, на наличие или отсутствие пигмента, на форму колоний, характер их роста (распростертые или компактные), на растущий край (гладкий или извилистый), на степень развития воздушного мицелия.
Микроскопическое исследование грибов проводят прежде всего непосредственно в чашках, пользуясь только малым увеличением микроскопа. Затем готовят препараты для длительного изучения морфологии гриба. Частицы гриба берут из различных мест колонии, в зависимости от вида гриба. Желательно брать материал из старых частей колонии (у центра) и одновременно из более молодых частей (у края).
На чистое предметное стекло наносят каплю смеси спирта, воды и глицерина (в равных соотношениях). Затем иглой осторожно берут небольшое количество мицелия гриба, стараясь не повредить его, и вносят в каплю жидкости, аккуратно снимая его другой иглой. Препарат накрывают покровным стеклом и, оттянув язычок жидкости кусочком фильтровальной бумаги, изучают вначале под малым, а затем под большим увеличением.
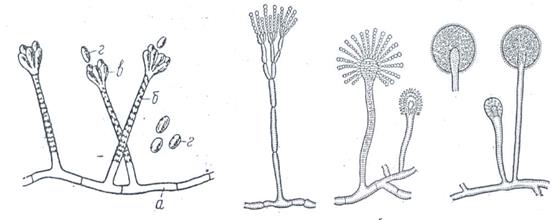 |
1 2 3 4
Рис. 49. Плесневые грибы: 1 – Stachybotrуs alternans (а – мицелий, б – конидиеносец, в – стеригмы, г – конидии); 2 – Penicillium; 3 – Aspergillus; 4 – Mucor.
При изучении морфологических особенностей грибов рода Stachybotrуs установлен септированный мицелий и плодовые тела, представленные стеригмами, располагающимися в виде розетки по 6-8 штук, и овальными спорами – конидиями. У грибов рода Penicillium мицелий и конидиеносец септированные (многоклеточные), органы плодоношения в виде кисточки («кистевидная плесень»). Верхняя часть конидиеносца разветвленная на конце образует стеригмы, от которых отшнуровываются конидиеспоры. Род Aspergillus характеризуется септированным мицелием и одноклеточным конидиеносцем, на верхнем его конце веерообразно расположен ряд коротких стеригм. От стеригм отшнуровываются цепочками экзоспоры – конидии («леечная плесень»). Морфологическими элементами грибов рода Mucor являются несептированный широкий мицелий, зооспоры и шарообразные плодовые тела с спорангиеспорами.
Токсичность культур грибов выявляют на парамециях, кожной пробой на кролике, введением различными способами культур грибов мышам, на рыбах.
С помощью парамеций устанавливают первичную токсичность культур как известных (Fusarium, Stachybotrуs, Dendradochium, Aspergillus и др.), так и выделением из корма первичных грибов.
Среда для культивирования парамеций (Paramecium caudatum) – сенной настой. Для его получения нарезанное кусочками сено (без цветков) помещают в колбу, заливают водопроводной водой в соотношении 1:2 по объему, закрывают ватной пробкой и кипятят в течение 20 минут. Затем колбу помещают в термостат при 22–25 0С на трое суток для накопления в воде сенной палочки (Bac. subtilis), которая служит кормом для парамеций. После этого в полученную среду вносят каплю с парамециями. Культивируют их при комнатной температуре, на новую среду пересевают через месяц.
Определение токсичности культур грибов на парамециях. Из культуры грибов, выращенных на среде Чапека, сусловом агаре и других средах, готовят водные экстракты. Для этого пленки грибов снимают с поверхности агара, освобождают от него, измельчают, помещают в пробирку и заливают дистиллированной или стерильной водопроводной водой в соотношении 1:1, встряхивают и оставляют при температуре 4–10 0С на 24 ч. Вода, используемая для приготовления экстрактов, должна быть нейтральной реакции и без посторонней примеси. Нельзя применять физраствор, так как парамеции чувствительны к соли.
Две капли экстракта из культуры гриба наносят на предметное или часовое стекло и добавляют одну каплю среды с парамециями. Все три капли должны быть одинаковыми по объему, поэтому их наносят градуированной пипеткой.
Предметное или часовое стекло помещают в чашки Петри с фильтровальной бумагой, смоченной водой. Гибель парамеций определяют по прекращению их движения и наличию распада.
Для быстрого определения токсичности грибов берут кусочек колонии гриба, выросшего в чашке Петри при первичном посеве корма, переносят на предметное стекло шпателем или петлей, измельчают, заливают несколькими каплями дистиллированной воды и смешивают. Через два часа пленку гриба удаляют или отодвигают в сторону и вносят овоскопической иглой или пипеткой жидкость с парамециями. Наблюдение за поведением парамеций проводят не более 2 часов.
Гибель парамеций под воздействием экстрактов из культур грибов наступает: для резко токсичных грибов в течение 3 минут, токсичных – от 1 до 20 минут, слабо токсичных – до 2 часов, не токсичных – более 2 часов.
Контрольные вопросы. 1. Микологические исследования кормов, определение родов грибов. 2. Методы определения токсичности кормов и выделенных плесневых грибов.
Дата добавления: 2021-04-07; просмотров: 333; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
