Тема 18. Методы улучшения качества питьевой воды
Цель занятия. Изучить методы очистки и обеззараживания воды, практически провести очистку и обеззараживание воды.
Практические навыки. Освоить и уметь применять на практике методы пробной коагуляции и пробного хлорирования воды.
Материалы и оборудование. Пробы воды, колбы, стаканы, пипетки. Определение дозы коагулянта: 1 %-ный раствор сульфата алюминия, 1 %-ный раствор соды, 0,1 н. раствор соляной кислоты, 0,15 %-ный раствор метилоранжа. Определение содержания активного хлора в хлорной извести: 0,01 н. раствор и сухое вещество тиосульфата натрия (гипосульфит натрия (Na2S2O3 ∙ 5 Н2О)), 5 %-ный раствор и 25 %-ный раствор серной кислоты, 10 %-ный раствор иодида калия, 1 %-ный раствор крахмала, 1 %-ный раствор хлорной извести.
Задание. 1.Для данного образца воды определить дозу коагулянта.
2. Приготовить 1 %-ный раствор хлорной извести и определить в нем содержание активного хлора.
3. Установить дозу 1%-ного раствора хлорной извести для обеззараживания питьевой воды путем пробного хлорирования.
4. Провести гиперхлорирование, определить остаточный хлор с расчетом дозы гипосульфита для дехлорирования.
Методы очистки воды. Использование природных вод открытых водоемов для хозяйственно-питьевого водоснабжения требует предварительного улучшения свойств воды и ее обеззараживания. Применяемые специальные методы обработки воды включают умягчение, опреснение, обезжелезивание, фторирование, обесфторирование, дезодорацию, дезактивацию, дегазацию.
|
|
|
В результате обработки воды на водопроводных станциях она освобождается от взвешенных частиц, запаха, привкуса, микроорганизмов и различных примесей.
Для улучшения качества воды проводят ее осветление, обесцвечивание обеззараживание. Осветление и обесцвечивание достигаются очисткой, которая осуществляется механическим (отстаивание), физическим (фильтрование) и химическим (коагуляция) методами.
Коагуляция является наиболее эффективным методом очистки воды и выполняется путем добавления в нее коагулянтов, специальных веществ, реагирующих с карбонатами кальция и магния и подвергающихся гидролизу с образованием хлопьев. Хлопья выпадают в осадок, увлекая за собой взвешенные частицы и бактерии. В качестве коагулянтов широко используется сульфат алюминия (глинозем), полиакриламид и др.
Определение дозы коагулянта. Предварительно определяют карбонатную жесткость воды. Для этого в колбу наливают 100 мл исследуемой воды, 3 капли 0,15 %-ного раствора метилоранжа и титруют 0,1н. раствором соляной кислоты до появления слабо розового окрашивания. Количество миллилитров соляной кислоты, пошедшее на титрование, умножают на 2,8 , чтобы получить величину карбонатной жесткости в градусах. Если жесткость воды выше 40, приступают к выбору необходимой дозы коагулянта.
|
|
|
Al2(SO4)3 + 3Ca(HCO3) 2 = 2Al(OH)3 + 3CaSO4 + 6CO2
В 3 стакана наливают по 200 мл мутной воды. В первый стакан вносят 2 мл, во второй – 3 мл, в третий – 4 мл 1 %-ного раствора глинозема – Al2(SO4)2 (или на каждый 10 карбонатной жесткости 0,8 мл 1 %-ного раствора глинозема). Содержимое стаканов перемешивают стеклянной палочкой и наблюдают за характером хлопьеобразования в течение 10 минут. Выбирается наименьшая доза коагулянта, обеспечивающая быстрое образование и осаждение хлопьев. Если процесс происходит слишком быстро (менее 5 минут) и крупные хлопья не успевают образоваться, следует провести повторное исследование с меньшим количеством глинозема. При отсутствии заметной коагуляции во всех стаканах опыт повторяют с большими дозами.
При карбонатной жесткости воды менее 40 перед пробной коагуляцией в воду добавляют 1 %-ный раствор соды в количестве, составляющем половину дозы коагулянта (1,0; 1,5 и 2,0 мл).
При вычислении количества 1 %-ного раствора глинозема для коагуляции наименьшую дозу его умножают на 5 и на количество воды, подлежащей коагуляции.
|
|
|
Пример расчета потребного количества коагулянта: Если коагуляция лучше всего прошла во втором стакане, куда на 200 мл воды было внесено 3 мл 1 %-ного раствора глинозема, то коагуляция 1 л воды потребует 3 мл ∙ 5 = 15 мл 1 %-ного раствора. Поскольку 1 мл 1 %-ного раствора содержит 0,01 г вещества, это соответствует 0,15 г глинозема на 1 л воды (0,01г ∙ 15мл = 0,15г).
Обеззараживание воды. Для обеззараживания воды применяют химические (реагентные) методы - хлорирование, озонирование, использование олигодинамического действия серебра, а также физические (безреагентные) методы - кипячение, ультрафиолетовое облучение, ультразвук, токи высокой частоты и т.д.
Наиболее простым, надежным и широко распространенным методом обеззараживания воды является ее хлорирование. Обработка воды проводится соединениями хлора – газообразным хлором Cl2, хлорной известью Ca(OCl)2 ∙ СаO ∙ H2O, гипохлоритом кальция Ca(OCl)2, хлораминами (RNHCl2 и RNH2Cl). Во всех случаях при контакте этих соединений с водой выделяется хлорноватистая кислота HOCl, которая частично диссоциирует в воде с выделением гипохлорит-иона OCl-. HOCl и OCl- обусловливают бактерицидное действие хлора и его соединений и рассматриваются как «активный» хлор. Антимикробный эффект активного хлора связывают с его окислительным действием на вещества, входящие в состав бактериальной клетки, и прежде всего на энзимы, регулирующие окислительно-восстановительные процессы. Вслед за этим происходит деструкция протоплазмы бактериальной клетки.
|
|
|
Определение содержания активного хлора в хлорной извести. При хранении под действием углекислого газа, содержащегося в воздухе, солнечных лучей и др., гипохлорит кальция постепенно разлагается с выделением хлора, улетучивающегося в воздух.
Поэтому перед применением хлорной извести в ней следует определять содержание активного хлора, которого должно быть не менее 28 %.
Метод определения содержания активного хлора в хлорной извести основан на том, что при действии на гипохлорит кальция серной кислоты в присутствии йодида калия выделяется хлор, который вытесняет из йодида калия эквивалентное количество йода. Выделившийся йод титруют в присутствии крахмала 0,01 н. раствором гипосульфита натрия до исчезновения синей окраски.
По количеству гипосульфита натрия, израсходованного на титрование, рассчитывают количество хлора, содержащегося в навеске хлорной извести, взятой для определения.
Подготовка к исследованию. Из разных мест бочки (или ящика) с хлорной известью отбирают образцы, тщательно смешивают, отвешивают 1 г хлорной извести и готовят 1%-íûé водный раствор ее. После перемешивания с водой раствор оставляют до следующего дня в закрытой посуде.
Для анализа пипеткой отбирают 1 мл отстоявшегося прозрачного раствора хлорной извести, переносят в чистую колбу. Добавляют 50 мл дистиллированной воды, 1 мл раствора 5 %-ной серной кислоты и 2 мл 10 %-ного раствора йодида калия. Колбу закрывают, хорошо перемешивают и через 5 мин при наличии интенсивного желтого окрашивания приступают к титрованию раствором гипосульфита натрия. Вначале титруют до слабо-желтого окрашивания, после чего прибавляют 1 мл раствора крахмала и продолжают титрование до исчезновения синей окраски.
Содержание хлора в хлорной извести рассчитывают по формуле:
Х = А ∙ 0,355 ∙ 100 ∙ 100 / 1000,
где X – содержание активного хлора в хлорной извести, %; А – количество 0,01 н. раствора гипосульфита натрия, пошедшее на титрование жидкости, мл; 0,355 – количество хлора, соответствующее 1 мл 0,01 н. раствора гипосульфита натрия, мг; 100 – коэффициент перевода содержания хлора в 100 мл приготовленного раствора хлорной извести; 100 – коэффициент перевода содержания хлора в 100 г хлорной извести; 1000 – коэффициент перевода мг в г.
Определение дозы хлорной извести для хлорирования воды. Различают несколько способов хлорирования воды:
1. Хлорирование нормальными дозами (дозы хлора устанавливается по величине хлорпоглощаемости и санитарной норме остаточного хлора);
2. Хлорирование с аммонизацией (в воду одновременно вводят хлор и аммиак для образования хлораминов);
3. Гиперхлорирование (доза хлора значительно превышает хлорпоглощаемость воды).
При обеззараживании воды нормальными дозами хлора берут такое количество хлорной извести, которое способно обеспечивать хороший бактерицидный эффект и наличие в воде 0,3–0,5 мг/л остаточного хлора после 30-минутного контакта воды с хлором летом и 1–2 часа зимой. Хлорирование воды по этому методу наиболее приемлемо при централизованном водоснабжении, так как небольшие количества остаточного хлора не изменяют органолептических свойств воды (вкус и запах) и не требуют последующего дехлорирования ( устранение избытка остаточного хлора).
Количество мг активного хлора, поглощаемого органическими веществами в 1 л воды, называют хлорпоглощаемостьюводы, которая вместе с остаточным хлором составляет хлорпотребностьводы.
Необходимая доза хлорной извести устанавливается путем опытного хлорирования воды и последующего контрольного определения в ней остаточного хлора.
Определение хлорпотребности воды. Исследуемую воду разливают по 200 мл в три стакана. В первый стакан добавляют пипеткой 1 каплю, во второй – 2 капли, в третий – 3 капли 1 %-ного раствора хлорной извести. Размешивают воду в каждом стакане отдельными стеклянными палочками и оставляют на 30 минут. Затем добавляют по 5 капель крепкой соляной кислоты, 1мл раствора йодида калия и 1мл раствора крахмала. При наличии в воде свободного хлора, оставшегося после окисления содержащихся в воде органических веществ, вода красится в синий цвет. Интенсивность окраски находится в прямой зависимости от количества свободного йода. Для хлорирования берут дозу того стакана, в котором вода окрашена в слабо-синий цвет.
Расчет. Выверяют пипетку, которой отмеривали раствор хлорной извести путем подсчета количества капель, содержащихся в 1 мл. Пользуясь следующей формулой, подсчитывают необходимое количество раствора хлорной извести на 1 л исследуемой воды:
Х = А ∙ 5 / Б ,
где А – число капель 1 %-ного раствора хлорной извести, внесенных в стакан с 200 мл воды; Б – число капель раствора хлорной извести в 1мл; 5 – число, на которое необходимо умножить взятый объем воды для приведения его к 1 л.
Зная дозу 1 %-ного раствора хлорной извести, необходимую для обеззараживания 1 л исследуемой воды, подсчитывают общее количество раствора для обработки всего объема воды, подлежащего хлорированию.
Определение содержания остаточного хлора в хлорированной воде. Метод основан на окислении йодида калия активным хлором до йода, который отгитровывают гипосульфитом натрия.
В коническую колбу наливают 200 мл хлорированной воды. Добавляют 2 мл 25 %-ного раствора серной кислоты, 1 мл 10 %-ного йодида калия и 5 капель крахмала. Посиневшую жидкость титруют 0,01 н. раствором гипосульфита натрия до обесцвечивания (очень медленно).
Содержание остаточного активного хлора вычисляют по формуле:
Х = а ∙ К ∙ 0,355 ∙ 5 ,
где Х – содержание остаточного активного хлора, мг/л; а – количество 0,01 н. раствора гипосульфита натрия, израсходованное на титрование, мл; К – поправочный коэффициент нормальности раствора гипосульфита натрия; 0,355 – количество активного хлора, соответствующее 1 мл 0,01 н раствора гипосульфита натрия, мг, 5 – коэффициент перевода на 1 л воды.
Хлорирование воды повышенными дозами (гиперхлорирование) применяется обычно в полевых условиях особенно при неудовлетворительных органолептических свойствах воды или неблагоприятном санитарно-топографическом окружении водоисточника, а также при наличии случаев инфекционных заболеваний в районе.
Для гиперхлорирования сравнительно чистой воды выбирают дозу активного хлора около 5–10мг/л, для более загрязненных вод с высокой цветностью и низкой прозрачностью используются дозы в 10–20мг/л, при сильной загрязненности и неудовлетворительной санитарно-эпизоотологической обстановке применяются дозы 20–30 мг/л.
Обеззараживание воды повышенными дозами хлора обычно производится при помощи хлорной извести, необходимое количество которой вычисляется, исходя из намеченной дозы активного хлора и процентного содержания активного хлора в хлорной извести.
Поскольку содержание остаточного хлора при этом способе хлорирования может намного превышать допустимые дозы, а воды приобретает неприятный вкус и запах, производится удаление избытка хлора, то есть дехлорирование. Для дехлорирования применяется фильтрация воды через активированный уголь, 1 %-ный раствор перманганата калия, но чаще всего сухой гипосульфит натрия.
Количество гипосульфита, необходимое для дехлорирования избытка остаточного хлора в 1 л воды (мг/л), устанавливают по формуле:
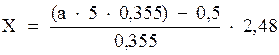 ,
,
где а – количество 0,01 н. раствора гипосульфита, израсходованного на титрование остаточного хлора в 200 мл исследуемой воды, мл; 5 – множитель для перевода расхода раствора гипосульфита на титрование 1 л воды; 0,355 – количество активного хлора, которому эквивалентен 1 мл 0,01 н. раствора гипосульфита, мг; 0,5 – количество активного хлора, которое необходимо оставить после дехлорирования (остаточный хлор); 2,48 – количество сухого гипосульфита, находящегося в 1 мл 0,01 н. раствора гипосульфита, мг.
Контрольные вопросы. 1.Способы очистки и обеззараживания воды, их гигиеническая оценка. 2. Вещества коагулянты и определение их дозы. 3. Хлорирование воды, механизм обеззараживания воды хлорной известью и способы хлорирования воды. 4. Методы определения активного хлора в растворе хлорной извести, хлорпотребности воды, остаточного хлора в хлорированной воде и дехлорирования.
Тема 19. Санитарно-биологические методы исследования воды
Цель занятия. Изучить особенности методов определения бактериальной обсемененности и санитарно-гельминтологических исследований воды.
Практические навыки. Приобрести навыки определения общей микробной обсемененности воды, определения санитарно-показательных микроорганизмов в ней, и освоить методы гельминтологического исследования воды.
Материалы и оборудование. Пробы воды, стерильные пипетки, чашки Петри и пробирки с питательными средами, термостат, автоклав, платиновая петля, воронки Гольмана, ручной насос Шнитца, колба Бунзена, микроскоп, бумажные фильтры, 30 %-ный раствор соляной кислоты.
Задание. 1.Провести посев 1 мл воды различной степени чистоты на мясо-пептонный агар, подсчитать колонии.
2. Определить коли-индекс в пробах воды различной степени чистоты. Дать сравнительную оценку результатов.
3. Провести гельминтологическое исследование воды.
4. Дать заключение о качестве воды и пригодности ее для питья.
Бактериологические исследования воды. Бактериологический анализ воды – важнейшая часть гигиенических исследований. Результаты его могут иметь решающее значение при санитарной оценке воды. С эпизоотологической точки зрения при санитарно-гигиенической оценке воды имеют значение преимущественно патогенные организмы. Однако обнаружить их даже в заведомо инфицированной воде очень трудно. Поэтому критерием оценки воды по санитарно-бактриологическим показателям является: а). определение общего числа микробов в 1 мл воды, косвенно характеризующего загрязненность водоисточника органическими веществами; б). определение степени загрязнения воды санитарно-показательными микробами кишечной группы, выражаемой титром или индексом кишечной палочки. При этом считают, что чем значительнее загрязнена вода, тем больше в ней сапрофитной и кишечной микрофлоры, и, наоборот, чем меньше она загрязнена, тем меньше в этой воде микробов, в частности кишечной палочки и, следовательно, тем меньше выражена возможность возникновения инфекционных болезней при употреблении такой воды.
При отборе проб воды для бактериологического анализа используют стерильные флаконы вместимостью 0,5 л с притертой каучуковой или корковой пробкой.
Проба должна быть исследована не позже, чем через 2 ч после ее отбора. При невозможности выполнения этих условий анализ допускается проводить не позже, чем через 6 ч после отбора пробы, сохраняя при этом пробу при температуре от 1 до 5 0С.
Определение микробного числа. Микробное число – общее количество микробов в 1 мл исследуемой воды. Это ориентировочный показатель, так как подсчитываются все находящиеся в пробе микробы без их идентификации. Оно указывает на загрязнение воды сточными водами, различными отходами, в которых могут содержаться патогенные микроорганизмы. Микробное число имеет значение при контроле за состоянием воды в одном и том же источнике в разные периоды времени, при контроле за эффективностью действия водоочистных сооружений и т.п.
Доставленную пробу воды тщательно перемешивают, стараясь не смачивать пробку. Стерильными пипетками набирают пробы для посева в чашки Петри, желательно для каждой чашки использовать отдельную пипетку. В крайнем случае можно пользоваться одной пипеткой при условии, что посев начинают с больших разведений.
Воду с небольшим загрязнением высевают в количестве от 1 до 0,1 мл непосредственно в чашки, а со значительным загрязнением разводят перед посевом стерильной водой. Для этого в пробирку с 9 мл стерильной воды вносят 1 мл исследуемой воды и тщательно перемешивают, получая первое разведение 1 : 10. После этого 1 мл воды первого разведения вносят во вторую пробирку и получают разведение 1 : 100. Так поступают до получения необходимого разведения (каждый раз берут новую стерильную пипетку). Из пробы исследуемой воды должно быть сделано не менее двух разведений в зависимости от степени ожидаемого загрязнения.
Отобранное количество воды вносят в чашку, слегка приподняв ее крышку. Одновременно ставят в водяную баню (45 0С) пробирки с МПА для рас плавления и выливают в чашку с исследуемой водой. Вращательным движением смешивают воду с агаром и ставят чашки на горизонтальной плоскости для застывания (на чашке делают пометки о пробе восковым карандашом). Чашки после застывания помещают в термостат крышкой вниз, стопками по 3–4, при 37 0С на 24 ч.
Пробы воды из открытых водоемов засевают в две чашки, которые помещают во второй термостат при 20 0С на 48 ч.
Подсчитывают колонии с помощью лупы по всей площади чашки. Если в чашке выросло свыше 300 колоний и нет посевов других разведений, можно вести подсчет при помощи счетной пластинки. Для этого чашку с колониями ставят под стекло, сняв крышку, или переворачивают вверх дном, считают колонии в 12 квадратах, в четырех центральных и в двух расположенных по четырем углам счетной пластинки. По найденным числам определяют количество колоний на всей площади чашки (последнюю измеряют и определяют по формуле ПR2) и рассчитывают содержание микроорганизмов в 1 мл исследуемой воды.
Пример: Диаметр чашки 10 см, следовательно, ее площадь равна 78,5 см2 (3,14 ∙ 52). В 12 квадратах выросло 84 колонии, т. е. на 1 см2 приходится 7 колоний, а на всю площадь чашки 78,5 ∙ 7 = 549,5. Было засеяно 0,5 мл воды, поэтому в 1 мл исследуемой воды содержится 549,5 ∙ 2 = 1099 колоний микробов. Подсчет лучше делать на двух чашках с посевом одной и той же пробы воды и взять среднее арифметическое из них.
Для определения количества микробов в воде может быть использован «прямой метод», основанный на использовании мембранных фильтров с последующим подсчетом микробов под микроскопом. Имеется модификация этого метода с применением фазово-контрастной микроскопии.
В воде незагрязненных и хорошо оборудованных артезианских скважин микробное число не превышает 10–30 , в воде шахтных колодцев – 300–400, в воде сравнительно чистых открытых водоемов – 1000–1500 в 1 мл. В водопроводной воде при достаточной очистке и обеззараживании микробное число не должно превышать 50 в 1 мл воды.
Результаты количественного определения в воде бактерий Е. coli выражают в виде коли-титра и коли-индекса.
Коли-титром называют наименьший объем исследуемой воды, в котором обнаружена кишечная палочка. Коли-индекс показывает число кишечных палочек в одном литре воды.
Обнаружение в воде бактерий группы кишечных палочек определяют бродильным методом и методом мембранных фильтров.
Ускоренный метод определения в воде кишечной палочки. Метод позволяет сократить срок анализа до 20–24 ч. Исследования ведут в два этапа: 1. посев исследуемой воды на среду накопления (пептонно-глюкозную) и выращивание на ней в течение 12 ч при температуре 42 0С; 2. пересев со среды накопления независимо от признаков роста на агаровую среду с розоловой кислотой и выращивание в течение 12 ч при 37 0С(можно при 42 0С). Для пересева пользуются платиновой петлей с большим ушком.
Приготовление среды накопления: в 1000 мл водопроводной воды растворяют при нагревании 10 г пептона и 5 г хлорида натрия, доводят до кипения, фильтруют и после этого добавляют 5 г (можно 2,5) глюкозы, рН среды должен быть 7,4–7,6. Разливают среду в пробирки с поплавками по 10 мл и стерилизуют в текучепаровом аппарате или в автоклаве при открытом вентиле.
Приготовление МПА с розоловой кислотой: на 1 л МПА (агара около 1%) вносят 50 мл желчи, 10 г лактозы и 1 г глюкозы. Все это смешивают при подогревании. рН среды должен быть 7,4–7,6. Затем добавляют индикаторы – 2 мл 1%-ного спиртового раствора бромтимолового синего и 2 мл 5%-ного свежеприготовленного спиртового раствора розоловой кислоты. Среду разливают в агглютинационные пробирки и стерилизуют при 112 0С в течение 20 мин. Перед посевами среду скашивают так, чтобы получилась косая поверхность и столбик ее был достаточной высоты (полускошенный агар). Среда в готовом виде имеет коричнево-красный цвет. При отсутствии или недостатке бромтимолового синего среда будет иметь бледно-розовую окраску. Можно готовить среду и без добавления желчи, но она не будет давать четких показаний.
Для анализа исследуемую воду, сравнительно чистую (из водопроводов, артезианских скважин, благоустроенных колодцев) засевают в пробирки в количестве 1 и 5 мл и в колбы в количестве 10, 25 и 100 мл. Воду из открытых водоемов в зависимости от предполагаемого загрязнения засевают в пробирки в количестве 0,01; 0,1; 0,2; 0,5; 1 мл или 0,001, 0,01 и 1 мл (путем разведения в стерильной воде). Встряхиванием пробирки и колбы воду хорошо смешивают со средой, стараясь в то же время заполнить засеянной средой весь объем опущенной пробирки (поплавка). Посевы помещают в термостат при 45 0С на 24 ч.
Через 24 ч делают пересев на агаровую среду с розоловой кислотой путем укола в толщу агара и проведения штриха на скошенной поверхности агара при извлечении петли. Посевы делают из всех пробирок со средой накопления независимо от признаков роста. Пробирки с посевами ставят в термостат на 12 ч (можно на 24 ч),
При осмотре пробирок в среде накопления отмечают помутнение и образование газа в маленьких пробирочках (поплавках), в пробирках с агаром – разрыв столбика и образование пены в конденсационной жидкости.
Большинство обычных сапрофитных бактерий на агаре с розоловой кислотой не растет. Если на розоловом агаре (в случае раннего пересева) не установлен рост бактерий, а в среде накопления через 20–24 ч выявлен рост бактерий кишечной палочки (помутнение, газообразование), рекомендуется делать дополнительный посев на розоловый агар из пробирок с признаками роста.
Для определения в воде общего числа бактерий и количества кишечной палочки (показатели фекального загрязнения), применяют мембранные ультрафильтры. Применение таких ультрафильтров позволяет вести ускоренные исследования, так как при фильтровании определенного объема воды на поверхности фильтра приблизительно равномерно оседают и распределяются все микробы, находящиеся в данном объеме. Состав фильтров позволяет выращивать осевшие микроорганизмы непосредственно на поверхности фильтров. Колонии, вырастающие на поверхности фильтра, сохраняют присущие им видовые особенности. При таком анализе результаты получают уже через 24 ч. По количеству выросших колоний судят о загрязненности воды.
Нормативы микробиологических показателей приведены в таблице 29.
Таблица 29
Нормативы микробиологических и паразитологических показателей
| Наименование показателя | Единица измерения | Норматив |
| Термотолерантные колиформные бактерии | Число бактерий в 100 см3 | Отсутствие |
| Общие колиформные бактерии 1) 2) | Число бактерий в 100 см3 | Отсутствие |
| Общее микробное число 2) | Число образующих колонии бактерий в 1 мл | Не более 50 |
| Колифаги 3) | Число бляшкообразующих единиц (БОЕ) в 100 см3 | Отсутствие |
| Споры сульфитредуцирующих клостридий 4) | Число спор в 20 см3 | Отсутствие |
| Цисты лямблий 3) | Число цист в 50 дм3 | Отсутствие |
Примечания:1.При определении производится трехкратное исследование по 100 см3 отобранной пробы воды. 2. Превышение норматива не допускается в 95 % проб, отбираемых в точках водоразбора наружной и внутренней водопроводной сети в течение 12 месяцев, при количестве исследуемых проб не менее 100 за год. 3. Определение производится в системах водоснабжения из поверхностных источников перед подачей воды в распределительную сеть. 4. Определение проводится при оценке эффективности технологии обработки воды.
Гельминтологические исследования. При определении степени загрязненности воды открытых водоемов (рек, прудов, озер) яйцами гельминтов пробы воды для исследования необходимо брать выше и ниже места существующего или предполагаемого загрязнения, у берегов и вдали от них. Объем пробы – 10–15 л. Пробу воды в избранном месте надо брать постепенно: по 0,1–1 л через каждые 5 мин как с поверхности воды, так и с глубины 20–50 см, а также на расстоянии 50 см от дна (с помощью батометра). Пробы воды следует брать утром, днем и вечером, а также в разные сезоны. Соблюдение этих правил отбора даст возможность сделать точное и объективное заключение о наличии и степени загрязнения воды яйцами и личинками гельминтов.
Исследуют пробы воды в хорошо оборудованных лабораториях с помощью специальных методов (метод Гнединой и др.) и приспособлений. Наиболее простым является модифицированный метод Васильковой, с помощью которого можно проводить исследования в полевых условиях.
Для анализа бумажные фильтры помещают на дно воронки, сменяя их после пропускания через прибор 0,5–1 л исследуемой воды. Разряжение воздуха в колбе для ускорения фильтрации создается ручным насосом.
Бумажные фильтры с образовавшимся на них осадком осветляют в течение 3–5 мин раствором соляной кислоты и кладут на предметное стекло, соответствующее по размерам фильтру. Для обнаружения яиц гельминтов фильтры исследуют во влажном состоянии под малым увеличением микроскопа.
При отсутствии специального оборудования для исследования воды на яйца глист можно вести путем отстаивания ее в течение суток в высоких цилиндрах. Верхний слой из цилиндра сливают через сифон, старясь не захватить осадок. Осадок переносят в центрифужные пробирки и центрифугируют. Нижний слой жидкости из пробирок переносят каплями на предметное стекло и исследуют под малом увеличении микроскопа. Видовую принадлежность яиц определяют в соответствии с их описаниями в руководствах по паразитологии.
Контрольные вопросы. 1.Как производят отбор проб воды для бактериологического и гельминтологического исследований? 2. Характеристика биологических свойств воды. 3. Санитарно-бактериологические показатели качества воды. 4. Исследования воды на яйца гельминтов.
Дата добавления: 2021-04-07; просмотров: 125; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
