Неводное кислотно-основное титрование. Титрование в кислых и основных растворителях.
Титрование в неводных средах, неводное титрование, - такое титрование, при котором средой служит неводный растворитель с минимальным содержанием воды.
1)Протогенные (кислые, кислотные) растворители - такие растворители, у которых доминирует способность отдавать протоны растворенному веществу, т.е. они обладают протоно-донорными (кислотными) свойствами. К растворителям этого типа относятся безводные серная, муравьиная, уксусная, пропионовая кислоты, жидкий фтористый водород H2F2 и некоторые другие. Такие растворители повышают силу растворенных в них оснований и понижают силу растворенных в них кислот.
2) Протофильные (основные) растворители — такие растворители, у которых доминирует способность принимать протоны — присоединять протоны от растворенных в них веществ, т.е. они обладают протоно-акцепторными (основными) свойствами. К таким растворам относятся жидкие аммиак, амины (например, н-бутиламин), формамид, пиридин, этилендиамин, диметилформамид и некоторые другие. Растворители этого типа понижают силу растворенных в них оснований и повышают силу растворенных в них кислот.
Гравиметрия.
Гравиметрия (весовой анализ) — метод количественного анализа в аналитической химии, который основан на изменении массы определяемого компонента, выделенном в виде веществ определённого состава.
Используется уравнение химической реакции типа: aX + bR = XaRb для получения осадка XaRb
Метод осаждения
Навеску анализируемого вещества растворяют в воде или другом растворителе и осаждают определяемый элемент реактивом в виде малорастворимого соединения. Полученный осадок отфильтровывают, промывают, высушивают, прокаливают и взвешивают. Зная массу осадка, вычисляют содержание определяемого элемента в массовых долях или процентах от взятой навески.
Поскольку осаждённое вещество может не соответствовать тому, что получается после прокаливания, различают осаждаемую и гравиметрическую форму осадка.
Например: CaCl2 + (NH4)2C2O3 = CaC2O3 + 2(NH4)Cl
где CaC2O3 будет являться осаждаемой формой, так как при прокаливании он изменяет свой состав:
CaC2O3 = CaO + CO2↑ + CO↑
Метод выделения
Основан на выделении определяемого компонента из анализируемого вещества и его точном взвешивании. Например определение золы в твердом топливе.
Метод отгонки
В этом методе определяемый компонент выделяют в виде летучего соединения действием кислоты или высокой температуры. Возможны различные варианты этого метода:
определяемый компонент выделяют в виде летучего соединения и поглощают поглотителем. Расчёт ведут по изменению массы поглотителя
отгоняемое вещество отгоняют и отгон (дистиллят) взвешивают
вещество взвешивают, совершают отгон и вновь взвешивают. Расчёт производят по уменьшению массы навески.
Перманганатометрия.

Иодометрия

Иодатометрия.


Хлориодиметрия.
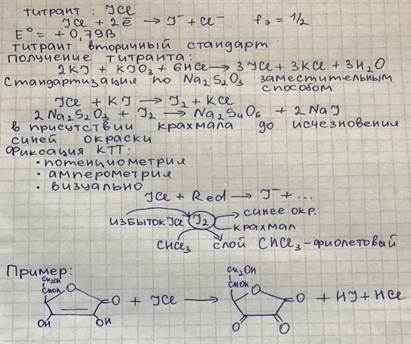
Нитритометрия.
1)Титрант-NaNo2
2) 
Условия:кислая среда,кат.КBr;fэкв.=1;Е=0,98 В
3)Титрант-вторичные стандарт.
Стандартизация по сульфаниловой кислоте:
 Фиксация КТТ:смесь тропеолина оо с метиленовым синим(малинов.-синий) или нейтрального красного(красно-фиолет.-синий).
Фиксация КТТ:смесь тропеолина оо с метиленовым синим(малинов.-синий) или нейтрального красного(красно-фиолет.-синий).
Стандартизация по перманганату калия:
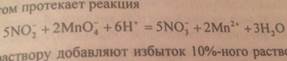

Йод+тиосульфат натрия=…(напишите).Фиксация КТТ:прибавляют небольшое количество крахмала-раствор окрашивается в синий, титрование ведем до исчезновения синей окраски в бесцветную.
4)Применение метода:определяют олово(2),мышьяка(3),железа(2),гидразина,дикаин.
5)Примеры:
: 
Броматометрия.

Иодиметрия.

Цериметрия.
1)Титрант-соли Се(4),Сe(SO4)2
2) 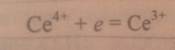
Условия:сильнокислая среда,Е=1,74 В,fэкв.=1(?)
3)Титрант-вторичный стандарт.
Стандартизация по оксалату натрия:

Фиксация КТТ:безиндикаторный способ(ферроин,дифениламин)
4)Применение метода:определяют олово(2),ртуть(1),сурьма(3),железо(2),иодиды,нитриты.
Бромометрия.

Дихроматометрия.

Дата добавления: 2020-04-25; просмотров: 341; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
