Гетерогенные равновесия в аналитической химии. Способы выражения растворимости малорастворимых электролитов.
Гетерогенное равновесие – равновесие, устанавливающее на границе фаз (два типа: осадок какого-либо вещества, находящийся в равновесии с насыщенным раствором того же вещества и две равновесные жидкие фазы: водный раствор и орг. растворитель)
| Способы выражения растворимости малорастворимых электролитов | |
| Массовая растворимость вещества (Сm) – это масса растворенного вещества в граммах, содержащаяся в одном литре его насыщенного раствора. Сm = m/V (г/л) | Молярная растворимость вещества( S ) – количество растворенного вещества, содержащееся в 1 литре его насыщенного раствора. S = m/MV (моль/л) |
6. Произведение растворимости малорастворимого сильного электролита– это величина, равна произведению равновесных активностей (или равновесных концентраций) ионов данного электролита в его насыщенном растворе в степенях, равных соответствующим стехиометрическим коэффициентам.
BaSO4 = Ba2+ + SO42- (в растворе)
ПР (BaSO4) = а(Ba2+)а(SO42-) = [Ba2+][ SO42-]f(Ba2+)f(SO42-)
Условие образования осадков малорастворимых сильных электролитов
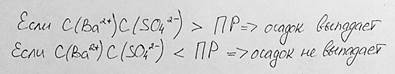
Дробное осаждение и дробное растворение осадков
Дробное осаждение – последовательное осаждение ионов из анализируемого раствора при действии какого-либо общего реагента вследствие различной растворимости образующегося в результате реакции малорастворимого соединения.

Дробное растворение – последовательное растворение ионов из осадка.
Перевод одних малорастворимых электролитов в другие

Влияние посторонних электролитов на растворимость малорастворимых сильных электролитов
Влияние добавок электролита с одноименным ионом на растворимость

Растворимость малорастворимого электролита уменьшается при введении в раствор сильных электролитов, содержащих одноименные ионы с осадком.
Влияние добавок постороннего (индифферентного) электролита на растворимость
При увеличении ионной силы, коэффициент активности f уменьшается (по Деббаю-Хюккелю)
Солевой эффект: растворимость осадков увеличивается при введении в раствор сильных электролитов, не имеющих с осадком общих ионов.
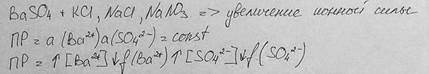
11. Влияние различных факторов на полноту осаждения осадков и их растворение:природа осаждаемого вещества, осадителя, растворителя; концентрация реагентов; температура; рН среды; присутствие посторонних веществ, как имеющих, так и не имеющих одноименные ионы с осадком; характер образующегося осадка (аморфный, кристаллический); возможность протекания побочных реакций.
Протолитические равновесия. Понятие о протолитической теории кислот и оснований.
Протолитическое равновесие – равновесие, в котором участвует протон – ион водорода Н+.
Дата добавления: 2020-04-25; просмотров: 2502; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
