Определение рН анализируемого раствора.
Кислотно-основная классификация катионов по группам. Аналитические реакции катионов различных аналитических групп.(реакции в методичке)
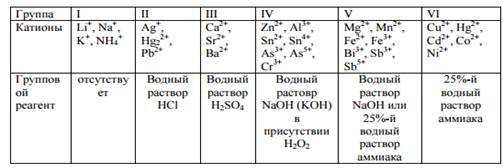
Аналитическая классификация анионов по группам (по способности к образованию малорастворимых соединений). Аналитические реакции анионов различных аналитических групп. (см.методичку.)

Систематический анализ катионов по группам при их совместном присутствии.
Первая группа: Катионы Li+ и NH4+ мешают открытию катионов Na+ и К+, поэтому из анализируемого раствора их нужно удалять. Вначале в отдельных пробах анализируемого раствора открывают катионы Li+ и NН4+, после чего эти ионы удаляют, а в остатке открывают К+, Nа+.

Вторая группа: Открыть ионы дробно в смеси невозможно, т.к. нет избирательного реагента, поэтому проводят систематический анализ.К анализируемому раствору прибавляют на холоде групповой реагент-раствор (2 моль/л) HCI до полного выделения осадка, состоящего из AgCl, Hg2CI2, РиСl2 (если раствор остается прозрачным при добавлении 2 капель НCl, осаждение считается полным).

Третья группа: Вначале проводятпредварительные испытания: в отдельных небольших пробах анализируемого раствора дробно открывают катионы, присутствующие в растворе, учитывая их взаимное влияние друг на друга.
I. Предварительные испытания.
1. Открытие катионов бария (II):
Ва3+ + К2Сr2O7 (в прис. СН3СОО—) → ВаСrО4 ↓ — желтый, осадок не растворяется в разбавленной уксусной кислоте;
2. Sr2+ и Са2+ может открыть, только если нет Ва2+.
Sr3+ + CaSО4 → SrSO4↓ + Са2+ (реакция с гипсовой водой);
Са2+ + K4[Fe(CN)6] + 2 NH4+ → (NH4)2Ca[Fe(CN)6]↓ белый осадок (Sr2+ не мешает);
3. Если нет Ва2+ и Sr2+, то Са2+ + Na2C2O4 → СаС2O4 ↓ белый

Четвертая группа:
I. Предварительные испытания.
1. Открытие Сr3+ (если они присутствуют, раствор должен быть сине-зеленым):
[Cr(H2О)6]3+ (зеленый)+ Н2О2(3%) + NaOH изб. → СrО42- (желтый)
2. Открытие Sn2+:
Sn2+ + NaOH + Bi(NO3)3 (1-2 капли) → Вi ↓ +[Sn(OH)6] 2-
3. Открытие As3+ (AsO33- в растворе):
AsO33- + AgNO3 → Ag3AsO3↓ желтый, аморфный
4. Открытие As5+ (AsO43- в растворе):
AsO43- + AgNO3 = Ag3AsO4 аморфный осадок шоколадного цвета

Пятая группа:
Предварительные испытания.
1. Открытие ионов Fe2+:
4Fe2+ +3 K3[Fe(CN)6] → Fe4[Fe(CN)6]3 +9K+ — темно-синий осадок «турнбуленовой сипи»
2. Открытие ионов Fe 3+ (если ионы присутствуют в растворе, последний имеет желтоватую окраску):
а) 4Fe3+ + 3K4[Fe(CN)6] → Fe4[Fe(CN)6]3 +12K+ — темно-синий осадок «берлинской лазури»
б)Fe3+ + 6SCN— → [Fe(SCN)6]3- — красное окрашивание раствора
3. Открытие ионов Мn2+:
а) Mn2+ + NaBiO3 +Н+ → МnO4— + Bi3+ + Na+
б) Мn2+ + РbO2 + H+ → МnО4— + Рb2+
МnO4—bоны окрашивают раствор в малиновый цвет.
4. Открытие ионов Bi3+ (реакцию проводят о щелочной среде, рH=10):
Bi(OH)3 +[Sn(OH)4] 2- → Bi↓ + [Sn(OH)6] 2- черный

Шестая группа: Перед проведением систематического анализа в отдельных пробах анализируемого раствора можно открыть некоторые катионы с помощью характерных для них реакций.Некоторые выводы можно сделать по окраске анализируемого раствора: так, аквакатионы Ni2+ придают раствору зеленоватую окраску, Со2+ — розовую, Сu2+ — голубую.Отдельную порцию раствора можно обработать водным раствором аммиака и проанализировать окраску раствора, зная, что водные растворы аммиачных комплексов металлов окрашены следующим образом:
[Cu(NH3)4] 2+ — синий;
[Co(NH3)6] 2+ — сине-фиолетовый;
[Co(NH3)4] 2+ — желтый;
[Cd(NH3)4] 2+, [Hg(NH3)4] 2+ — бесцветные.

4. Дробный анализ анионов по группам. Систематический анализ серусодержащих анионов при их совместном присутствии. Систематический анализ галогенид-ионов при их совместном присутствии.
Проводят сначала предварительные испытания:
Определение рН анализируемого раствора.
Если рН < 2, в растворе отсутствуют анионы неустойчивых кислот, разлагающихся в кислой среде, т.е. SO32-, S2O32-, CO32-, S2-, NO2—. При рН < 5 не могут сосуществовать анноны-окислители и анионы — восстановители, например, J— и NO2—, SO32- и МnО4— и так далее, т.к. они взаимодействуют между собой. В щелочной среде могут присутствовать все рассматриваемые анионы.
Дата добавления: 2020-04-25; просмотров: 218; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
