Протолитическая теория кислот и оснований Бренстеда-Лоури.
Кислота – частица вещества, способная быть донором протона, а основание – это частица вещества, способная быть акцептором протона.
Протолиты – переносчики протонов.
HNO3(к-та) + NH3(осн) = NO3- (к-та) + NH4+(осн)
Протолитические равновесия в воде
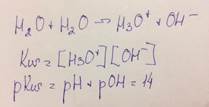
Характеристика силы слабых кислот и оснований.
Слабые кислоты и основания в водных растворах распадаются на ионы лишь в незначительной мере. В их растворе устанавливается равновесие между ионами и непродиссоциированными молекулами.
CH3COOH + H2O = H3O+ + CH3COO-
Поскольку для слабых электролитов степень диссоциации ионы α<< 1, то коэффициенты активности близки к единице, поэтому
Ка = Кс = [H3O+][ CH3COO-]/[ CH3COOH]
Ка - истинная термодинамическая константа химического равновесия
Таким образом, равновесие, устанавливающееся при диссоциации уксусной кислоты в воде, характеризуется константой равновесия Кс, которую можно назвать константой кислотности уксусной кислоты.
15.Константы кислотности, основности и их показатели; рН растворов слабых кислот и слабых оснований.
Константа кислотности и рН растворов слабых кислот
НВ+Н2О= Н3О++ В-
Ка = [H3O+][B-]/[HB]
pH = 0.5(pKa + pCa)
Константа основности и рН растворов слабых оснований
B + H2O = HB+ + OH-
KB= [HB+][OH-]/[B]
pH= 14-0.5(pKb+pCb)
Гидролиз. Константа и степень гидролиза.
Гидролиз – взаимодействие ионов растворенной соли с протонами или гидроксильными группами нейтральных молекул воды (частный случай сальволиза).
Ni2+ + 2H2O = NiOH+ + H3O
Константа гидролиза – константа гидролитического равновесия Кh
Степень гидролиза h – величина, равная отношению числа прогидролизовавшихся ионов nh к общему числу ионов n.
Вычисление значений рН растворов солей, подвергающихся гидролизу (гидролиз аниона слабой кислоты, гидролиз катиона слабого основания, гидролиз соли, содержащей катион слабого основания и анион слабой кислоты).


Гидролиз соли, содержащей катион слабого основания и анион слабой кислоты
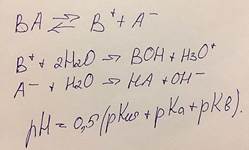
Буферные системы (растворы). Буферная емкость. Использование буферных систем в анализе.
Буферные растворы – растворы, рН которых не изменяется от прибавления ограниченных количеств сильной кислоты или щелочи. Состоят из смеси раствора слабой кислоты и ее соли сильного основания или, наоборот, — слабого основания и его соли сильной кислоты.
Значения рН буферных растворов: буферные системы, содержащие слабую кислоту и ее соль, слабое основание и его соль. Буферная емкость.
Буферные системы, содержащие слабую кислоту и ее соль: ацетатная буферная смесь – водный раствор, содержащий слабую уксусную к-ту и её соль – ацетат натрия.
Ацетат натрия в водном растворе распадается на ионы : СН3СООNа = Na+ + CH3COO-
А уксусная к-та частично: СН3СООН +Н2О = Н3О+ + СН3СОО-
Буферное действие: если в буферную смесь прибавляют небольшой объём сильной к-ты , то ионы водорода этой кислоты, будут связываться с ацетат ионами в уксусную к-ту, которая почти не диссоциирует, баланс ионов водорода почти не нарушается и рН остаётся постоянным. Если к этому же р-ру прибавить щёлочи, то гидроксид ионы будут связываться уксусной к-той и значение рН почти не изменится.
рН = рКа + р(С a/С b)
рКа – константа кислотной диссоциации
Сa –концентрация к-ты
Сb – концентрация соли
Буферные системы, содержащие слабое основание и его соль: аммиачная буферная система. Водный р-р аммиака и хлорид аммония.
Хлорид аммония диссоциирует полностью: NH4Cl = NH4+ + Cl-
Аммиак в водном р-ре в незначительной степени: NH3 + H2O = NH3*H2O = NH4+ + ОН-
Буферное действие: если к аммиачной буферной системе прибавить небольшое кол-во сильной к-ты, то ионы водорода этой к-ты связываются с гидроксильными группами, образующимися при ионизации аммиака. Убыль гидроксо-групп компенсируется за счёт дальнейшей ионизации водного аммиака, рН не изменяется.
Если прибавить небольшое кол-во щёлочи, то гидроксильные группы этой щёлочит связываются катионами аммония с образованием почти не диссоциирующего аммиака, рН снова не изменится.
р H = 14 – pKb - р(С b/С a)
pKb - показатель основности.
Сa –концентрация основания
Сb –концентрация соли
Дата добавления: 2020-04-25; просмотров: 487; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
