Опыт 5.9 Цветная реакция с нитропруссидом натрия
Реактивы, материалы, приборы: 40%-й раствор формальдегида, ацетон, 0,2 н раствор гидроксида натрия, 0,5%-й раствор нитропрус- сида натрия, пробирки, капельницы.
В две пробирки наливают по 5 капель воды и по 2 капли: в одну – ацетона, в другую – формалина. Затем добавляют в каждую по 5 капель 0,5%-го раствора нитропруссида натрия (пентацианонитрозоферроат натрия Na2[Fe(CN)5NO]) и по 2 капли гидроксида натрия. Смесь приобретает красно-фиолетовую окраску наиболее яркую для кетонов, которая через несколько минут в пробирке с ацетоном переходит в желтую.
Наблюдение:
Выводы:
Опыт 5.10 Получение фенолформальдегидной смолы
Реактивы, материалы, приборы: 40%-й раствор формальдегида, фенол, соляная кислота концентрированная, мерные пробирки, кипятильные камешки, нагревательный прибор, пробирки.
Фенол легко конденсируется с формальдегидом в кислой или щелочной среде с образованием высокомолекулярных соединений. В присутствии кислоты в мольном соотношении фенол:формальдегид – 1:1,3 образуются линейные полимеры (резолы).
РАБОТА ПРОВОДИТСЯ ПОД ТЯГОЙ!
К 1 г фенола добавляют 2 см3 40%-го раствора формалина, вносят кипятильный камешек и кипятят 2-3 мин. Затем прекращают нагревание и добавляют 0,1–0,2 см3 концентрированной соляной кислоты. Смесь начинает вновь кипеть и через 2-3 мин мутнеет вследствие выделения тяжелой непрозрачной массы – резольной смолы. При избытке формальдегида получают резольные смолы, содержащие гидроксиметильные группы:
|
|
|
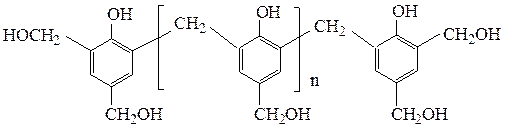
При дальнейшей конденсации резольные смолы (растворимые, легкоплавкие) переходят в резиты (неплавкие, нерастворимые), имеющие сетчатое строение:
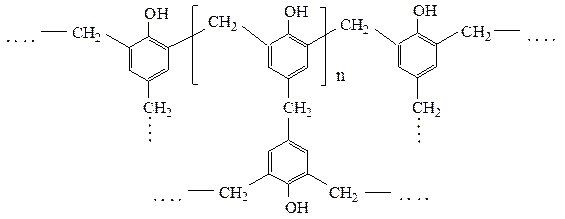
Наблюдение:
Выводы:
Опыт 5.11 Получение мочевино-формальдегидной смолы
Реактивы, материалы, приборы: 40%-й раствор формальдегида, мочевина, 25%-й раствор аммиака, концентрированная соляная кислота, пробирки, кипятильные камешки, спиртовки, капельницы, мерные пробирки, водяная баня.
В присутствии щелочей и избытка формальдегида из мочевины образуются преимущественно моно- и диметилолмочевины, которые образуют в воде вязкие растворы, при нагревании которых происходит поликонденсация с образованием нерастворимых полимеров:
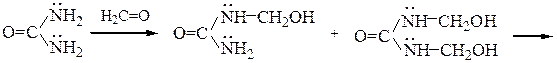
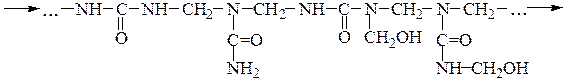
линейный полимер
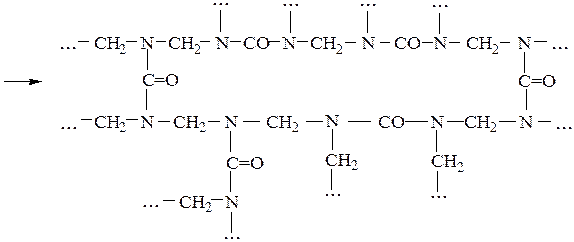
сшитый полимер
В пробирку помещают 1 г мочевины, 4 см3 формалина, 0,5 см3 25%-го раствора аммиака и кипятильный камешек. Под тягой кипятят 2-3 мин, за это время объем жидкости уменьшится на 1/3. После этого добавляют 2-3 капли концентрированной соляной кислоты и нагревают на водяной бане. Отмечают помутнение и образование твердой смолы белого цвета.
|
|
|
Наблюдение:
Выводы:
6 КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ.
ЖИРЫ И МАСЛА
Карбоновые кислоты – органические соединения, содержащие карбоксильную группу R–COOН. Получают их окислением углеводородов (алкены с разрывом двойной связи, боковые цепи аренов и др.), первичных спиртов и альдегидов; гидролизом соединений типа R–ССl3 и функциональных производных (сложные эфиры, амиды, галогенангидриды, ангидриды, нитрилыи др.), а также стандартными схемами из малонового и ацетоуксусного эфиров.
Химические свойства:
- рН водных растворов < 7;
- реагирование с металлами, основными оксидами, щелочами, солями (Na2CO3 и др.);
- бромирование в α-положение радикала;
- образование производных по карбоксильной группе (амиды, ангидриды, галогенангидриды, сложные эфиры, нитрилыи др.);
- восстанавление LiAlH4 до первичных спиртов; пиролиз кальциевых (бариевых) солей с образованием карбонильных соединений.
Жиры представляют собой смеси триацил-, диацил- и моноацилглицеринов – полных и неполных сложных эфиров глицерина и высших карбоновых кислот. В природных жирах в составе жиров встречаются до 50 различных остатков карбоновых кислот.
|
|
|
Дата добавления: 2020-04-08; просмотров: 426; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
