Влияние температуры на скорость, избирательность и выход продукта при протекании сложных реакций.
Для параллельных реакций.
В технологическом процессе протекают параллельно 2 реакции:
k 1 k 2
А----→ В А----→ D ,
из них В – целевой продукт, D – побочный продукт.
Скорости образования этих продуктов описываются уравнениями:
UВ = 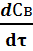 = k1 · Сm 1 А = k01 ·exp [- E1 /( RT ) ]· Сm 1 А
= k1 · Сm 1 А = k01 ·exp [- E1 /( RT ) ]· Сm 1 А
U D = 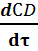 = k2 · Сm 2 А = k02 ·exp [- E2 /( RT ) ]· Сm 2 А (22)
= k2 · Сm 2 А = k02 ·exp [- E2 /( RT ) ]· Сm 2 А (22)
Избирательность по продукту В будет пропорциональна отношению скоростей образования целевого и побочного продукта:
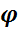 В = U В / U D = [ k01 · Сn 1 А /( k02 ·Сn 2 А) ]· exp [(E2 - E1) /( RT ) ] ; (23)
В = U В / U D = [ k01 · Сn 1 А /( k02 ·Сn 2 А) ]· exp [(E2 - E1) /( RT ) ] ; (23)
Если принять все величины, входящие в уравнение (23)
постоянными, тогда 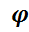 В = exp [Δ E /( RT ) ]
В = exp [Δ E /( RT ) ]
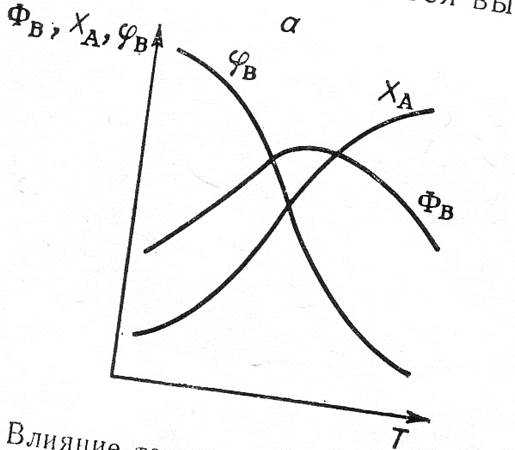
Если энергия активации побочной реакции выше, чем основной, т.е. Δ E >0, то для повышения избирательности необходимо ументьшать температуру. Но если при этом сохраняется неизменным время реакции 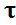 , то уменьшается скорость образования продукта В, степень превращения исходного вещества А и понижается выход целевого продукта.
, то уменьшается скорость образования продукта В, степень превращения исходного вещества А и понижается выход целевого продукта.
Рис. Влияние температуры на избирательность , степень превращения и выход целевого продукта для параллельных реакций, Е2 > Е1
В подобной ситуации задача технолога найти оптимальный вариант снижения температуры, обеспечивающую повышение избирательности при допустимом снижении производительности и выхода продукта.
Если в процессе для параллельных реакций Е1 > Е2 , то увеличение температуры повышает избирательность , степень превращения ХА, выход Ф B и производительность, что отражено на графике.
Рис. Влияние температуры на избирательность , степень превращения и выход целевого продукта для параллельных реакций, Е1> Е2

Для последовательных реакций.
В технологическом процессе протекают последовательно 2 реакции:
k 1 k 2
А----→ В----→ D ,
из них В – целевой продукт, D – побочный продукт.
Скорости образования этих продуктов описываются уравнениями:
UВ = 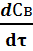 = k1 · СА = k1 ·СА – k2 ·Св (24)
= k1 · СА = k1 ·СА – k2 ·Св (24)
U D = k2 · Св
Т. к. избирательность по продукту В пропорциональна отношению
UВ / U D можно записать:
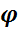 В = U В / U D = k1 · СА / k2 ·Св - 1; (25)
В = U В / U D = k1 · СА / k2 ·Св - 1; (25)
При постоянстве СА и Св избирательность процесса будет тем выше, чем больше отношение k1 / k2, т.е.
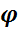 В = k1 / k2 = К01·exp[ - E1 /( RT ) ] /{ k02 · exp[ - E2 / ( RT ) ] } =
В = k1 / k2 = К01·exp[ - E1 /( RT ) ] /{ k02 · exp[ - E2 / ( RT ) ] } =
= А·exp [Δ E / ( RT ) ], где А- постоянная. (26)
При Δ E > 0 для повышения избирательности целесообразно уменьшить температуру, а при Δ E < 0 температуру необходимо увеличивать. Во втором случае при увеличении температуры растет также выход целевого продукта, его количество, получаемое в единицу времени, и степень превращения исходного вещества.
Влияние давления на скорость газофазных процессов.
Влияние давления на скорость реакций и другие показатели гомогенных процессов наиболее сильно проявляется, когда реагирующие вещества находятся в газообразном состоянии.
- Для необратимых реакций увеличение давления приводит к пропорциональному росту концентрации реагирующих веществ, а, следовательно, увеличению движущей силы и скорости процесса в целом.
Например, при реакции аА + bВ → dD скорость можно записать уравнением:
U = k · СА а' ·Св b ' = k · [ Р А / ( RT ) ] а' · [ Р В / ( RT ) ] b ' = k ' · Р А а' ·Р В b ' ; (27)
В соответствии с законом парциальных давлений
РA = NA · Робщ ; Р В = N В · Робщ ;
Следовательно, скорость реакции можно представить, как функцию давления, при котором проводят процесс Робщ:
U = k ' · NA а' · N В b ' · Робщ а'+ b ' = k '·А· Р m общ ; (28)
Из последнего уравнения следует, что с увеличением давления Робщ скорость гомогенного процесса растет пропорционально давлению в степени, равной порядку реакции.Чем выше порядок реакции, чем в большей степени влияние давления на скорость, что отмечено на графике.
Рис. Влияние давления Р на скорость газофазных необратимых реакций различного порядка m .
- Для необратимых реакций влияние давления на движущую силу процесса имеет более сложный характер, так как с увеличением Р растут не только концентрации реагирующих веществ, но и изменяются параметры равновесного состояния, входящие в состав выражения движущей силы. Это равновесные концентрации и равновесная степень превращения.
Движущая сила процесса пропорциональна разности фактической и равновесной концентраций реагента А для реакции аА + b В ⇄ dD, т. е.
СА ~ СА - СА * .
Если данная реакция протекает с уменьшением объема реагирующей смеси ( а + b > d ) , то с увеличением Робщ растетСА и снижаетсяС*А. Скорость реакции возрастает с увеличением давления, при котором протекает реакция. По сравнению с необратимыми реакциями того же порядка влияние роста давления на увеличение скорости обратимых реакций, протекающих с уменьшением объема, происходит в более значительной степени.
Если реакция протекает с уменьшением объема реагирующей смеси
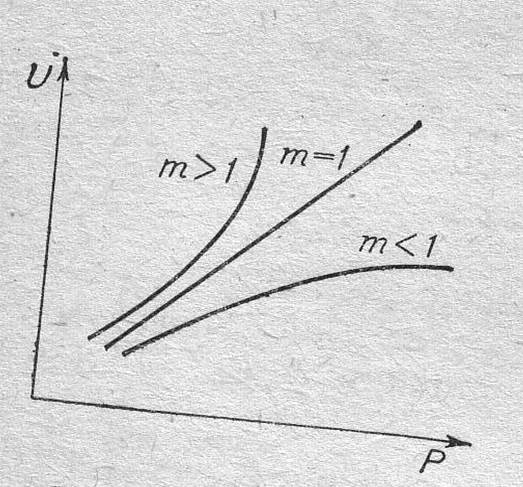
( а + b < d ) , зависимость скорости реакции от давления имеет максимум, что отражено на графике.
Рис. Влияние давления на скорость обратимой реакции, протекающей с увеличением объема.
Оптимальное давление, при котором скорость реакции максимальна, зависит от степени приближения реагирующей смеси к равновесию.
C увеличением степени превращения оптимальное давление уменьшается.
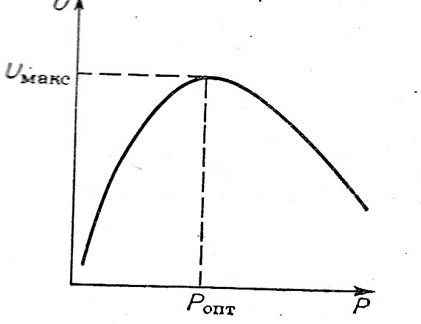
Аналогично изменяются степень превращения исходных реагентов (Х) и выхода продуктов (Ф), согласно графических данных.
Рис. Влияние давления на степень превращения и выход продукта для обратимых реакций, протекающих с увеличением объема
(τ1> τ2> τ3> τ4)
На графике линия MN , соединяющая максимумы на кривых
Х A ,Ф D ( A ) = f (Робщ) называется линией оптимальных давлений. Положение линии оптимальных давлений в координатах Х – Р показывает, что по мере увеличения степени превращения необходимо уменьшать общее или парциальные давления реагентов. На практике для уменьшения парциальных давлений реакционную смесь по мере увеличения степени превращения разбавляют инертным газом или паром.
При проведении параллельных или последовательных реакций влияние давления эквивалентно изменению концентраций реагирующих веществ. Например, повышение давления во всех случаях увеличивает скорость образования целевых и побочных продуктов. Если порядок основной реакции выше, чем побочной, то увеличивается выход целевого продукта и избирательность.
Для гомогенных процессов с жидкой фазой давление процесса оказывает влияние на изменение константы скорости реакции.
Но эта зависимость ощутима лишь при высоких давлениях. Например, полимеризацию этилена осуществляют при давлении свыше 100 МПа.
Порядок реакции по данному веществу, показатель степени при концентрации этого вещества в кинетическом уравнении
U = k · СА n А =·Св n Б
U – скорость реакции
n А , n Б – порядки реакции по веществам А и Б
k – константа скорости реакции.
Величина ( n А + n Б + …) называется общим или суммарным порядком реакции.
Порядок реакции n равен сумме показателей степени у концентраций в уравнении, выражающем зависимость скорости реакции от концентрации реагирующих веществ. Например, для реакции
аА + бБ →rR + sS ± Q скорость прямой реакции выражается уравнением: U =k · СА а · СБ б порядок этой реакции равен n = а + б
Реакции разделяются на реакции первого, второго и третьего порядка. Могут быть реакции , в которых порядок выражается дробным числом, нулем и отрицательным числом.
Порядок каталитических реакций почти всегда ниже, чем их молекулярность. В присутствии катализатора обычно снижается порядок реакции, причем, чем активнее катализатор, тем ниже порядок реакции.
Поэтому кинетика каталитических реакций обычно описывается уравнениями, найденными эмпирически, и порядок таких каталитических реакций выражается как в виде целого, так и дробного числа.
Дата добавления: 2019-11-25; просмотров: 672; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
